CHIP参与高糖介导下的血管内皮细胞损伤*
乔先栋 ,刘 婷 ,洪丽英 ,付勇南 △
(1南昌大学,2江西省高血压研究所,3南昌大学第一附属医院心内科,江西南昌330006)
随着世界人口老龄化的发展,糖尿病患病人数逐年增加,根据2015 年国际糖尿病联盟数据显示,全球糖尿病患者已达4.15 亿,在糖尿病患者的死亡人数中,约1/2患者死于心血管并发症[1-2]。体内较高的血糖可导致血管内皮细胞的损伤继而诱发动脉粥样硬化形成,现今普遍认为炎症反应和氧化应激是高糖血症导致血管内皮细胞损伤的重要机制[3]。
热休克蛋白70羧基末端相互作用蛋白(carboxyl terminus of heat shock protein 70-interacting protein,CHIP)是E3泛素连接酶的一个成员,首先由Ballinger等[4]发现于人的心脏cDNA 文库,也表达于血管内皮细胞,其N 端TPR 结构域能与分子伴侣蛋白相互作用,而C 端U-box 结构域具有E3 泛素连接酶活性,能使疾病相关蛋白质及错误折叠蛋白质泛素化并被降解,从而维持细胞内环境的稳定[4-5]。之前对CHIP的研究大多集中在肿瘤方面,其对不同肿瘤影响差异大[6]。在心血管方面,血管紧张素Ⅱ导致的心肌重塑模型中,过表达CHIP基因小鼠心肌细胞炎症反应和凋亡水平下降[7],提示CHIP 参与炎症发生及细胞凋亡过程。但对CHIP 是否参与高糖(high glucose,HG)介导的血管内皮细胞损伤尚无相关报道。本项工作将通过高糖诱导人脐静脉内皮细胞(human um‑bilical vein endothelial cells,HUVECs)损伤及下调CHIP 表达,初步探讨CHIP 对高糖介导的血管内皮细胞损伤的影响及所涉及的分子机制。
材料和方法
1 细胞提取及处理
提取健康产妇分娩脐带(南昌大学第一附属医院产科提供,标本采集通过孕妇本人知情同意及医院伦理委员会批准),用Ⅱ型胶原酶消化10 min 后加入胎牛血清中和,560×g 离心5 min,弃上清液,得到HUVECs 沉淀后加入内皮细胞培养液(endothelial cell medium,ECM)重悬并置于95%空气/5% CO2孵箱中培养,每 2 d 换 1 次培养液[8]。重组慢病毒 LV-siRNA-NC 和LV-siRNA-CHIP 根据公司提供的方法加入细胞,处理2~3 d稳定后加入不同浓度葡萄糖处理细胞24 h,分为4组:正常糖(normal glucose,NG)+siRNA NC 组、NG+siRNA CHIP 组、HG+siRNA NC 组和HG+siRNA CHIP组。
2 主要试剂及材料
ECM 及配套血清购于 Sciencell;普通 DMEM 培养基、胎牛血清及胰酶购于BI;Ⅱ型胶原酶及PCR试剂盒购于全式金公司;引物和转染病毒由GeneChem合成;葡萄糖粉末及内皮素1(endothelin-1,ET-1)ELISA 试剂盒购于Sigma;红色荧光TUNEL 细胞凋亡检测试剂盒、MTT 细胞增殖及细胞毒性检测试剂盒和超氧化物阴离子荧光探针二氢乙啶(dihydroethid‑ium,DHE)购于碧云天;一氧化氮(nitric oxide,NO)、诱导型一氧化氮合酶(inducible nitric oxide syn‑thase,iNOS)和总超氧化物歧化酶(superoxide dis‑mutase,SOD)测定试剂盒购于南京建成生物工程研究所;CHIP、NADPH 氧化酶(NADPH oxidase,NOX)2、NOX4、p38、p65、p-p38、p-p65、Bax、Bcl-2 及 GAP‑DH抗体购于Santa Cruz。
3 主要方法
3.1 MTT 检测细胞活力 取对数生长期细胞,胰酶消化后调整细胞浓度并取100 µL 细胞悬液接种于96孔板使每孔细胞数为105,细胞融合至70%左右吸去培养液并加入相应浓度葡萄糖培养液继续培养24 h,加入20 µL MTT 溶液孵育4 h,去除培养液,加入DMSO 低速振荡5~10 min,使甲臜完全溶解,使用分光光度计在波长570 nm 处测量各孔吸光度(A)值。每孔设置3 孔并且设置调零孔(无细胞只有培养液)。细胞相对活力(%)=(处理组A值-调零孔A值)/(对照组A值-调零孔A值)×100%。
3.2 细胞凋亡检测 将各组细胞接种于12 孔板,弃上清液,4%多聚甲醛固定30 min,PBS清洗多聚甲醛,加入通透液室温孵育5 min,并加入新鲜TUNEL液,封闭液37℃避光孵育1 h,荧光显微镜下观察,红色为TUNEL 阳性(凋亡细胞),各组设置3个复孔,随机选取40 个非重叠视野,统计凋亡细胞个数及总细胞数。细胞凋亡率(%)=凋亡细胞/细胞总数×100%。
3.3 ET-1检测 超净台吸取各组细胞上清液,配制好相应浓度标准品液,所有样品及试剂置于室温平衡30 min,分别加入100µL 样品和标准品于96 孔反应板并覆盖板贴37℃孵育1 h,去除液体并甩干,加入Ⅰ抗37℃孵育30 min,加入Ⅱ抗室温静置45 min,加入显影液避光慢速振荡30 min,加入终止液立马使用分光光度计在波长450 nm 处测量各组A值。每组设置3 个复孔,并设置调零孔(样品稀释液),计算各组ET-1浓度。
3.4 NO 含量及iNOS 活性检测 各组细胞使用超声波细胞粉碎仪处理后12 000×g离心5 min 取上清液。立即用于实验,按照NO 及iNOS 试剂盒说明加入相应试剂操作,分光光度计测定A值并计算各组NO含量及iNOS活性。
3.5 氧自由基水平及SOD 活性检测 各组处理细胞孵育24 h 后去除上清液,PBS 清洗,加入含10 mmol/L 浓度DHE 的无血清培养液,37℃避光孵育30 min,PBS清洗3次,荧光显微镜下拍照。超声波细胞粉碎仪破碎细胞,12 000×g离心 5 min 取上清液,20µL 样品加入96 孔板,加入 SOD 测定试剂,37℃孵育20 min,450 nm 波长下测定A值,根据说明书计算SOD活性。
3.6 RT-qPCR TRIzol 法提取总 RNA,检查 RNA 纯度及质量,按照逆转录试剂盒说明书进行总cDNA合成,并按照定量试剂盒进行操作,以20µL 反应体系进行 PCR 扩增,2 µL cDNA 加入上、下游引物各 0.4µL 后在 ABI Prism 7500 Real-Time PCR System 上操作。反应条件如下:95℃ 15 min;95℃ 10 s,60℃20s,72℃ 30 s,40 个循环。重复实验 3 次。采用2-ΔΔCt公式计算目的mRNA 相对表达量。单核细胞趋化蛋白1(monocyte chemotactic protein1,MCP-1)上游引物序列为 5′-TGCAGAGGCTCGCGAGCTA-3′,下游引物序列为5′-CAGGTGGTCCATGGAATCCT‑GA-3′;白细胞介素8(interleukin-8,IL-8)上游引物序列为5′-ACTGAGAGTGATTGAGAGTGGAC-3′,下游引物序列为 5-AACCCTCTGCACCC-AGTTTTC-3′;GAPDH 上 游 引 物 序 列 为 5′-GTCTTCACTACCATG‑GAGAAGG-3′,下 游 引 物 序 列 为 5′-TCATGGAT‑GACCTTGGCCAG-3′。
3.7 Western blot 使用含有蛋白酶抑制剂的裂解液提取总蛋白,BCA 法检测各蛋白浓度,加入loading buffer煮10 min置于-80℃储存。按照Western blot步骤对蛋白样品电泳及电转,5%脱脂牛奶封闭1 h,加入抗 CHIP、NOX2、NOX4、p38、p65、p-p38、p-p65、Bax、Bcl-2 及GAPDH 抗体,4℃孵育过夜,加入Ⅱ抗室温下孵育2 h。加入发光液使用Quantity 4000 仪器曝光。ImageJ软件评估相对蛋白表达水平。
4 统计学处理
采用SPSS 15.0 软件进行统计分析。数据以均数±标准差(mean±SD)表示,组间数据采用Satterth‑waite校正后行t检验进行统计学分析。以P<0.05为差异有统计学意义。
结 果
1 HUVECs形态及CHIP的表达
正常原代HUVECs 呈鹅卵石样,培养2 d 后细胞融合达80%,取第2~6 代细胞用于实验,光镜下可见HG+siRNA NC 组细胞形态改变,数量较NG+siRNA NC 组减少,而HG+siRNA CHIP 组细胞数量则较HG+siRNA NC 组进一步减少,见图1A。Western blot显示,分别与NG+siRNA NC 组和HG+siRNA NC 组相比 ,NG+siRNA CHIP 和 HG+siRNA CHIP 组 细 胞 中CHIP表达均显著下调(P<0.05),见图1B。
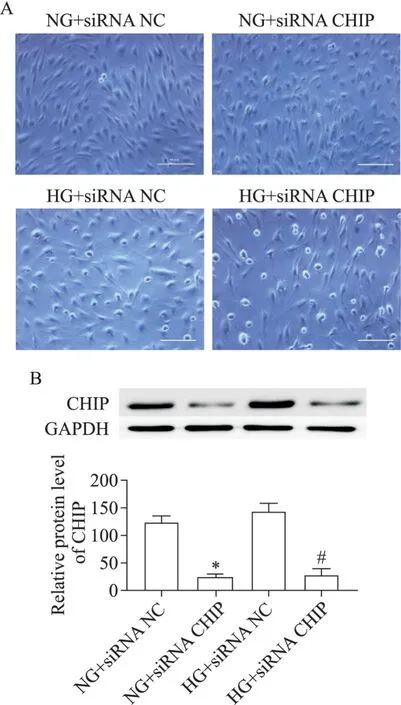
Figure 1.The morphological changes of HUVECs(A;scale bar=50 µm)and the protein expression of CHIP(B).Mean±SD. n=3.*P<0.05 vs NG+siRNA NC;#P<0.05 vs HG+siRNA NC.图1 HUVECs形态及CHIP的表达
2 CHIP对HUVECs活力及凋亡率的影响
与5.5 mmol/L 葡萄糖组相比,5.5 mmol/L 葡萄糖+20 mmol/L 甘露醇对细胞活力的影响差异无统计学意义(P>0.05),见图2A。以此结果可排除渗透压对实验的干扰。而25.5 mmol/L 葡萄糖显著降低细胞活力,并提高细胞凋亡率(P<0.05),见图2A、B。与 HG+siRNA NC 组相比,HG+siRNA CHIP 组细胞活力显著降低,凋亡率显著提高(P<0.05),Bax 表达增加及Bcl-2表达减少(P<0.05),见图2A~C。

Figure 2.Effects of CHIP on the viability and apoptosis rate of HUVECs.A:the cell viability was detected by MTT assay;B:the apoptosis was detected by TUNEL staining(×100);C:the protein expression of Bax and Bcl-2 was determined by Western blot.Mean ±SD. n=3.△P<0.05 vs 5.5 mmol/L glucose;*P<0.05 vs NG+siRNA NC;#P<0.05 vs HG+siRNA NC.图2 CHIP对HUVECs活力及凋亡率的影响
3 CHIP 对 HUVECs 内 ET-1 和 NO 含量及 iNOS 活性的影响
与 NG+siRNA NC 组相比,HG+siRNA NC 组 ET-1和 NO 含量及 iNOS 活性增加(P<0.05);而 HG+siRNA CHIP 组 ET-1 和 NO 含 量及 iNOS 活性相 较 于HG+siRNA NC组进一步增加(P<0.05),见图3。
4 CHIP 对 HUVECs 内活性氧簇(reactive oxygen species,ROS)水平、NOX表达及SOD活性的影响
与 NG+siRNA NC 组相比,HG+siRNA NC 组细胞内ROS 水平升高(P<0.05),NOX2 及 NOX4 蛋白表达水平升高(P<0.05),同时 SOD 活性降低(P<0.05);与 HG+siRNA NC 组相比,HG+siRNA CHIP组细胞内ROS水平升高(P<0.05),NOX2及NOX4蛋白表达水平升高(P<0.05),SOD 活性降低(P<0.05),见图4。
5 CHIP对HUVECs内炎症因子水平的影响
与 NG+siRNA NC 组相比,HG+siRNA NC 组细胞内炎症因子 IL-8 和 MCP-1 的 mRNA 水平升高(P<0.05);HG+siRNA CHIP 组炎症因子IL-8和MCP-1的mRNA 水平相较于 HG+siRNA NC 组显著增加(P<0.05),见图5。
6 CHIP对HUVECs内p65和p38磷酸化水平影响
与 NG+siRNA NC 组相比,HG+siRNA NC 组 p65和 p38 磷酸化水平增加(P<0.05);而 HG+siRNA CHIP 组p65和p38磷酸化水平相较于HG+siRNA NC组显著升高(P<0.05),见图6。

Figure 3.Effects of CHIP on the levels of ET-1,iNOS and NO in HUVECs.Mean±SD. n=3.*P<0.05 vs NG+siRNA NC;#P<0.05 vs HG+siRNA NC.图3 CHIP对HUVECs内ET-1、iNOS及NO水平的影响
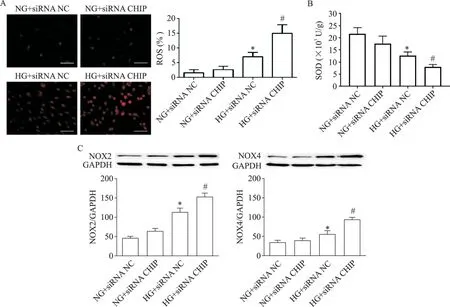
Figure 4.Effect of CHIP on ROS level,SOD activity and NOX expression in HUVECs.A:the ROS level was detected by fluores‑cence probe dihydroethidium under fluorescence microscope(scale bar=50 µm);B:the activity of SOD was detected by SOD kit;C:the protein expression of NOX2 and NOX4 was determined by Western blot.Mean±SD. n=3.*P<0.05 vs NG+siRNA NC;#P<0.05 vs HG+siRNA NC.图4 CHIP对HUVECs内ROS水平、SOD活性及NOX表达的影响
讨 论
糖尿病导致血管内皮细胞损伤以及动脉粥样硬化形成涉及分子机制众多,目前普遍认同的通路包括多元醇通路活化、晚期糖基化终末产物(advanced glycosy lation end products,AGEs)形成增加、蛋白激酶C活化以及己糖胺通路激活等[9],但最终内皮细胞损伤都有炎症反应和氧化应激反应参与,炎症反应和氧化应激贯穿整个动脉粥样硬化的发生、发展。血管内皮细胞炎症反应和氧化应激能刺激脂质积累、巨噬细胞迁移以及血管平滑肌细胞的增生从而促进动脉粥样硬化形成[10]。

Figure 5.The mRNA expression of IL-8 and MCP-1 detected by RT-qPCR.Mean±SD. n=3.*P<0.05 vs NG+siRNA NC;#P<0.05 vs HG+siRNA NC.图5 CHIP对HUVECs内炎症因子mRNA表达的影响

Figure 6.Effects of CHIP on the phosphorylation levels of p65 and p38 in HUVECs.Mean±SD. n=3.*P<0.05 vs NG+siRNA NC;#P<0.05 vs HG+siRNA NC.图6 CHIP对HUVECs内p65和p38磷酸化水平的影响
目前普遍认为CHIP 参与心肌细胞炎症发生和氧化应激并影响细胞存活率,但尚无CHIP 在高糖引起的血管内皮细胞损伤中的研究。在本实验中,通过MTT检测和TUNEL 染色法,我们观察到下调CHIP表达确实增加高糖介导的脐静脉内皮细胞的凋亡率和死亡率,证实了CHIP 可以影响高糖导致的脐静脉内皮细胞损伤。根据CHIP 对心肌细胞的影响,我们猜测CHIP 可能通过影响血管活性物质、氧化应激及炎症反应参与高糖介导的脐静脉内皮细胞损伤。
NO 是重要血管活性物质,可缓解炎症反应和氧化应激,对抗ET-1 收缩血管效应,从而改善血管功能。NO 合成主要依靠内皮型一氧化氮合酶(endo‑thelial nitric oxide synthase,eNOS)和iNOS,高糖刺激早期,iNOS 大量表达并产生过多NO,增加细胞氧化应激水平[11-12]。大多数研究注重高糖处理后晚期eNOS 表达水平而忽视iNOS 早期的表达,少量研究发现 CHIP 能影响iNOS 在细胞内活性[13]。而ET-1 同样在高糖处理的血管内皮细胞中高表达并且参与动脉粥样硬化形成。基于此,本实验进一步研究CHIP是否影响高糖处理的脐静脉内皮细胞iNOS 和ET-1水平,结果表明CHIP 可以影响高糖刺激的脐静脉内皮细胞早期iNOS 和ET-1 活性进而对血管功能产生影响。
另一方面,NOX途径是重要的ROS来源,当葡萄糖含量在细胞内较高状态下,细胞内不仅AGEs含量升高,还可因糖酵解过程分解葡萄糖而产生过多的二酰甘油,在AGEs和二酰甘油等物质刺激下蛋白激酶C 活化增加,进而导致NADPH 表达增加。抗氧化物质SOD 可以清除细胞内多余氧自由基从而维持细胞内氧化平衡。因此SOD 可以作为细胞抗氧化能力指标[14].本研究中,高糖培养后脐静脉内皮细胞胞质内 NOX2、NOX4 和 ROS 水平增加,SOD 活性下降。说明高糖处理脐静脉内皮细胞内氧化应激水平增加,而下调CHIP 处理细胞24 h 后,脐静脉内皮细胞氧化损伤加重,证实CHIP 可参与高糖介导的脐静脉内皮细胞氧化应激反应。
研究表明,糖尿病患者体内心肌细胞及内皮细胞 p38 及 p65 活化增加,而抑制 p38 和 p65 的活化能降低细胞内炎症反应和凋亡水平[15-16]。p65和p38以无活性形态存在于细胞质,当受到晚期糖基化终末产物、缺氧等刺激后磷酸化激活并迁移至细胞核,激活炎症因子、凋亡蛋白等靶基因的转录,启动炎症反应并介导细胞凋亡[17-18]。研究显示CHIP能影响心肌细胞 p38 和 p65 活性[19],而本实验 p38 和 p65 发现下调 CHIP 可增加 HUVECs 内 p38 和 p65 磷酸化及炎症因子MCP-1 和IL-8 转录水平和凋亡蛋白Bax 表达水平,但减少Bcl-2 蛋白表达,并发现下调CHIP 增加脐静脉内皮细胞内炎症因子和凋亡蛋白表达。说明CHIP 可通过影响p38 和p65 活化而参与高糖介导的脐静脉内皮细胞炎症反应和凋亡。当然,CHIP 是否可以调控其它因子从而影响炎症反应和细胞凋亡有待深入研究。
综上所述,在高糖导致的血管内皮细胞损伤过程中,CHIP可以通过影响炎症反应、氧化应激、凋亡蛋白以及血管活性物质参与损伤过程,下调CHIP 表达可加重血管内皮细胞损伤,其对血管内皮细胞炎症反应、细胞凋亡影响机制可能与调控p65 和p38 磷酸化水平有关,而上调CHIP 表达是否改善高糖介导的血管内皮细胞损伤未知,有待进一步研究。

