宫颈鳞状上皮FoxM1及Cdc25B细胞核内蛋白水平与高危型HPV感染的相关性研究
梁 琳,万晓春,危 平,常 彬,向礼兵,朱琳琳,平 波
1.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032
宫颈癌是最常见的妇科恶性肿瘤,其中宫颈鳞癌(squamous cell carcinoma,SCC)最多见,宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)为宫颈鳞癌的癌前病变。宫颈细胞学与高危型人乳头状瘤病毒(high-risk human papilloma virus,hrHPV)检测是目前宫颈癌筛查的主要方法,虽然细胞学和hrHPV检测分别有灵敏度和特异度相对较低的局限性。此外,上述联合检查在大规模人群筛查中成本高昂,反观超80%的宫颈癌发生于发展中国家,20年来中国宫颈癌发病率和死亡率呈逐年升高趋势[1],中国宫颈癌筛查人群覆盖率仅21.4%[2]。因此仍需寻找高性价比的新方法和筛查策略。
HPV与宫颈癌/癌前病变发生关系密切,其基因组中E6和E7为癌基因,二者的转录受HPVE2基因编码蛋白抑制。转录因子FoxM1参与细胞增殖和细胞周期调控,并在恶性肿瘤发生、发展中发挥重要作用。Thierry等[3]和Pang等[4]分别在HPV16和HPV18阳性的细胞系中过表达HPV E2后发现FoxM1基因表达下降[3-4]。有报道在不同器官来源的细胞系中发现HPV E6有调节FoxM1基因和蛋白水平的功能,虽然此二项研究否定HPV E7对FoxM1表达有调控作用[5-6],有证据表明,细胞系中改变HPV E7表达水平可调节FoxM1蛋白的表达[4,7-8]。免疫组织化学(immunohistochemistry,IHC)检测已发现FoxM1蛋白可表达于人宫颈癌及其癌前病变组织,但很多IHC研究或未同时检测HPV表达[9-15],或仅检测了少量病例的HPV16和18[16],或对FoxM1蛋白的细胞质和胞核表达混合评价,甚至不予区分[11,14,16-17]。因此,为发掘新的HPV感染状态替代性标志物,本研究验证FoxM1蛋白在细胞核内的表达与HPV在体内宫颈鳞状上皮中表达的相关性,并检测FoxM1基因下游主要以核蛋白形式参与细胞周期调控的Cdc25B的表达。
1 资料和方法
1.1 病例收集
经复旦大学附属肿瘤医院医学伦理委员会审核,收集来自复旦大学附属肿瘤医院病理科资料库2007—2009年间宫颈活检、锥切或全子宫切除石蜡包埋标本。入组标准:①所有病例均无其他恶性肿瘤病史;② 正常(含炎症)组织必须来源于既往无宫颈癌及CIN病史,且无细胞学异常病史的患者;③正常或CIN患者经过6个月随访,未出现更高级别病变者;④ 经连续切片首尾张H-E染色保留鳞状上皮(正常标本)和病灶(CIN及以上标本);⑤ 提取DNA的内参为阳性;⑥ 获得患者或家属签署的知情同意书。
1.2 HPV DNA检测
使用中国国家药品监督管理局(National Medical Products Administration,NMPA)认证的聚合酶链反应(polymerase chain reaction,PCR)-反向点杂交法HPV基因分型检测试剂盒[亚能生物技术(深圳)有限公司],按厂商说明对石蜡切片进行检测和结果判读(图1),可检测23种HPV亚型,包括HPV 16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、83、MM4、6、11、42、43和44。

图1 PCR-反向点杂交法HPV基因分型检测Fig.1 HPV genotyping by PCR-reverse dot blot
1.3 IHC检测
石蜡包埋组织按3 µm厚度连续切片,常规脱蜡至水。采用EnVision+两步法和二氨基联苯胺(diaminobenzidine,DAB)显色,一抗来源、抗原修复条件及稀释浓度见表1,抗原修复液均为0.01 mol/L pH=6.0的枸橼酸缓冲液,二抗及DAB均购自丹麦DAKO公司。
IHC结果阳性标准如下:
①FoxM1、Cdc25B和Ki-67:棕黄色颗粒着色于细胞核,鳞状上皮自基底层向上,着色超出全层下1/3为阳性;② P16INK4a(P16):棕黄色颗粒着色于细胞核或细胞核加细胞质,鳞状上皮自基底层向上,着色超出全层下1/3,并为连续且强的着色(弥漫块状着色)为阳性,局灶、斑片状或单个细胞着色不计为阳性,仅有细胞质着色不计为阳性[18]。
1.4 统计学处理
采用SPSS 15.0统计软件对数据进行分析。通过Jonckheere-Terpstra检验分析指标与病变程度之间关系;利用Spearman相关性分析评价指标间相关性;构建受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC)及灵敏度和特异度,评价各指标诊断效果。P<0.05为差异有统计学意义。

表1 一抗来源、抗原修复条件及稀释浓度Tab.1 Primary antibodies,antigen retrieval and dilution
2 结果
2.1 临床病理学资料
符合入组条件病例共140例,包括正常组22例、CIN1组28例、CIN2/3组50例(CIN2和CIN3分别为3例和47例)、SCC组40例,CIN2+(CIN2/3和SCC)病例共90例。患者年龄分布为22~75岁,中位和平均年龄分别为43和43.81岁。
2.2 HPV感染及IHC检测结果在不同级别宫颈病变组织中的分布
对140例标本的23种HPV基因型DNA检测显示HPV阳性率总计为82.86%(116/140)。将HPV16、18、31、33、35、39、45、51、52、56、58、59、66和68定义为14种hrHPV型别,hrHPV阳性率为82.14%(115/140)。感染HPV16和18(HPV16/18)者共计103例。14种hrHPV及HPV16/18在正常组、CIN1、CIN2/3及SCC中的阳性率随宫颈病变严重程度加剧而上升(Jonckheere-Terpstra检验,P均<0.000 1,表2)。此外高危型中单一型别感染者75例,其中HPV16、18和其他型别感染分别为61例、3例和11例(包括5例HPV58,3例HPV33,HPV56、HPV52及HPV31各1例)。低危型HPV单一基因型感染仅1例,为HPV11感染。无任何HPV感染者24例。
细胞核中FoxM1和Cdc25B蛋白在不同级别宫颈病变中的典型表达图像见图2。两者与Ki-67及P16的阳性率亦均随宫颈病变程度加剧而上升(Jonckheere-Terpstra检验,P<0.000 1,表2)。50%的CIN1病例FoxM1和Cdc25B阳性,P16和Ki-67阳性率亦分别高达35.71%和46.43%。CIN2+中FoxM1、Cdc25B、P16和Ki-67阳性率分别为100.00%(90/90)、94.44%(85/90)、85.56%(77/90)和97.78%(88/90),其中13例P16阴性者均为CIN2/3病例,FoxM1阳性率为100.00%(13/13),CdC25B和Ki-67则均为92.31%(12/13)。联合检测P16与其他生物标志物,P16和(或)其他标志物阳性即为联合标志阳性,可见除SCC外,其他类别阳性率均较单独检测P16有不同程度的提高(表2)。

表2 140例宫颈组织中HPV DNA和IHC检测结果分布Tab.2 Results of HPV DNA and immunohistochemical tests for 140 uterine cervical specimens[n (%)]

图2 FoxM1、Cdc25B、P16和Ki-67在宫颈鳞状上皮中的免疫组化染色Fig.2 Immunohistochemistry of FoxM1,Cdc25B,P16 and Ki-67 in uterine cervical squamous epithelium
2.3 细胞核FoxM1和Cdc25B蛋白水平与hrHPV感染、P16及Ki-67阳性率的相关性检验
采用Spearman相关性检验分析由64例仅有HPV16或仅有HPV18感染以及24例无任何HPV感染的病例构成的病例组(HPV16或18,表3)。在此组88个病例中,HPV感染与细胞核FoxM1及Cdc25B蛋白水平均呈较好的相关性,Spearman相关系数(rho值)分别为0.842和0.757(P<0.000 1,表4)。随后对11例其他hrHPV单一型别感染及24例无任何HPV感染者构成的病例组(其他型别)进行分析,发现这些HPV类型的感染与细胞核FoxM1及Cdc25B蛋白表达亦有较强的相关性(P<0.000 1,表3~4)。进一步分析14种hrHPV单一及混合型别感染及无任何HPV感染者构成的病例组(14种hrHPV),相关性依然存在(P<0.000 1,表3~4)。此外,4种标志物表达在相互之间也有较强相关性,尤其FoxM1与Ki-67和Cdc25B之间相关性最强,rho值分别高达0.909和0.840(P<0.000 1,表5)。
2.4 IHC与hrHPV DNA检测的诊断效果评价
包含FoxM1和14种hrHPV的单独或联合标志的检测灵敏度和阴性预测值(negative predicative value,NPV)均达100%,单独P16检测最低,灵敏度和NPV分别为为85.56%和75.47%,P16与其他标志物的联合检测灵敏度和NPV均提高(98.89%~100.00%)。P16特异度为80.00%,高于其他单独或联合检测(48.00%~72.00%,表6)。14种hrHPV及联合P16检测的AUC值最低,分别为0.750和0.740,其他标志物AUC值范围高达0.822~0.850(图3,表6)。

表3 hrHPV感染情况Tab.3 hrHPV infection of the patients[n (%)]
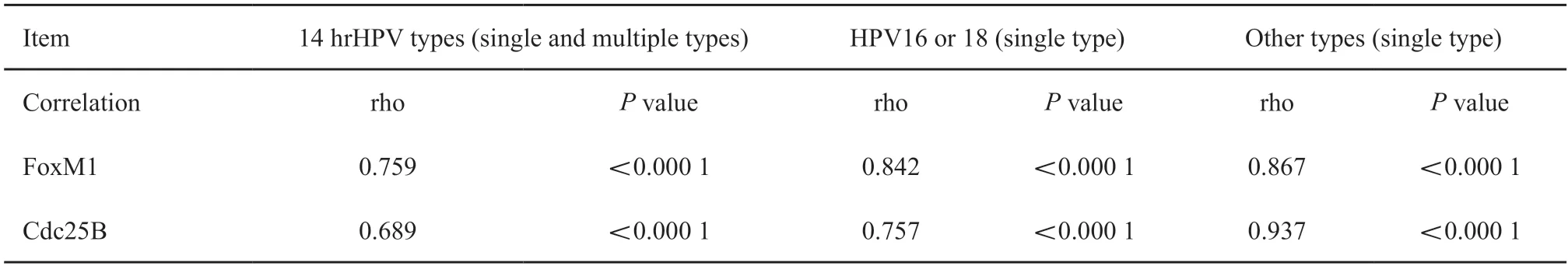
表4 hrHPV感染与细胞核FoxM1和Cdc25B蛋白过表达的Spearman相关性检验Tab.4 Spearman’s correlation between hrHPV infection and nuclear expressions of FoxM1 and Cdc25B
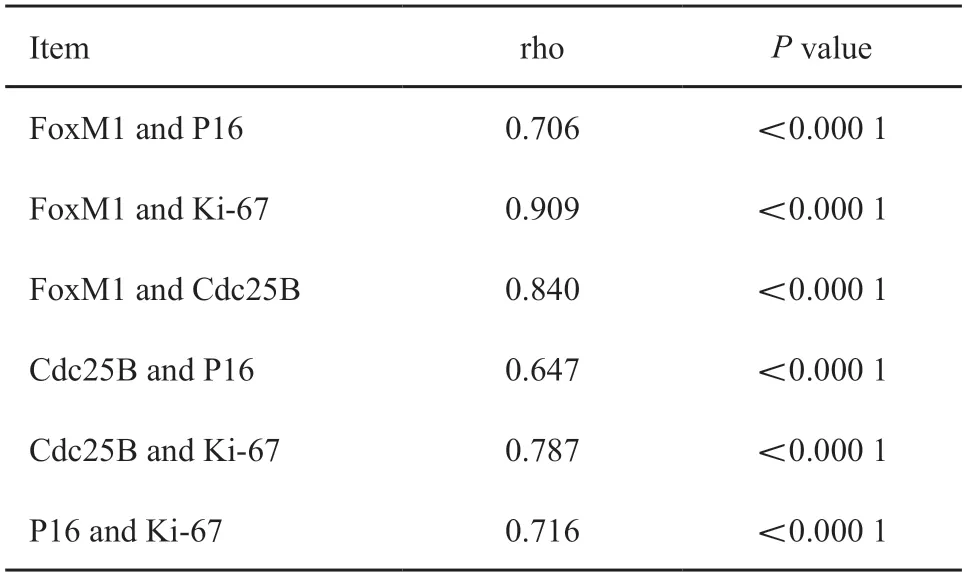
表5 FoxM1、Cdc25B、Ki-67和P16蛋白水平的Spearman相关性检验Tab.5 Spearman’s correlation test for expressions of FoxM1,Cdc25B,Ki-67 and P16
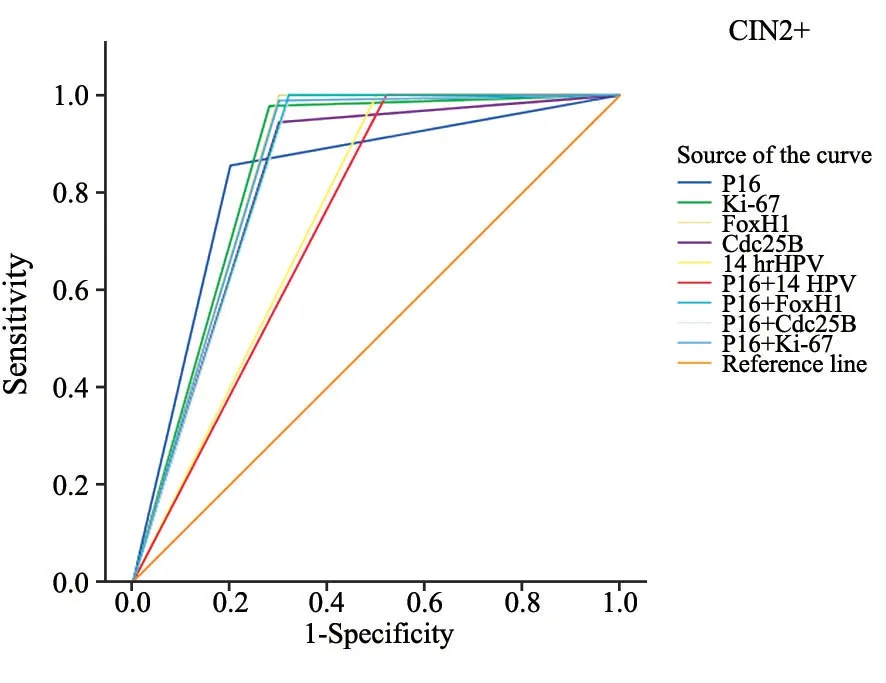
图3 宫颈标本中各生物标志物对CIN2+诊断效果的ROC曲线Fig.3 ROC curves for the performance of different biomarkers evaluating CIN2+in the uterine cervical specimens

表6 各生物指标诊断CIN2+病变的效果Tab.6 Diagnostic performance of different biomarkers for CIN2+
3 讨 论
转录因子FoxM1在细胞周期循环中对G1/S和G2/M转换相关的重要基因进行转录调控,功能与细胞增殖高度相关,并涉及有丝分裂、凋亡、染色体分离及DNA损伤修复等多环节,在肿瘤发生、发展中具有重要地位[8]。细胞周期不同阶段中,FoxM1蛋白在细胞质之间穿梭,其进入细胞核实施转录调控需要促有丝分裂信号刺激及Raf/MEK/MAPK通路活化[19-20]。有文献[16]报道,宫颈癌的FoxM1蛋白水平与HPV感染无显著相关性,然而该文对FoxM1蛋白的细胞质和细胞核表达进行了混合评分,且仅提供了HPV16和HPV18的感染状况[16],可能是导致结果差异的原因。
磷酸酶基因Cdc25B在细胞周期中是重要的G2/M转换相关基因,受FoxM1转录活化[21],有报道Cdc25B基因水平可因过表达HPV E2而被抑制或因过表达E7而被上调,且HPV16 E7被招募到Cdc25B基因启动子区域[4]。本研究对宫颈组织中Cdc25B核蛋白进行了IHC检测,发现其表达不仅与细胞核FoxM1蛋白表达相关,也与HPV感染具有相关性,与体外研究结果相符。
由于体外HPV对FoxM1和Cdc25B的调控研究主要经表达或敲除HPV16或HPV18 E6/E7的方法,而人宫颈组织中感染HPV的基因型多样,并可为单一或多型别感染,我们着意分析了HPV16和18以外的hrHPV单一型别感染是否有类似相关性。虽然病例数较少,但在11例其他hrHPV单一型别感染(包括5例HPV58,3例HPV33,HPV56、HPV52及HPV31各1例)及24例无任何HPV感染者构成的病例组中,依然可见这些型别感染与细胞核FoxM1及Cdc25B蛋白表达有较强的相关性,Spearman相关系数分别为0.867和0.937,要考虑不同型别的hrHPV均可能有上述调控作用。
FoxM1和Cdc25B的IHC判断标准中,关于“鳞状上皮自基底层向上,着色超出全层下1/3为阳性”的要求考虑了HPV E6/E7蛋白在鳞状上皮黏膜层空间分布的特点,即自基底层至颗粒层表达渐增高[22]。对于诊断CIN2+,4个IHC标志物特异度和AUC值均高于14种hrHPV DNA检测,可能一方面它们比临床最常使用的HPV DNA检测更能体现HPV致癌基因E6/E7的功能状态,另一方面宫颈癌及其癌前病变发病机制中可能存在hrHPV感染以外的其他促肿瘤发生、发展的因素,并调控了这些蛋白的表达。本研究结果显示,FoxM1、Cdc25B与P16及Ki-67均具相关性,尤其FoxM1与Ki-67的相关系数最高,达0.909(P<0.000 1),且判断CIN2+的灵敏度、特异度和AUC等数据都非常相近,提示细胞核FoxM1蛋白表达可能是与Ki-67相仿的细胞增殖标志物,与其生物学功能符合。Meta分析结果显示,P16在CIN2和CIN3的阳性率分别为68%和82%[23],本研究CIN2/3中P16阳性率为74%(37/50),与之相仿。P16联合其他标志物后诊断CIN2+灵敏度和NPV均提高。4种蛋白在宫颈CIN和SCC中过表达可能机制兼具共性及差异,由此联合IHC检测可能弥补P16对CIN2/3确诊率的问题。文献报道,至少1/3的CIN1中P16呈阳性[18,23]。目前组织学标本中并不推荐P16单独使用,可用于辅助CIN2/3及其形态学改变相似者的鉴别诊断,而非形态学上明确的正常、CIN1或CIN3病变[18]。故细胞核内FoxM1和Cdc25B蛋白检测结果应同样需结合形态学表现。
综上所述,人宫颈鳞状上皮中细胞核FoxM1和Cdc25B蛋白水平与hrHPV感染相关,有望作为诊断与鉴别诊断CIN2+的潜在辅助指标,其实际临床应用价值仍有待更大样本量临床试验的验证。

