SOCS1的表观遗传学修饰与急性髓系白血病的关系
张晓慧,罗建民,索晓慧,孙国锋,刘洪峰,李 静,牛广旭
1.河北省邯郸市中心医院血液内科,河北 邯郸 056001;
2.河北医科大学第二医院血液内科,河北 石家庄 050000;
3.河北省邯郸市中心医院肿瘤内科,河北 邯郸 056001;
4.河北省邯郸市中心医院病理科,河北 邯郸 056001
细胞因子信号转导抑制因子1(suppressor of cytokine signaling 1,SOCS1)基因是细胞因子信号转导抑制因子家族中的重要成员,是一类调节细胞信号转导通路的蛋白,它通过负反馈调节细胞信号的转导来发挥生物学功能。SOCS1被公认为抑癌基因,近年多项研究发现,SOCS1的启动子是位于该基因5’端功能区的CpG岛,它的表观遗传学修饰会导致SOCS1表达沉默,表达沉默的SOCS1基因在致癌过程中发挥重要的作用[1],特别是在造血系统的恶性肿瘤和增殖性疾病中[2]。本研究旨在明确SOCS1基因的甲基化和组蛋白去乙酰化致使其表达沉默与急性髓系白血病(acute myeloid leukemia,AML)发生、发展的关系。
1 材料和方法
1.1 研究对象
2016年2月—2018年12月邯郸市中心医院血液内科和河北医科大学第二医院血液内科收治的110例AML患者和10名健康志愿者。患者的一般情况见表1。初治(initial treatment,IT)组为AML初次就诊未进行任何治疗的患者,复发难治(relapsed/refractory,RR)组为治疗后再次复发或两个疗程仍未缓解的AML患者,缓解(remission,RE)组为经过治疗后达到完全缓解的患者,正常对照组(normal control group,NC)为健康志愿者。AML的诊断和分型按照法国-美国-英国(French-American-British,FAB)标准进行,包括M0(2例)、M1(9例)、M2(50例)、M4(36例)、M5(13例)。研究标本均取自骨髓单个核细胞。
1.2 随访观察指标
从疾病确诊之日开始计算生存期,对所有患者采用电话、门诊、住院等方式随访至2019年8月31日。总生存期(overall survival,OS)定义为患者从确诊开始至死亡的日期(月),无事件生存期(event-free survival,EFS)定义为患者从接受治疗开始至疾病进展、反复或死亡的日期(月)。完全缓解(complete remission,CR)按照美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)评价标准判定。
1.3 细胞培养
AML细胞系U937和THP-1购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。U937和THP-1细胞系悬浮培养于含有10%胎牛血清(美国Gibco公司)的RPMI-1640培养液(美国Gibco公司),在37 ℃、CO2体积分数为5%的恒温培育箱中温育,每2~3 d换液传代。

表1 研究对象的一般情况Tab.1 Characteristics of patients
1.4 细胞计数试剂盒(cell counting kit-8,CCK-8)法检测细胞增殖
将U937和THP-1细胞系接种于96孔板中,密度为1×104个细胞/孔,用不同浓度的去甲基化药物5-氮杂胞苷(5-azacytidine,5-azaC;美国Sigma公司)和组蛋白去乙酰化酶抑制剂西达本胺(美国CSNpharm公司)处理两种白血病细胞系,在培养箱中分别培养24、48和72 h,使用酶标仪测量波长450 nm处的吸光度(D)值。制作细胞标准增殖率曲线,最终选取5-azaC 2.0和5.0 μmol/L干预U937细胞,干预THP-1细胞的浓度为20.0和50.0 μmol/L,西达本胺干预U937细胞和THP-1细胞的浓度为0.5和1.0 μmol/L,培养时间为48 h。两药联合时低浓度组和高浓度组中5-azaC和西达本胺浓度、培养时间均不变。同时设置空白组和对照组,每次实验重复3次。
1.5 反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)和甲基化特异性PCR(methylation-specific PCR,MS-PCR)
RNA和DNA均提取自骨髓单个核细胞或细胞系,按照反转录试剂盒说明书[天根生化科技(北京)有限公司]进行反转录,按照DNA甲基化试剂盒说明书(美国Zymo Research Biotech公司)进行基因的甲基化处理。PCR扩增条件:50 ℃,2 min;95 ℃,10 min;95 ℃,10 s,60 ℃,20 s,72 ℃,15 s,40个循环;72 ℃,7 min。β-actin为内参。ΔΔCt方法分析基因的相对表达。每次实验重复3次。甲基化PCR产物进行琼脂糖凝胶电泳,用溴化乙锭染色并在UV照射下显现。引物序列见表2。
1.6 蛋白质印迹法 (Western blot)检测蛋白水平
用冰磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤细胞3次,然后用RIPA缓冲液溶解细胞。用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离50 μg总蛋白,将裂解物转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。用SOCS1(1∶1 000)、DNMT1(1∶1 000)、DNMT3a (1∶1 000)、HDAC1(1∶1 000)和β-actin(1∶2 000)(美国Cell Signaling Technology公司)的抗体对膜进行4 ℃温育,随后与二抗共同温育1 h,洗涤后进行胶片显影。Sicon Image J软件对其蛋白水平进行半定量分析,计算蛋白和内参蛋白的相对积分光密度(integral optical density,IOD)值来显示其相对表达量。

表2 引物序列Tab.2 Primer sequence
1.7 基因敲除
将U937和THP-1细胞接种在6孔板上,在培养孔中接种浓度为2×105个/mL的细胞。抑制DNMT1基因的小干扰RNA(DNMT1-siRNA)序列为:5’-GGGAGAAAUUAAACUUACUTT-3’和5’-AGUAAGUUUAAUUUCUCCCTT-3’。用不靶向任何基因的siRNA序列作为干扰序列对照。培养孔中加入DNMT1-siRNA和Lipofectamine RNAiMax(美国Invitrogen公司),37 ℃共同温育48 h,同时设置空白对照孔。
1.8 统计学处理
2 结果
2.1 AML各组中SOCS1基因mRNA的表达及甲基化状态
在IT组和RR组中SOCS1 mRNA的相对表达量显著低于RE组和NC组(P<0.05),RR组中的表达低于IT组,但差异无统计学意义(P>0.05,图1)。AML IT组中SOCS1基因甲基化者有24例(48%,24/50),RR组中有8例(80%,8/10),而在RE组和NC组均为非甲基化状态甲基化率为0%(0/50)和0%(0/10),SOCS1基因甲基化率在IT组和RR组中显著高于RE组和NC组(图2)。

图1 SOCS1基因mRNA的相对表达水平Fig.1 Relative expression of SOCS1 mRNA in IT,RR,RE and NC groups

图2 SOCS1基因甲基化状态Fig.2 SOCS1 gene methylation status in IT,RR,RE and NC groups
2.2 SOCS1甲基化、组蛋白去乙酰化相关基因的表达
DNA甲基转移酶1(DNA methyltransferase1,DNMT1)和DNMT3a及组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)的mRNA在AML IT组和RR组中表达显著高于RE组和NC组(P<0.05)。IT组和RR组中表达差异均无统计学意义,RE组和NC组中表达差异均无统计学意义(图3)。
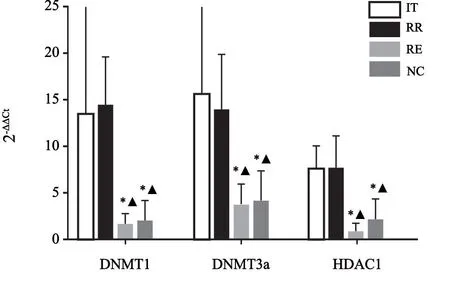
图3 DNMT1,DNMT3a and HDAC1 mRNA的相对表达水平Fig.3 mRNA relative expressions of DNMT1,DNMT3a and HDAC1
AML IT组和RR组中SOCS1蛋白相对表达量比RE组和NC组显著减少(P<0.05),而DNMT1、DNMT3a和HDAC1蛋白相对表达量在RE组和NC组显著低于IT组和RR组(P<0.05,图4)。
2.3 SOCS1甲基化与AML患者预后的相关性
将AML IT根据有无SOCS1的甲基化分为甲基化组和非甲基化组,分别检测两组患者CR、EFS和OS的差异。SOCS1甲基化组中治疗后CR明显低于非甲基化组(P<0.05),但两组间EFS和OS差异无统计学意义(P>0.05,图5)。
2.4 药物干预AML细胞系后SOCS1基因表达和甲基化状态的变化
随着5-azaC和西达本胺浓度的增加,SOCS1 mRNA的表达量逐渐增加,各组间差异均有统计学意义(P<0.05)。5-azaC干预后U937和THP-1细胞株中SOCS1基因甲基化条带逐渐减弱,非甲基化条带逐渐增强,由完全甲基化状态转变为完全非甲基化状态(图6)。
2.5 药物干预AML细胞系后甲基化、组蛋白去乙酰化相关基因的表达水平
5-azaC处理白血病细胞系后,SOCS1基因mRNA表达增多,DNMT1、DNMT3a表达较无药物处理组明显下降(P<0.05);西达本胺处理白血病细胞系后,SOCS1基因mRNA表达同样升高,HDAC1表达较无药物处理组明显下降(P<0.05),而在同时有5-azaC和西达本胺的处理组,SOCS1基因较同浓度单药组升高更加明显(P<0.05),且DNMT1、DNMT3a、HDAC1表达均较同浓度单药组下降更加明显(P<0.05,图7)。

图4 蛋白相对水平Fig.4 Relative level of protein
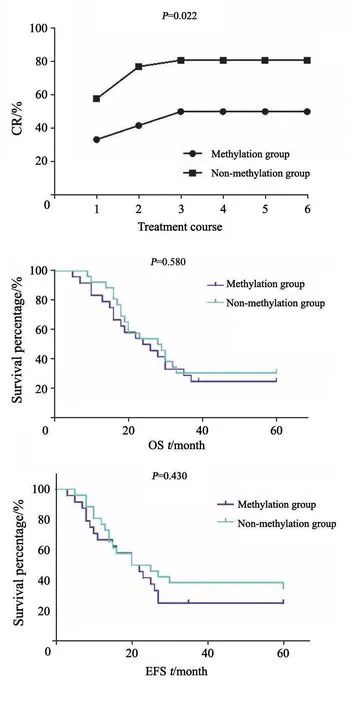
图5 SOCS1甲基化对AML患者CR、EFS和OS预后的影响Fig.5 The prognostic value of SOCS1 methylation for CR,EFS and OS among AML patients

图6 药物处理后SOCS1的改变Fig.6 Changes of SOCS1 after drug treatment
2.6 药物干预AML细胞株后细胞增殖率结果
5-azaC对U937和THP-1细胞株的半数抑制浓度(the half maximal inhibitory concentrations,IC50)分别为0.92和13.65 μmol/L;西达本胺对U937和THP-1细胞系的IC50分别为0.17和0.42 μmol/L;两药组对U937(5-azaC∶西达本胺为4∶1配制)和THP-1(5-azaC∶西达本胺chidamide为40∶1配制)细胞系的IC50分别为5-azaC 0.85 μmol/L、西达本胺0.21 μmol/L和5-azaC 11.25 μmol/L、西达本胺0.28 μmol/L。随着5-azaC和西达本胺浓度的增加,两种白血病细胞系U937和THP-1的增殖率逐渐下降,随药物处理时间的延长,细胞增殖率也在逐渐下降(图8~9)。
2.7 敲除DNMT1基因
U937和THP-1细胞系转染入DNMT1-siRNA后,细胞内DNMT1基因mRNA和蛋白的表达均较前下降,而SOCS1基因mRNA和蛋白的表达均明显升高。白血病细胞增殖曲线随转染时间推移开始逐渐上升(图10~11)。

图7 AML细胞系中表观遗传学相关基因表达的变化Fig.7 Changes of epigenetic gene expression in AML lines

图8 药物干预AML细胞系后增殖率浓度的变化Fig.8 Cell viability of AML cell lines after demethylation treatment
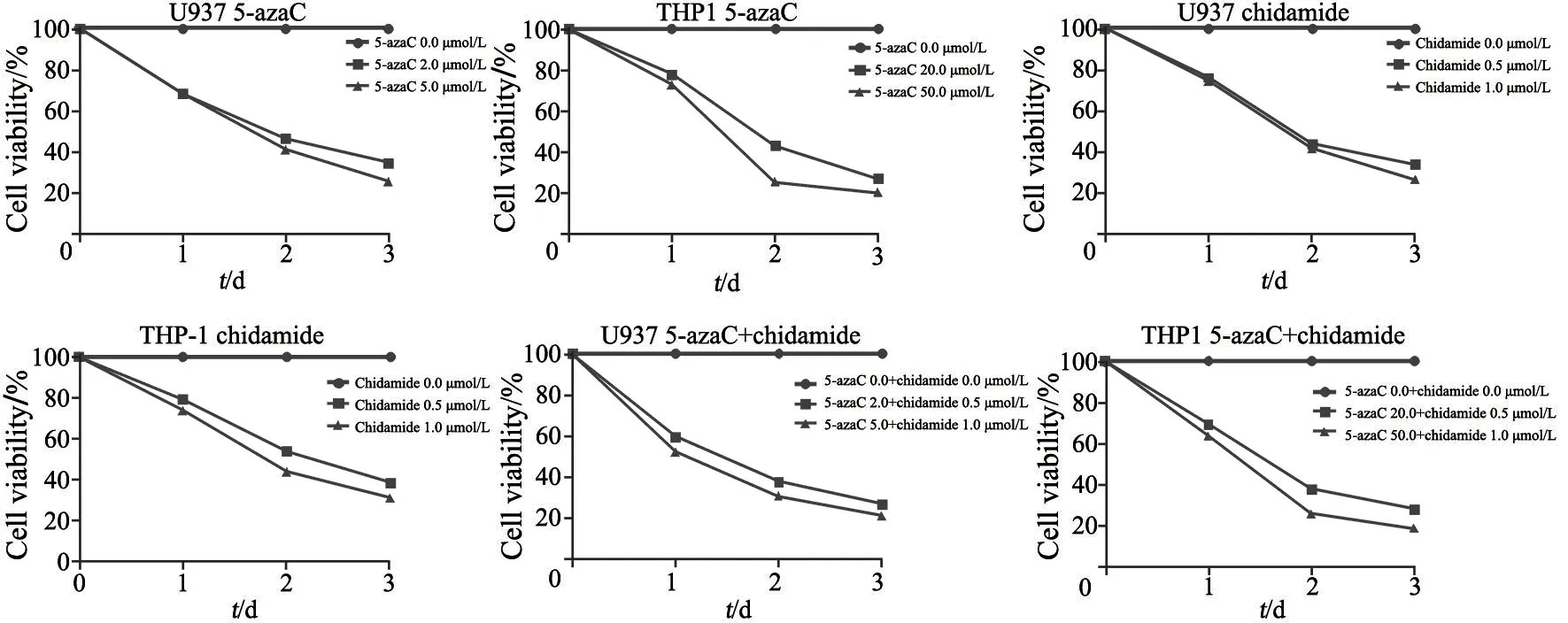
图9 AML细胞系增殖曲线Fig.9 Cell proliferation curves of AML cell lines
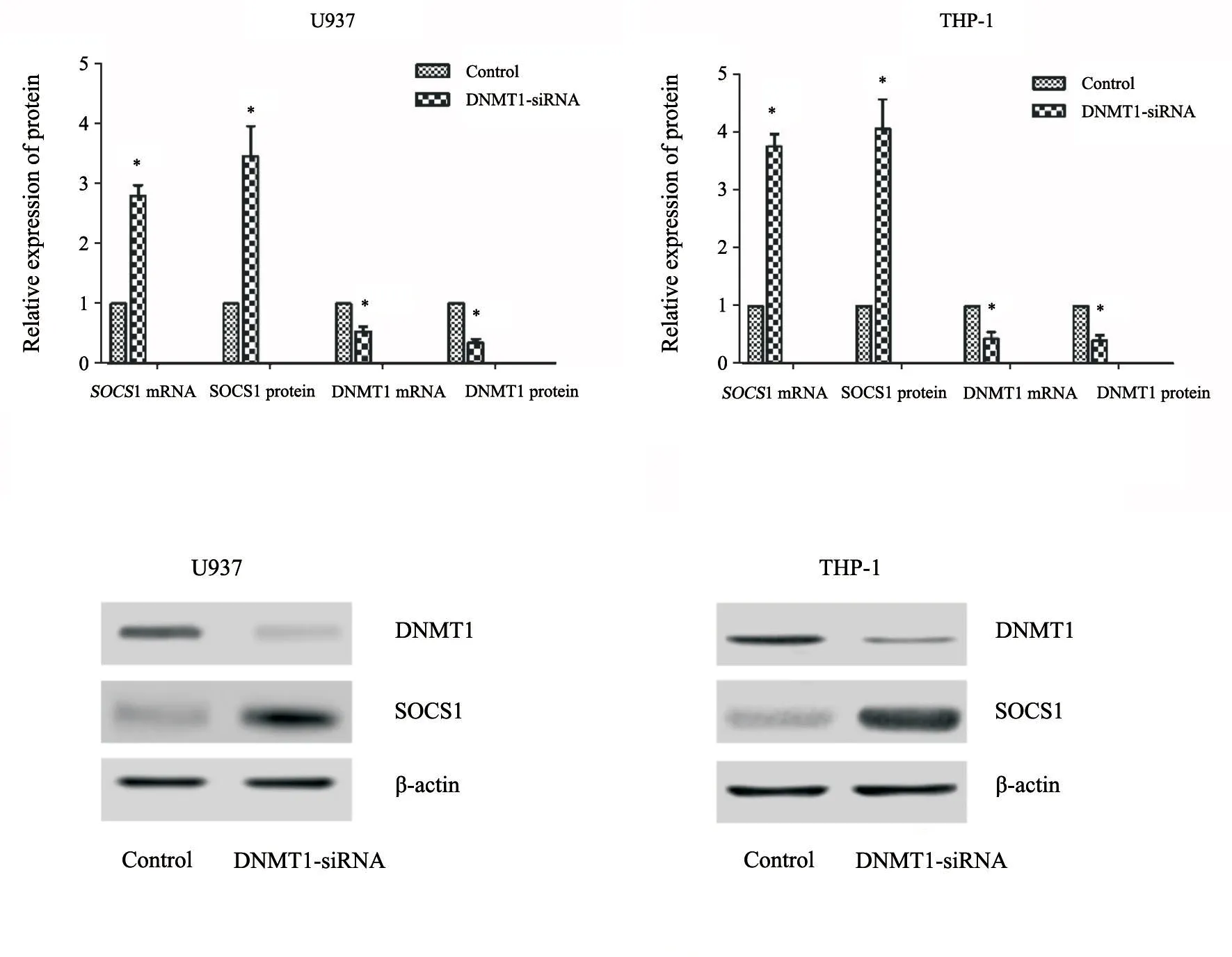
图10 AML细胞系转染DNMT1-siRNA后SOCS1、DNMT1基因变化Fig.10 Changes of SOCS1 and DNMT1 gene expressions in AML lines transfected with DNMT1-siRNA

图11 转染DNMT1-siRNA后AML细胞系的增殖曲线Fig.11 Cell proliferation curves of AML lines transfected with DNMT1-siRNA
3 讨 论
在肿瘤的发生过程中,细胞表观基因组发生了关键性的改变,表观遗传学修饰仅改变基因的表达但不影响基因序列,意味着基因表观遗传学修饰与癌症的发生、发展密切相关[3-5]。基因突变包括抑癌基因和癌基因的突变,大都向细胞增殖失控的方向倾斜。表观遗学修饰更为复杂,主要包括DNA甲基化、组蛋白去乙酰化、染色质重塑和非编码RNA[6]。其中抑癌基因启动子区CpG岛的甲基化和组蛋白去乙酰化在肿瘤的发生过程中发挥了关键性的作用[7-8]。
SOCS1被公认为抑癌基因,在肝细胞癌中甲基化发生率高达39%~60%,且与肝癌的淋巴结转移及疾病进展相关[9]。SOCS1的甲基化还发生于其他肿瘤性疾病中,例如61%的子宫颈癌[10],45%的食管鳞状细胞癌[11],40%的肝母细胞癌[12]等。随后,在胃肠道肿瘤、胰腺肿瘤等疾病中都相继有SOCS1基因被高度甲基化的研究报道。Kim等[13]在对宫颈癌的研究中发现,SOCS1的表达沉默不仅与其启动子区的甲基化有关,同时还发现与基因的组蛋白去乙酰化有关,用组蛋白去乙酰化酶抑制剂处理后,SOCS1的表达明显增高,可抑制肿瘤细胞的增殖[14]。
最近的研究[15-17]表明,SOCS1可上调多发性骨髓瘤、乳腺癌和前列腺癌中微小RNA的表达,进一步验证了SOCS1作为肿瘤抑制基因的作用。本研究也发现,在AML的发生中SOCS1的甲基化、组蛋白去乙酰化发挥重要的作用。在疾病初治组和复发难治组中SOCS1基因的甲基化(甲基化率为48%和80%)导致mRNA和蛋白的表达减少,SOCS1基因的甲基化与该基因的表达呈负相关。同时,DNMT1、DNMT3a和HDAC1随之升高,与SOCS1甲基化率及表达减低趋势一致,提示DNMT1、DNMT3a和HDAC1基因可能参与了SOCS1表观遗传学修饰的过程,致使SOCS1基因表达沉默。而在RE和NC中,SOCS1基因均为非甲基化状态且其mRNA和蛋白的表达量均较高,且在初治AML患者中SOCS1非甲基化组CR明显高于甲基化组,但两组间EFS和OS无显著性差异,说明SOCS1基因的表观遗传学改变与白血病的诊断、治疗缓解有相关性。
本实验对AML细胞系U937和THP-1进行了去甲基化和抑制基因组蛋白去乙酰化的研究,用去甲基化药物5-氮杂胞苷干预两种AML细胞系后,发现SOCS1基因由原本的甲基化状态转变为非甲基化状态,mRNA和蛋白表达均显著升高,呈药物浓度依赖性,组蛋白去乙酰化抑制剂西达本胺干预两种细胞系后,SOCS1基因表达也出现升高,甲基化相关基因DNMT1、DNMT3a和HDAC1的mRNA和蛋白相对表达量逐渐减少,而肿瘤细胞的增殖率随之下降。本研究发现,在同时有5-氮杂胞苷和西达本胺的处理组,SOCS1基因表达升高程度更加明显,对DNMT1、DNMT3a、HDAC1基因的抑制作用更强。同时应用去甲基化药物和组蛋白去乙酰化抑制剂,可明显抑制肿瘤细胞的生长。将可干扰DNMT1基因表达的小干扰RNA转染入U937和THP-1细胞系内,研究发现,随着DNMT1基因表达受到抑制,SOCS1基因mRNA和蛋白表达均显著升高,而AML细胞系增殖受到抑制。DNMT1基因敲除使SOCS1基因启动子甲基化减弱,上调了SOCS1的表达,抑制了肿瘤细胞的生长。提示在AML中,通过抑制SOCS1基因的表观遗传学修饰以提高该基因表达可以起到抑制肿瘤发展促进肿瘤细胞凋亡的作用。
因此,本研究证实,SOCS1作为AML诊断、治疗缓解和预后的标志物具有一定的可靠性和特异性。恢复或提高SOCS1表达的方法或许可作为抗癌疗法[18-19],但在其他种类的肿瘤中SOCS1是否均发挥抑癌作用,仍需要通过对不同种类肿瘤的研究来进一步证实。

