肿瘤相关巨噬细胞相关性miR-99a对子宫内膜癌细胞生长和侵袭的调控作用
文 静,黄 洁,李云云,张中卒,周 勤
1.重庆医科大学附属第一医院妇产科,重庆 400016;
2.陆军军医大学附属大坪医院(陆军特色医学中心)内科,重庆 400042;
3.重庆医科大学附属永川医院妇产科,重庆 402160;
4.重庆医科大学附属永川医院骨科,重庆 402160
子宫内膜癌(endometrial cancer,EC)是妇科常见恶性肿瘤之一,占女性所有癌症相关死亡的2.1%[1]。EC整体预后良好,但是对于晚期及特殊病理学类型患者预后仍较差。因此了解其具体的发病机制对EC的治疗具有重要意义。
肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是肿瘤微环境中重要的细胞亚群,参与肿瘤增殖和侵袭调控[2]。根据细胞功能、活化状态,巨噬细胞分为两种类型:M1型和M2型[3]。M1型由经典活化途径获得,主要存在于炎性反应环境中,分泌IL-12和IL-23等促炎因子,参与炎性反应;而M2型由替代活化途径获得,主要存在于肿瘤微环境中,参与肿瘤发生、发展过程调控,因此被许多研究报道称为TAM[4]。目前多项研究发现,M2型巨噬细胞浸润与多种肿瘤预后不良有关,其中包括EC[5],但其作用机制尚不十分明确,本研究将在前期研究的基础上,进一步检测TAM在EC细胞发生、发展中的作用及可能机制。
1 材料和方法
1.1 主要材料
人EC细胞系HEC-1B、RL95-2和人单核细胞系U937购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心;新生胎牛血清购自美国PAA公司;RPMI-1640培养液、胰蛋白酶和RIPA裂解液购自美国Invitrogen公司;青霉素和链霉素购自美国Sigma公司;miR-99a mimic、对照序列(scramble mimic)和DharmaFECT1转染试剂购自美国Thermo公司;TRIzol试剂和反转录试剂盒购自美国Life Technologies公司;Matrigel基质胶购自美国BD公司;细胞计数试剂盒(cell counting kit-8,CCK-8)购自日本株式会社同仁化学研究所。巨噬唾液酸蛋白(macrosialin)CD68及血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1)CD31购自武汉Boster公司,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、Bcl-2、E-cadherin及N-cadherin购自美国CST公司,蛋白提取试剂盒及GAPDH购自北京中杉金桥生物技术有限公司。
1.2 细胞培养及诱导
HEC-1B和RL95-2均用含10%胎牛血清、100 U/L青霉素和100 μg/mL链霉素的RPMI-1640培养液,置于37 ℃、CO2体积分数为5%的细胞培养箱中培养,收集培养上清液进行下一步实验。U937悬浮培养于含10%胎牛血清的RPMI-1640培养液的6孔板中(1×106个/mL)。培养24 h后加入EC细胞培养上清液诱导30 h,可见细胞贴壁生长。更换新鲜EC细胞培养上清液继续培养18 h。检测诱导前后U937细胞中CD68、CD163及CD206的表达水平,验证TAM诱导成功与否。
1.3 组织标本收集
本实验收集2014年8月—2016年8月于重庆医科大学附属第一医院及重庆医科大学附属永川医院妇产科经病理科医师确诊为EC患者的EC组织标本75例。年龄33~81岁[平均年龄(65.6±0.78)岁]。术前均未行放化疗。术后经重庆医科大学病理科诊断分期,Ⅰ~Ⅱ期49例,Ⅲ~Ⅳ期26例,病理分化类型,G1~G2型36例,G3型39例,有淋巴结转移患者22例,无淋巴结转移患者53例,肌层浸润深度≥1/2肌层者50例,肌层浸润深度<1/2肌层者25例。44例EC组织中CD68呈高表达,高表达率为58.7%;31例阴性/低表达,阴性/低表达率为41.3%。
1.4 免疫组织化学染色
将病理组织学切片置于56 ℃下烘烤2 h后,再逐级脱蜡和水化;随后行抗原修复;然后血清封闭30 min;一抗4 ℃过夜;第2天二抗室温30 min;浓缩型二氨基联苯胺显色,在显微镜下观察切片,被染黄后终止显色,最后脱水、透明、中性树胶封片。用Image-Pro Plus 6.0软件分析图像,对细胞染色强度和着色细胞百分比共同评定量化。
1.5 miRNA测序
收集8对不同浸润深度的EC组织,分选出肿瘤间质中CD68+TAM,对其进行miRNA表达谱的差异分析。在北京擎科生物科技股份有限公司进行miRNA测序,根据测序结果筛选出浸润深度>1/2肌层与浸润深度<1/2肌层的EC患者癌灶组织中TAM中差异表达的miRNA,并对有明显差异表达的miRNA进行聚类分析。
1.6 TAM转染及与EC细胞共培养
将EC细胞培养上清液诱导后的TAM分两组,按DharmaFECT1转染试剂说明书介绍的方法,将miR-99a mimic或scramble mimic分别转染至诱导后的TAM中。转染4~6 h后,更换为新鲜的完全培养液。转染48 h后,收取细胞,用于后续实验。将转染miR-99a或scramble的TAM分别接种于transwell小室上室内,与下室中EC细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中共培养36 h。共培养结束后,收集下室内的EC细胞,做进一步的功能检测。
1.7 流式细胞术检测
收集6孔板内的细胞,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗2次,再用PBS将细胞转移至试管中,1 000 r/min离心5 min,去上清液,98 μL PBS重悬细胞后,避光加入2 μL流式细胞术用抗体CD206、CD163及CD68(德国Miltenyi公司),4 ℃温育30 min,洗去抗体后,上BD Accuri C6流式细胞仪检测。采用CFlow软件进行数据分析。
1.8 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测
采用TRIzol法分别提取诱导前后及转染前后单核细胞中总RNA,然后用反转录试剂盒将RNA反转录;实验操作按TRIzol和反转录试剂盒说明书进行。以cDNA为模板,分别检测M2型巨噬细胞标志物CD68、CD163、CD206的表达水平和miR-99a表达水平。引物序列CD68上游为5’-CTACTTGCCATCCTTCA-3’,下游为5’-G TGGTTTTGTGGCTCTTGGTA-3’;CD163上游为5’-TTTTGTCACCAGTTCTCTTGGA-3’,下游为5’-AGCCATTATTACACACGTTCC-3’;CD206上游为5’-GGATGGAAGCAAAGT GGATTAG-3’,下游为5’-CTACTGTTATGT CGCTGGCAAA-3’;基因内参GAPDH上游:5’-AGGTCGGAGTCAACGGATTTG-3’,下游:5’-GTGATGGCATGGACTGTGGT-3’。miR-99a上游:5’-GCGAACCCGTAGATCCG AT-3’,下游:5’-CAGTGCAGGGTCCGAG GT-3’;miRNA内参U6上游:5’-CTCGCTTCG GCAG CACATATACT-3’,下游:5’-ACGCTT CACGAATTTGCGTGTC-3’。RTFQ-PCR反应体系(20 μL)包括:SYBR Green Mix 10 μL、引物(4 μmol/L)各1 μL、cDNA模板1 μg和ddH2O 7 μL。RTFQ-PCR反应条件:95 ℃ 5 min;95 ℃5 s,59 ℃ 30 s,72 ℃ 30 s,共39个循环。以2-ΔΔCt法计算mRNA相对表达量。
1.9 酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测单核细胞分泌的相关细胞因子
收集TAM转染后细胞上清液,分别检测巨噬细胞分泌相关细胞因子IL-12、IL-4和IL-10的含量,具体试验步骤分别按照相应ELISA试剂盒说明书进行。利用全波长光吸收酶标仪检测450和570 nm波长处各反应孔的吸光度(D)值,制作标准曲线并计算各孔对应的质量浓度值。
1.10 CCK-8检测EC细胞的增殖活性
共培养36 h后,将各组EC细胞分别均匀接种于96孔板中(8×103个细胞/孔),每组均设3个复孔。分别于0、24、48和72 h在每孔中加入10 μL的CCK-8溶液,在37 ℃培养箱中温育2 h,然后用自动酶联免疫检测仪测定各孔在450 nm波长处的D值(参比波长为650 nm),以此反映细胞增殖活性。
1.11 Transwell小室侵袭实验检测EC细胞的侵袭能力
将基质胶于冰上稀释,取40 μL平铺于transwell小室(8 μm孔径),37 ℃温育,待胶凝固。将共培养的EC细胞,取4×105个细胞于小室上室内用不含血清的RPMI-1640培养液培养;小室下层加入含20%胎牛血清的培养液进行趋化。置于培养箱中培养24 h后取出小室,吸掉上室内培养液,用棉签擦去上层未穿膜细胞,PBS洗3次,甲醇固定30 min,结晶紫染色8 min,PBS洗3次。风干后用刀片揭膜并用中性树胶封片,倒置显微镜下拍照。随机计数6个视野(×100)中结晶紫染色的细胞数,以此反映各组细胞的侵袭能力。
1.12 蛋白质印迹法(Western blot)检测蛋白水平
依据蛋白提取试剂盒说明书提取总蛋白,蛋白浓度用二喹啉甲酸法测定,10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转膜、封闭,加入一抗,4 ℃温育过夜。次日二抗37 ℃温育1 h,然后洗膜、显影。GAPDH为内参。
1.13 统计学处理
使用SPSS 20.0统计软件和GraphPad Prism 7.0软件对结果进行分析。使用独立样本t检验对两组间差异进行比较,细胞生长曲线分析采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 TAM浸润与EC的肌层浸润及血管新生相关
收集75例EC及对应癌旁组织,运用免疫组织化学法分析其中CD68+TAM浸润细胞数,并分析其与EC的病理学特征之间的相关性(图1)。CD68高表达与患者的年龄、病理学分期及病理学分化类型无明显相关性,与患者的肌层浸润深度呈正相关,提示TAM浸润与EC的浸润相关。
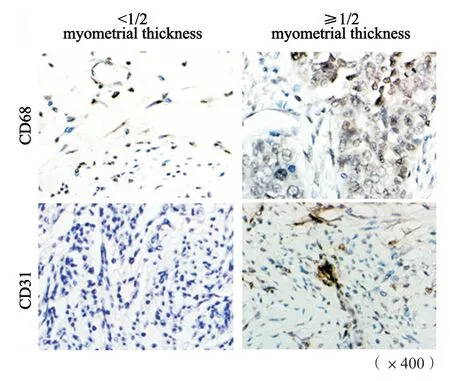
图1 浸润深度≥1/2肌层与浸润深度<1/2肌层的EC患者肿瘤组织中CD68+ TAM细胞及CD31+细胞免疫组织化学示例图Fig.1 Representative pictures of immunohistochemistry staining of CD68+ and CD31+ cells in endometrial cancer (EC) tissues with different myometrial invasion depth
同时我们运用CD31检测肿瘤组织内微血管密度,结果证实,CD68高表达与CD31高表达呈正相关(表1),提示EC的浸润及肿瘤新生血管形成与TAM细胞的浸润密切相关。
2.2 miR-99a参与EC组织TAM的浸润调控
本研究采用免疫磁珠法分选出肿瘤间质中CD68+TAM,并运用miRNA基因微阵列技术比较浸润深度>1/2肌层与浸润深度<1/2肌层的8对EC患者癌灶组织中TAM miRNA表达谱的差异,结果发现,浸润深度>1/2肌层患者组织TAM中miR-99a的表达较浸润深度<1/2肌层患者组织TAM中表达明显下降(图2);我们的前期实验也证实,相比癌旁对照组织,EC肿瘤组织中miR-99a的表达明显下降,且miR-99a能够抑制EC的生长以及浸润调控[6],提示miR-99a的抑癌功能可能不仅作用于肿瘤细胞本身,同时作用于肿瘤微环境中的TAM。
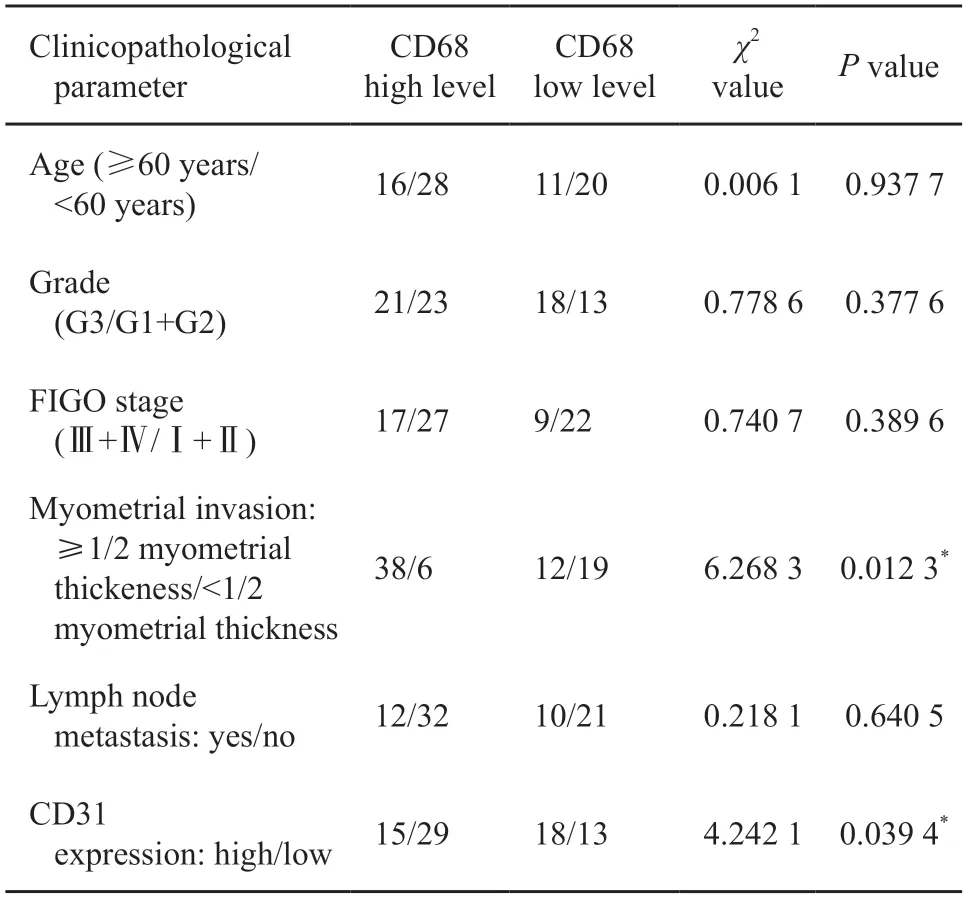
表1 CD68表达水平高低与EC病理学特征的相关性分析Tab.1 The analysis of relation between CD68 expression level and clinicopathological parameters of EC
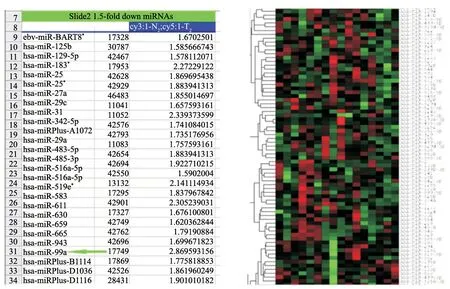
图2 基因芯片筛查不同肌层浸润深度的肿瘤组织间质中CD68+细胞中miRNAs表达谱的差异Fig.2 Differences of miRNA expression profiles in CD68+ cells with different depth of myometrial invasion
2.3 诱导人单核细胞向TAM细胞极化及鉴定
已有研究证实,肿瘤组织微环境可以诱导单核细胞募集并极化,EC细胞也被证实在体外能够诱导单核细胞向具有M2型表型巨噬细胞极化[7]。收集EC细胞(HEC-1B及RL95-2)条件培养基,将培养基与悬浮人单核细胞U937共培养,结果发现,共培养诱导后的细胞呈贴壁生长,收集贴壁后细胞。运用RTFQ-PCR检测诱导分化后细胞中M2型巨噬细胞标志物CD68、CD163及CD206表达情况,结果显示,诱导后单核U937细胞呈贴壁生长,贴壁后U937细胞中CD68(t=7.349,P<0.01)、CD163(t=12.90,P<0.01)及CD206(t=11.83,P<0.01)表达均明显升高。为了进一步验证其表达差异变化,运用流式细胞术分别检测其中CD68、CD163及D206表达量的变化。结果显示,诱导后单核细胞中CD68、CD163及D206均明显升高,差异有统计学意义,提示单核细胞U937向M2型巨噬细胞分化(图3)。
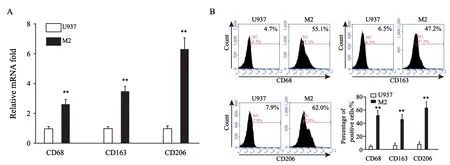
图3 人单核细胞的极化及鉴定Fig.3 Polarization of human monocytes and identification
2.4 过表达miR-99a能够逆转单核细胞向TAM极化
将人工合成的miR-99a mimic(实验组)及scramble(对照组)分别转染至诱导后的巨噬细胞中(HEC-1B-U937及RL95-2-U937)。RTFQ-PCR结果显示,转染miR-99a后诱导后细胞miR-99a表达水平较scramble组明显增高,差异有统计学意义(t=19.61,P<0.01;t=13.81,P<0.01;图4A)。转染miR-99a后单核细胞组CD68及CD163均较对照组表达明显下降,差异有统计学意义(t=8.179,P<0.01;t=11.78,P<0.01;图4B),CD206表达下降,差异无统计学意义(t=0.9951,P>0.05,图4B),进一步的流式细胞术证实上述表达变化(图4C),提示过表达miR-99a能够逆转巨噬细胞向M2型极化。而进一步运用ELISA法检测转染miR-99a后单核细胞中细胞因子表达差异,结果显示,转染miR-99a后HEC-1B/RL95-2-U937细胞中IL-12较对照组分泌量增加,而IL-4、IL-10较对照组分泌量减少(t=6.236、4.896、5.857,P<0.01,图4D),结果进一步表明过表达miR-99a能够逆转单核巨噬细胞向M2型巨噬细胞极化。
2.5 miR-99a逆转TAM对EC细胞增殖促进作用
既往研究证实,诱导后TAM与EC细胞共培养能够诱导EC细胞增殖及侵袭,促进肿瘤发生[8]。为了探索miR-99a在TAM介导对EC细胞增殖作用的影响,将miR-99a转染至诱导后单核细胞中(miR-99a-HEC-1B/RL95-2-U937),将转染后的细胞接种于transwell小室的上室内,与下室EC细胞(HEC-1B/RL95-2)共培养36 h,CCK-8结果显示,转染miR-99a诱导后单核细胞组的EC细胞(HEC-1B/RL95-2-U937)增殖能力较对照组下降,差异有统计学意义(HEC-1B-U937:miR-99avsscramble,48 h:t=4.841,P<0.01;72 h:t=4.975,P<0.01;RL95-2-U937:miR-99avsscramble,48 h:t=4.980,P<0.01;72 h:t=4.742,P<0.01,图5),结果表明,miR-99a能够抑制TAM对EC细胞增殖的促进作用。
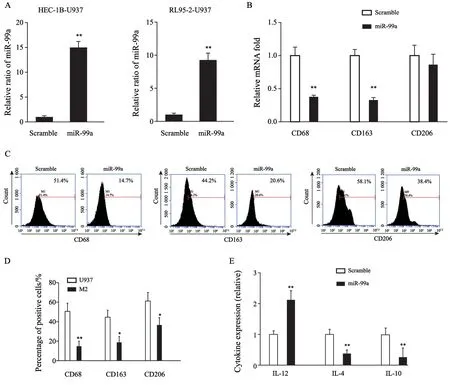
图4 miR-99a抑制诱导后单核细胞的极化Fig.4 miR-99a inhibits polarization of induced monocyte
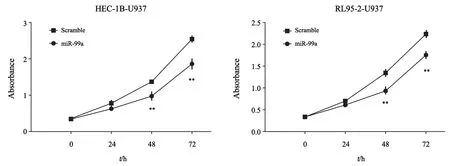
图5 CCK-8法检测过表达miR-99a的TAM共培养后HEC-1B及RL95-2细胞增殖能力变化Fig.5 The effects of co-culture with TAM transfected with miR-99a on the proliferation of HEC-1B and RL95-2 cells were detected by CCK-8 assay
2.6 miR-99a抑制TAM共培养对EC细胞侵袭能力的促进作用
将与转染后TAM共培养36 h的EC细胞重新铺于transwell小室(8.0 μm孔径)上室内,检测TAM转染miR-99a前后对EC细胞侵袭能力的影响。结果显示,过表达miR-99a的TAM组HEC-1B及RL95-2的穿膜能力较对照组下降,差异有统计学意义(t=3.148,P<0.05;t=4.376,P<0.05;图6),提示miR-99a能够抑制TAM细胞对EC细胞侵袭能力的促进作用。

图6 过表达miR-99a的TAM共培养后EC细胞侵袭能力的变化Fig.6 The invasive capacities of HEC-1B and RL95-2 cells co-cultured with TAM transfected with miR-99a were detected by transwell chamber invasion assay
2.7 mTOR可能参与TAM相关miR-99a在EC中的作用
为了进一步探究miR-99a可能参与TAM调控的机制,运用两种不同的miRNA靶基因生物信息学预测网站(miRanda和TargetScan)对miR-99a可能的靶基因进行预测并且进行交叉对比。结果发现,mTOR是miR-99a的靶基因之一。而mTOR在巨噬细胞调控中的作用也引起了科学家们广泛的兴趣。因此,我们初步检测了mTOR及其下游蛋白在转染miR-99a后单核细胞中表达量的变化,结果显示,过表达miR-99a能够下调诱导后单核细胞中mTOR及其下游蛋白的表达,提示其可能参与miR-99a相关作用调控。此外,我们进一步检测了其诱导后细胞中凋亡基因Bcl-2表达及EMT相关E-cadherin及N-cadherin蛋白水平的变化,结果发现,凋亡相关基因Bcl-2及N-cadherin表达下降,E-cadherin表达上调,提示过表达miR-99a能够下调诱导后单核细胞抑制其凋亡蛋白表达,并可能抑制细胞的EMT过程参与其调控作用(图7)。
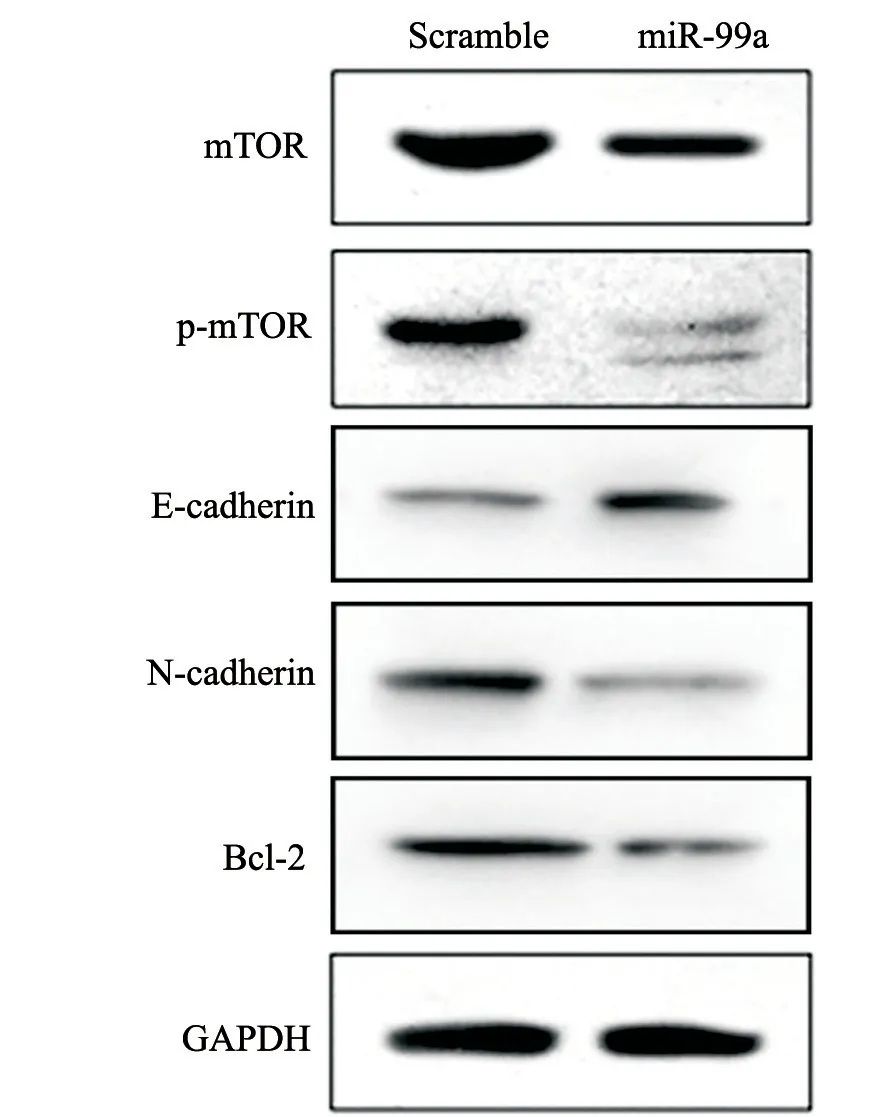
图7 过表达miR-99a的TAM中mTOR及其下游蛋白水平变化Fig.7 The expression of mTOR in TAM transfected with miR-99a
3 讨 论
肿瘤相关微环境在肿瘤的发生、发展中发挥重要作用,其中TAM是微环境中主要的炎症细胞群。根据细胞功能、活化状态的差异,巨噬细胞可被诱导为两种类型,即经典活化的M1型和替代活化的M2型。M1型巨噬细胞分泌IL-12、IL-23等促炎因子、趋化因子和效应分子[7],而M2型巨噬细胞可分泌IL-4、IL-10等大量抗炎因子,表达表征分子如CD68、CD163、CD206等[8]。其中M2型存在于肿瘤微环境中,参与肿瘤发生、发展过程,因此被许多研究报道称为TAM。本研究中通过检测EC间质中CD68阳性巨噬细胞浸润情况,评估其与EC病理学特征之间的关系,结果发现,巨噬细胞浸润与EC的肌层浸润及血管新生密切相关,但与肿瘤患者的年龄、分期及分化无明显相关性。进一步比较不同浸润深度肿瘤组织中巨噬细胞中miRNA表达差异,发现miR-99a在浸润深度较深的EC巨噬细胞中低表达,提示其可能发挥作用。TAM可以促进新生血管生成、破坏结缔组织、清除细胞碎片和促进肿瘤细胞增殖,在肿瘤的形成、进展和转移中发挥作用[2],而肿瘤细胞向周围环境分泌的细胞因子变化也能诱导单核细胞向M2表型分化[9]。本实验结果显示,诱导后的U937细胞中CD68、CD163及CD206表达水平升高,提示单核细胞向M2型巨噬细胞分化,而这一作用可以被过表达miR-99a所抑制,提示miR-99a可能参与巨噬细胞调控。
miR-99a已被证实在宫颈癌、胰腺导管腺癌、乳腺癌和头颈部鳞癌等多种肿瘤中低表达,恢复miR-99a的表达能抑制细胞增殖,促进细胞凋亡[10]。我们的前期实验证明miR-99a能抑制EC的恶性行为[6],但是这种抑制作用是否引起微环境改变,是否涉及对巨噬细胞极化的影响尚不清楚。因此,我们将miR-99a转染至诱导成功的TAM,发现转染后M2表型CD68及CD163较对照组表达下降,且促炎因子IL-12分泌增多,而抗炎因子IL-4、IL-10分泌减少,表明巨噬细胞向M1型极化,提示miR-99a可以抑制巨噬细胞向M2型极化。
为了进一步探究miR-99a可能参与TAM调控的机制,我们运用两种不同的miRNA靶基因生物信息学预测网站(miRanda和TargetScan)对miR-99a可能的靶基因进行预测并且进行交叉对比。结果发现,mTOR是miR-99a的靶基因之一。研究发现,mTOR通路抑制剂—雷帕霉素可诱导单核细胞分泌IL-12、IL-23等促炎症因子,下调IL-10的分泌,诱导细胞向M1型极化;而mTOR通路的激活可诱导单核细胞分泌IL-10,抑制促炎因子的分泌,诱导细胞向M2型极化[11]。因此,我们推测mTOR可能参与了miR-99a对TAM介导的对EC恶性生物学表型的影响。结果证实,诱导后单核细胞中过表达miR-99a能够明显抑制mTOR及其下游基因的表达,提示mTOR通路可能参与其作用调节。此外,我们进一步检测了其诱导后细胞中凋亡基因Bcl-2表达及EMT相关E-cadherin及N-cadherin蛋白水平的变化,结果提示过表达miR-99a能够下调诱导后单核细胞抑制其凋亡蛋白表达,并可能抑制细胞的EMT过程。
综上所述,miR-99a可能通过靶向调节mTOR通路参与EC中TAM极化及其介导EC生长及侵袭的调控。

