肺动脉高压关键基因的筛选及生物信息学分析
仲红艳,唐珊,赵飞飞,王大新
肺动脉高压是一种严重的致命性疾病,其可能是特发性的,也可能是先天性心脏病、自身免疫病、感染等疾病的最终结果[1],不管病因为何,病理特征都是肺血管重构,随后右心室重构,如果无有效治疗措施,最终可致右心衰竭和死亡[2]。据估计,全球目前约1%的人口患有肺动脉高压,在65岁以上的人群中,这一比例高达10%[3],且在女性中更为流行,男女比例约为1:4[4]。随着规范的临床诊疗,患者5年生存率已提高到50%~60%[5]。但由于肺动脉高压分子机制尚不清楚,目前的治疗方案通常侧重于缓解症状,而不是干预疾病进展。最近几年,随着基因测序技术的发展,产生了大量的基因信息,肺动脉高压作为常见重大疾病之一,其基因芯片数据的发展已成为研究新趋势和热点。因此,本研究利用信使RNA(mRNA)和微小RNA(microRNA)表达谱数据集来识别肺动脉高压发生的关键基因和重要通路,并构建microRNA-mRNA网络,从基因层面分析肺动脉高压发生的潜在分子机制,为探索肺动脉高压治疗提供一些新思路。
1 材料与方法
1.1 数据来源
从美国国立生物中心的基因表达数据库(Gene Expression Omnibus,GEO)(www.ncbi.nlm.nih.gov/geo)中获取2个mRNA表达谱数据集GSE113439、GSE117261和1个microRNA表达谱数据集GSE67597,样本均来源于人肺组织,各个数据集的特征见表1。

表1 各数据集特征
1.2 差异基因获取方法
用R软件中的“sva”包去除2个mRNA数据集批间差后通过“limma”包进行差异表达分析,最后以P<0.05和|log2FC | >0.5(“FC”表示差异表达倍数)为阈值筛选出mRNA数据集中的差异表达基因,另外,用GEO2R在线分析工具处理microRNA数据集,以P<0.05和|log2FC | >1为阈值筛选出差异表达的microRNA。
1.3 基因分析软件
通过DAVID 6.8在线数据库对差异基因进行基因本体论(Gene Ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,且GO和KEGG各项以P<0.05为筛选条件。STRING在线数据库构建蛋白之间相互作用可视化网络图(PPI),TargetScan在线数据库预测差异microRNA靶基因,Cytoscape 3.6.1软件获取关键基因、关键模块和构建microRNA-mRNA网络。
2 结果
2.1 筛选差异基因
mRNA数据集(GSE113439和GSE117261)共包含73个肺动脉高压样本和36个正常肺组织样本。通过R软件的“sva”包去除批间差(图1),用“limma”包进行差异表达分析,并以P<0.05和|log2FC |>0.5为筛选条件,发现与正常肺组织相比,肺动脉高压患者肺组织中有226个基因存在差异表达,其中141个为上调基因,85个为下调基因,对这些差异基因做聚类分析,见火山图(图2)。另外,microRNA数据集(GSE67597)中包含7个肺动脉高压样本和8个正常肺组织样本。利用GEO2R在线分析工具从microRNA表达谱数据集中获得29个差异表达microRNA,其中17个表达上调,12个表达下调。

图2 226个差异基因的火山图
2.2 差异基因功能和信号通路富集分析(表2~5)
226个差异基因GO分析包含生物学过程、细胞定位、分子功能三部分。这些基因涉及的生物学过程主要有炎症反应、细胞趋化、细胞增殖、黏附等;基因主要位于细胞外基质、细胞外间隙、质膜等;分子功能主要是肝素结合、整合素结合、碳水化合物结合、转运活性、趋化活性等。KEGG富集结果显示这些基因主要参与造血细胞系、性别、锥虫病、葡萄球菌感染等方面的信号通路。
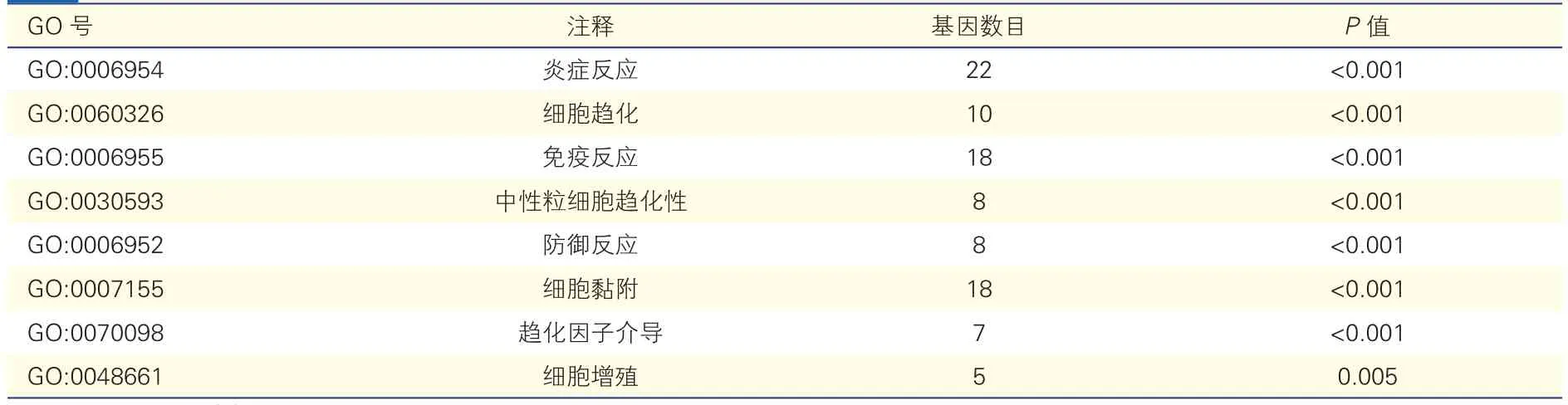
表2 226个差异基因生物学过程的GO分析结果

表3 226个差异基因细胞定位的GO分析结果

表4 226个差异基因分子功能的GO分析结果

表5 226个差异基因KEGG富集分析结果
2.3 蛋白相互作用网络分析
将226个差异基因导入STRING在线数据库构建PPI网络,利用Cytoscape 3.6.1软件中的cytoHubba插件对 PPI 网络图中的基因用Degree算法进行筛选。如图3所示,圆圈颜色越深,代表其度值(degree)越大,本研究以度值排名前十的基因作为关键基因,分别为HGF(degree=23)、KIT(degree=24)、VCAM1(degree=29)、CXCL12(degree=30)、ITGAM(degree=47)、FPR1(degree=26)、CXCL9(degree=24)、CXCR1(degree=24)、TLR8(degree=35)、CXCR2(degree=23)。应用Cytoscape 3.6.1中的MCODE插件发现PPI网络图中有一个显著簇集的模块(图4),图4B模块中包括12个基因,66个边。将模块基因进行GO和KEGG分析,发现其生物过程涉及细胞趋化、炎症反应、免疫反应、血管内皮生长因子的产生、血管生成,模块基因主要位于高密度脂蛋白粒子、细胞外间隙,KEGG通路涉及趋化因子信号通路、受体相互作用、金黄色葡萄球菌感染、补体系统。

图3 226个差异基因的PPI网络
2.4 预测差异靶基因和构建microRNA-mRNA网络(图5、6)
由于microRNA可促进其靶mRNA降解或抑制翻译,在转录后水平调控基因表达,所以用TargetScan数据库分开预测上调和下调的差异microRNA靶基因,并分开与差异基因取交集。结果显示,17个表达上调的microRNA预测靶基因11 404个,与前述85个表达下调的差异基因取交集后得到37个下调差异靶基因,如图5A所示。12个表达下调的microRNA预测靶基因13 679个,与前述141个表达上调的差异基因取交集后得到106个上调差异靶基因,如图6A所示。将这143个差异靶基因做GO和KEGG分析,发现其主要参与炎症反应、细胞趋化等生物学过程,涉及的通路主要是趋化因子信号通路、Rap1信号通路等。利用Cytoscape 3.6.1软件构建差异microRNA-mRNA网络图,如图5B、6B所示,网络中共有22个microRNA,用degree算法筛选,将度值排名前五的microRNA定为关键microRNA,分别为 hsa-miR-656(degree=52)、hsa-miR-4693-5p(degree=41)、hsa-miR-1253(degree=39)、hsamiR-4704(degree=37)和hsa-miR-302f(degree=34)。DAVID 6.8在线分析这5个关键microRNA对应的差异靶基因,发现其主要参与细胞增殖、血管生成、炎症反应等过程,涉及的通路主要是肾素-血管紧张素系统、造血细胞系、磷脂酰肌醇-3-激酶/蛋白激酶 B(PI3K/Akt)、Ras相关蛋白 1(Rap1) 信号通路等。
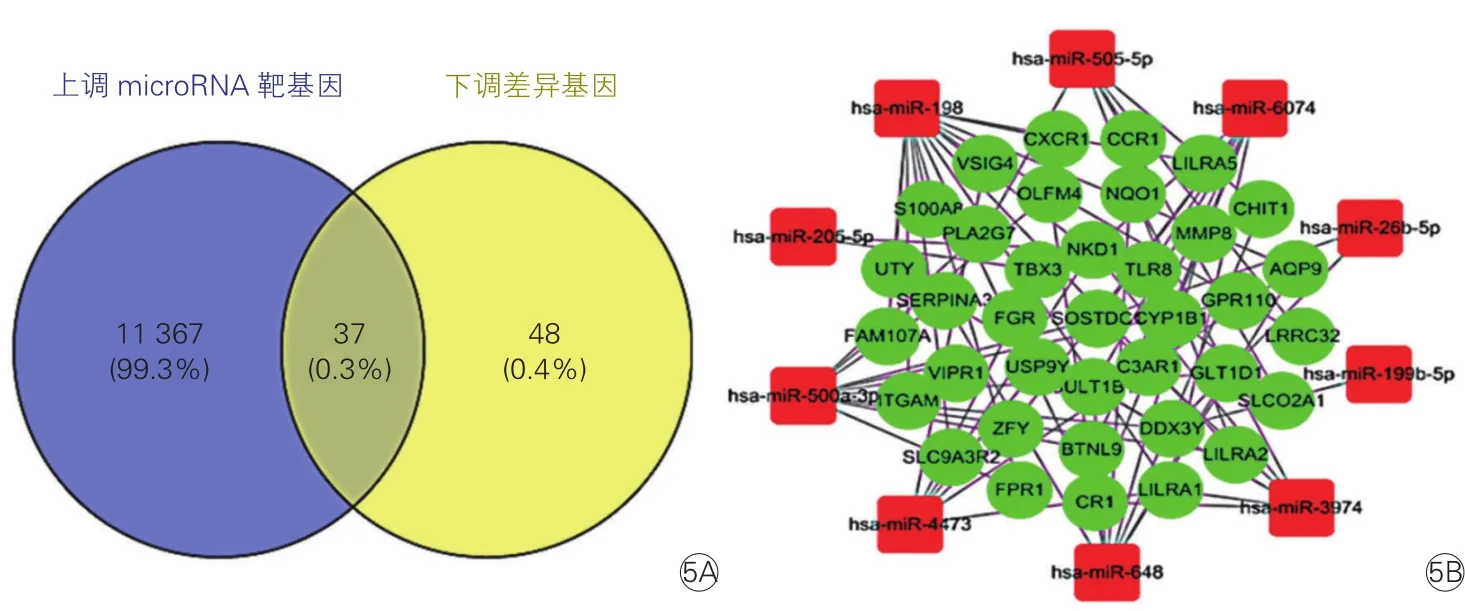
图5 上调差异microRNA-mRNA网络
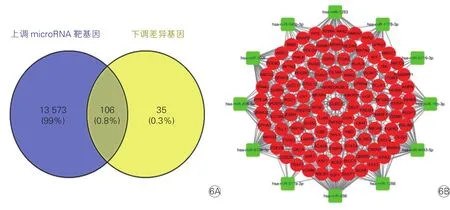
图6 下调差异microRNA-mRNA网络
3 讨论
肺动脉高压是进展性难治性疾病,现有治疗方法不能完全逆转病理重塑,且尚未完全清楚发病机制,因此与肺动脉高压相关的重要基因和通路有待进一步发现。本研究分析mRNA和microRNA表达谱,分别获得226个差异基因(141个上调,85个下调)和29个差异microRNA(17个上调,12个下调),这说明肺动脉高压发病机制复杂,是多个基因相互作用的结果。为进一步了解这些基因在肺动脉高压中的作用,本研究对差异基因、PPI网络中显著簇集的模块基因、microRNA-mRNA网络中差异靶基因分别进行GO和KEGG富集分析,发现生物过程主要涉及细胞增殖、细胞趋化、炎症反应,这与已有研究报道一致,肺血管平滑肌细胞异常增殖,导致内膜增厚、血管顺应性丧失,使血管腔变窄,阻碍血液流动,肺动脉压升高。有研究表明趋化因子水平与肺血流动力学、右心室功能相关,趋化因子也参与肺血管重构过程,如促进细胞增殖、迁移等[6]。炎症研究也越来越受青睐,有报道肺动脉周围有大量炎性细胞浸润,炎性细胞可释放各种细胞因子和趋化因子,导致内皮细胞凋亡,平滑肌细胞增殖,促进肺血管重构,且肺动脉高压患者免疫力低下,炎症容易诱发肺动脉高压加重[7],所以靶向抗炎可能是治疗肺动脉高压新方向[8-10]。
根据PPI网络中度值大小识别出HGF、KIT、VCAM1、CXCL12、ITGAM、FPR1、CXCL9、CXCR1、TLR8、CXCR2这10个关键基因。HGF具有刺激肺血管内皮细胞增殖、促进新生血管形成作用[11],利用基因转染HGF干预肺动脉高压动物模型,发现HGF能降低肺动脉压力从而改善肺动脉高压[12]。KIT编码的一种Ⅲ型受体酪氨酸激酶,与其受体结合后磷酸化,参与调节细胞增殖、凋亡、趋化和细胞分化[13],KIT突变有严重的致癌作用,如胃肠道间质瘤、黑色素瘤、急性髓细胞白血病等[14]。VCAM1编码由促炎细胞因子诱导的黏附分子,有研究报道系统性硬化症合并肺动脉高压(lSSc-PAH)中VCAM1升高[15],但不能作为lSSc-PAH特异性诊断标志物[16]。CXCL9、CXCL12属于趋化因子中CXC亚家族,研究表明CXCL9与心脏重构相关[17],血中CXCL12水平升高与特发性肺动脉高压患者右心室功能障碍有关[18],利用CXCL12中和作用可减轻肺部巨噬细胞浸润,从而改善大鼠肺动脉高压[19]。CXCR属于趋化因子受体家族,趋化因子受体和配体结合发挥重要生物学功能,例如CXCL8是CXCR1和CXCR2的共同配体,靶向过表达CXCL8受体(即CXCR1和CXCR2)的肺动脉内皮细胞,可通过阻断炎症细胞聚集而减轻肺动脉高压[20]。CXCL12是CXCR4的特异性配体,CXCL12-CXCR4轴参与多种组织的病理过程,缺乏CXCL12或CXCR4的小鼠不能存活,而且有神经、血管、心脏方面的发育缺陷[21]。ITGAM基因编码CD11b,与系统性红斑狼疮易感性有关,调节白细胞活化、迁移、黏附[22]。FPR1对血管系统的动态可塑性有重要意义[23],抑制FPR1能减轻肺部炎症和缺氧再灌注心肌损伤[24]。TLR8属于Toll样受体家族,TLR8激动剂有显著的抗肿瘤效应[25]。综上,HGF、VCAM1等6个关键基因已报道与肺动脉高压发生发展相关,KIT、ITGAM、FPR1、TLR8这4个关键基因目前在肺动脉高压中尚无具体研究,但也可能是潜在治疗靶点,需进一步研究。
microRNA是一种小的非编码RNA,研究发现microRNA失调与肺动脉高压的严重程度和预后相关,本研究从microRNA-mRNA网络中识别出hsamiR-656、hsa-miR-4693-5p、hsa-miR-1253、hsamiR-4704和hsa-miR-302f这5个关键microRNA。一项荟萃分析报道miR-656与多种癌症预后相关[26],研究发现长链非编码RNA NORAD通过吸附miR-656促进非小细胞肺癌的发生发展[27]。miR-1253通过靶向WNT5A抑制非小细胞肺癌细胞增殖和转移,可能是治疗非小细胞肺癌的治疗靶点[28]。另外,KIT、VCAM1和CXCL9这三个关键基因是miR-4693-5p靶基因,CXCL9、CXCL12和VCAM1也分别是miR-1253、miR-4704和miR-302f的靶基因。虽然目前尚无这5个关键microRNA在肺动脉高压中的具体研究,但其GO分析提示可能参与发病机制,这为以后的研究提供一些参考。
本研究尚有不足之处,首先,这些在肺动脉高压组中差异表达的基因,尤其是关键基因和关键microRNA,需要通过细胞实验和临床样本进一步验证。其次,这些差异表达基因和差异 microRNA分别是从不同患者肺组织样本中筛选,所以结果会因样本的不同而影响。总之,本研究结果除了揭示肺动脉高压发生发展过程中涉及的关键基因和通路及以生物信息学方法验证已有研究,也为探索新的治疗策略提供了一定的理论依据。
利益冲突:所有作者均声明不存在利益冲突

