右冠状动脉旁路移植策略及早期桥血管通畅率影响因素
张犁雪,陈生龙,刘刚,杨威,廉波,陈彧
右冠状动脉的旁路移植策略是冠状动脉旁路移植术的难点。与前降支不同,右冠状动脉系统的解剖走行和病变特点更为复杂,对于右冠状动脉旁路移植的手术方式也存在更大差异。孙文强等[1]对心外科医师基于冠状动脉造影的术前旁路移植策略制定的研究发现,不同医师对于右冠状动脉区域旁路移植位点和桥材料的选择上差异很大。而目前针对右冠状动脉旁路移植策略的临床研究仍少见。
本研究着眼于右冠状动脉系统,回顾单中心对于右冠状动脉旁路移植的处理方式,总结其病变特点,探讨影响右冠状动脉桥血管术中流量和术后近期通畅率的相关因素,为制定右冠状动脉旁路移植的策略提供依据。
1 资料与方法
1.1 研究对象
回顾2017年8月至2019年6月我院完成患多支血管复杂病变且行冠状动脉旁路移植术的冠心病患者,纳入其中靶血管包括右冠状动脉的患者作为研究对象。排除标准:资料不全者,既往接受过心脏手术、微创手术、急诊手术、术前循环不稳定、同期完成其他心脏或非心脏手术者。经筛选后共241例患者纳入本研究,其中男性178例,女性63例,包含262支右冠状动脉区域桥血管。本研究仅分析患者右冠状动脉干预前后的数据,其它血管干预前后的数据不在分析范围。
1.2 手术及其相关管理
常规正中胸骨切口,显露心脏,采用大隐静脉、乳内动脉、桡动脉作为桥血管材料。全身肝素化(非体外循环旁路移植1 mg/kg,体外循环旁路移植3 mg/kg),非体外循环或建立体外循环后进行靶血管的逐一旁路移植。对于右冠状动脉区域,常规将心脏垫高并适当牵引后显露右冠状动脉靶血管,结合术前造影决定旁路移植位点并进行吻合操作。术后7 d复查冠状动脉CT,评价桥血管通畅性。
1.3 临床资料收集
基线资料:包括患者性别、年龄、吸烟史、术前合并症、NYHA心功能分级、既往心肌梗死病史、既往经皮冠状动脉介入治疗(PCI)史、左心室射血分数(LVEF)及左心室舒张末期内径(LVEDD)。整理并统计241例患者冠状动脉造影中右冠状动脉的病变特点。
手术相关资料:包括靶血管数、右冠状动脉旁路移植部位、右冠状动脉桥血管材料、右冠状动脉桥血管是否为序贯吻合,以及术中血流仪测得的右冠状动脉桥血管的参数,包括流量、搏动指数和舒张血流分数。术后7 d冠状动脉CT血管成像(CTA)评价桥血管通畅性,以Fitzgibbon分级记录:A级:桥血管通畅,无狭窄或狭窄直径<50%;B级:桥血管狭窄直径在50%~99%;O级:桥血管完全闭塞。桥血管通畅率=(桥血管总数-Fitzgibbon B级血管-Fitzgibbon O级血管)/桥血管总数。术后早期桥血管通畅性为本研究的主要研究指标,分析影响桥血管通畅性及流量的相关因素。
1.4 统计学分析方法
采用SPSS 22.0统计学软件进行数据处理。计量资料用均数±标准差描述,组间比较采用t检验;计数资料用百分比(率)表示,采用χ2检验进行组间比较。应用Logistic回归预测桥血管通畅性相关因素,应用多重线性回归预测桥血管流量,其中桥血管材料以设置哑变量方式赋值。以P<0.05表示差异有统计学意义。
2 结果
2.1 患者基线及手术相关资料情况(表1)
全组患者均干预右冠状动脉系统。241例患者以老年 [(62.5±8.8)岁 ]、男性 [178 例(73.9%)]为主,其中合并有高血压151例(62.7%)、NYHA心功能为Ⅰ/Ⅱ级55例(22.8%),术前LVEF平均值为(62.3±10.3)%, LVEDD 为(5.1±0.6) cm。全组非体外循环旁路移植153例(63.5%),平均靶血管数(3.2±0.8)个。
右冠状动脉旁路移植部位选择的方式包括:单纯右冠状动脉主干旁路移植76例(31.5%),单纯后降支(PDA)旁路移植81例(33.6%),单纯左心室后支(PL)旁路移植15例(6.2%),PDA+PL旁路移植54例(22.4%),右冠状动脉主干+PDA旁路移植12例(5%),右冠状动脉主干+PL旁路移植3例(1.2%)。
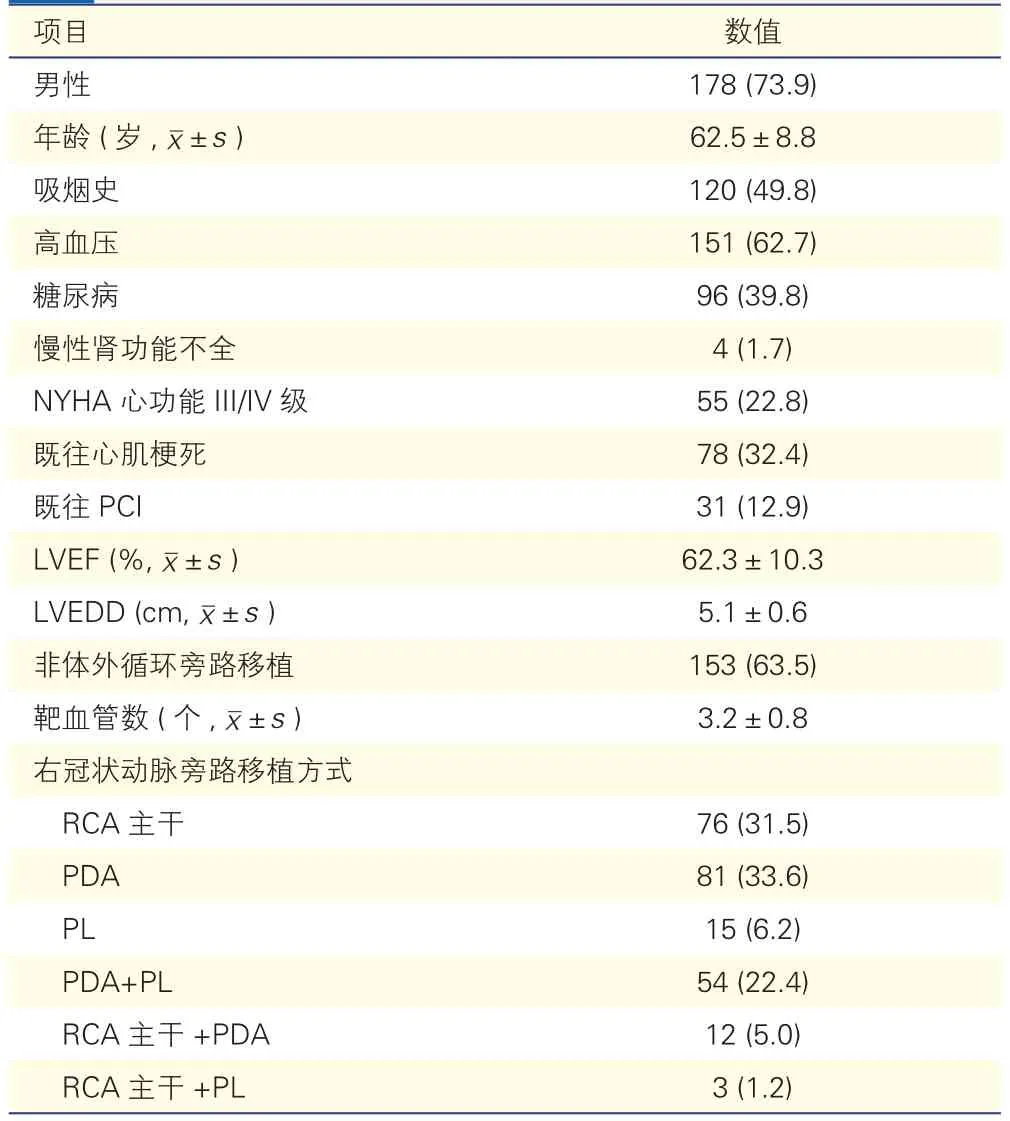
表1 241例患者基线及手术相关资料情况[例(%)]
右冠状动脉桥血管相关数据(表2):241例患者对应262支桥血管中,88支(33.6%)旁路移植在右冠状动脉主干,174支(66.4%)移植在右冠状动脉远端分支(PDA及PL);75支(28.6%)为序贯吻合桥;238支(90.8%)桥血管材料为大隐静脉。术后1周总体桥血管通畅率为96.2%(252/262)。
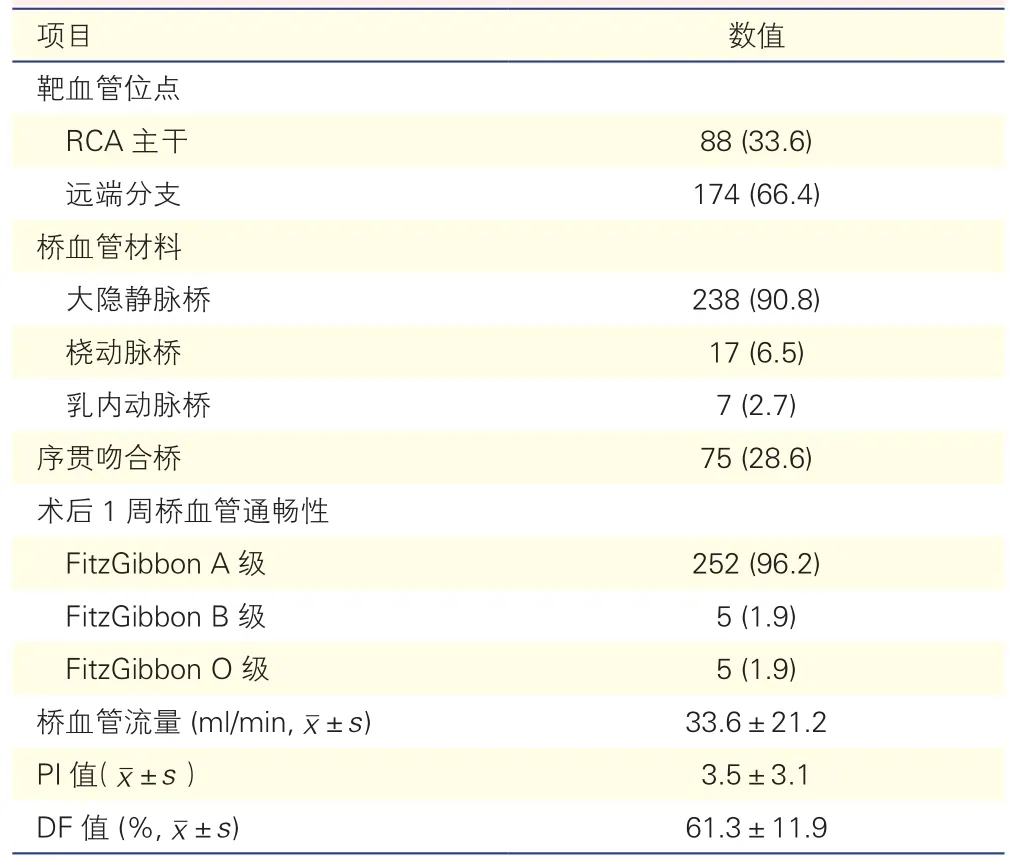
表2 241例患者对应的262支右冠状动脉桥血管相关数据[支(%)]
2.2 右冠状动脉病变特点及旁路移植部位(表3、图1)
右冠状动脉病变特点按主干、PDA及PL区域划分。(1)227例(94.2%)患者存在右冠状动脉主干病变(重度狭窄),其中101例(41.9%)为局限病变,23例(9.5%)为弥漫病变,77例(32.0%)为闭塞性病变,另有26例(10.8%)为后三叉病变。(2)142例(58.9%)存在右冠状动脉PDA病变,其中102例(42.5%)为局限病变,40例(16.6%)为弥漫病变。(3)96例(39.8%)存在右冠状动脉PL病变,其中61例(25.3%)为局限病变,35例(14.5%)为弥漫病变。(4)侧支循环:分别有60例(24.9%)、79例(32.8%)及30例(12.4%)的患者可见右冠状动脉自身侧支、左向右侧支及右向左侧支循环的建立(表 3)。
右冠状动脉旁路移植部位及病变特点关系(图1):(1)右冠状动脉主干局限病变中,36.6%(37/101)选择单纯干预右冠状动脉主干,而多数(63.4%,64/101)对PDA和(或)PL进行了旁路移植;(2)右冠状动脉弥漫病变时只移植右冠状动脉主干者占21.7%(5/23);(3)右冠状动脉主干闭塞性病变中,37.7%(29/77)选择单移植右冠状动脉主干,46.8%(36/77)选择单纯PDA干预;(4)右冠状动脉后三叉病变及单纯分支病变时,以处理远端分支为主,较多选择PDA及PL旁路移植的方式,单纯干预右冠状动脉主干者仅占12.5%(5/40);(5)另有7例选择移植在发出PDA以后的主干部位,其中有4例为后分叉处病变,1例为右冠状动脉全程的弥漫钙化。
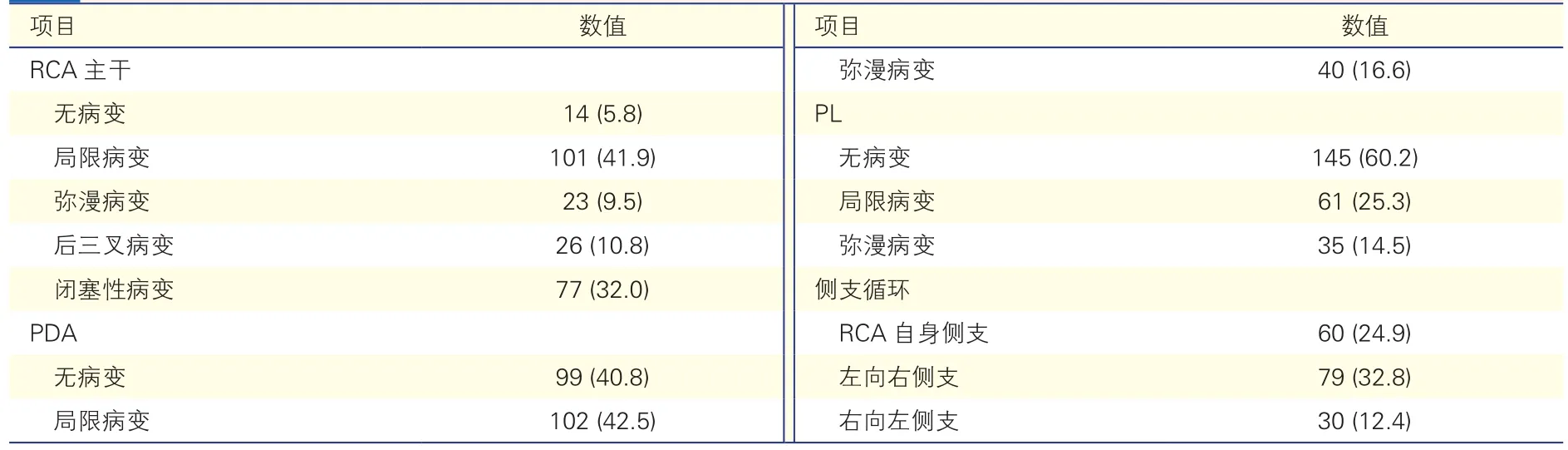
表3 241例患者右冠状动脉病变特点[例(%)]
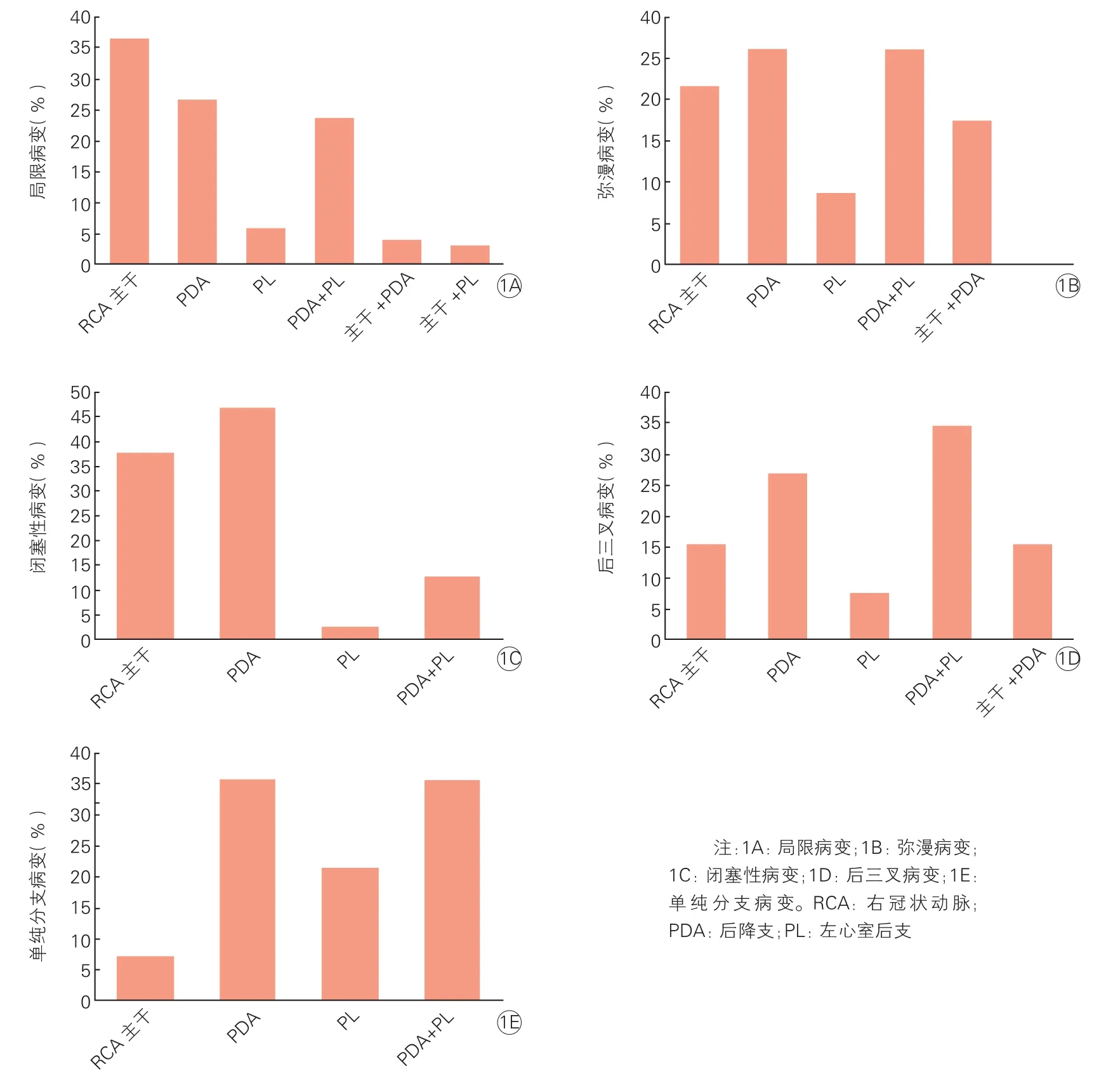
图1 右冠状动脉旁路移植部位及病变特点关系
262支桥血管体外循环与非体外循环旁路移植于右冠状动脉主干的比例(表4):非体外循环旁路移植中,25.5%(41/161)的桥血管移植于右冠状动脉主干,而体外循环旁路移植中则有46.5%(47/101)的桥血管移植于右冠状动脉主干,二者比较差异具有统计学意义(P<0.001)。

表4 241例患者对应262支桥血管体外循环与非体外循环移植于右冠状动脉主干的比例[支(%)]
2.3 影响桥血管通畅性的因素
右冠状动脉桥血管通畅与否单因素分析(表5):241例患者262支桥血管,按FitzGibbon分级分为通畅(Fitzgibbon A级)者252支,不通畅者(Fitzgibbon B+O级)10支。单因素分析提示,两者在桡动脉桥、PI值方面差异均有统计学意义(P均<0.05)。
术后早期桥血管通畅率相关因素Logistic回归分析(表6):应用Logistic回归分析评估包括桥血管材料、靶血管位点(右冠状动脉主干或远端分支)、序贯吻合、右冠状动脉闭塞性病变、桥血管流量与PI对桥血管通畅性的影响。得到的Logistic模型具有统计学意义(χ2=17.007,P=0.001),该模型能够正确分类96.2%的研究对象。Logistic回归分析结果显示,桡动脉桥术后早期不通畅的风险是静脉桥的21.973倍;PI值每增加1,桥血管不通畅的风险增加17.4%。
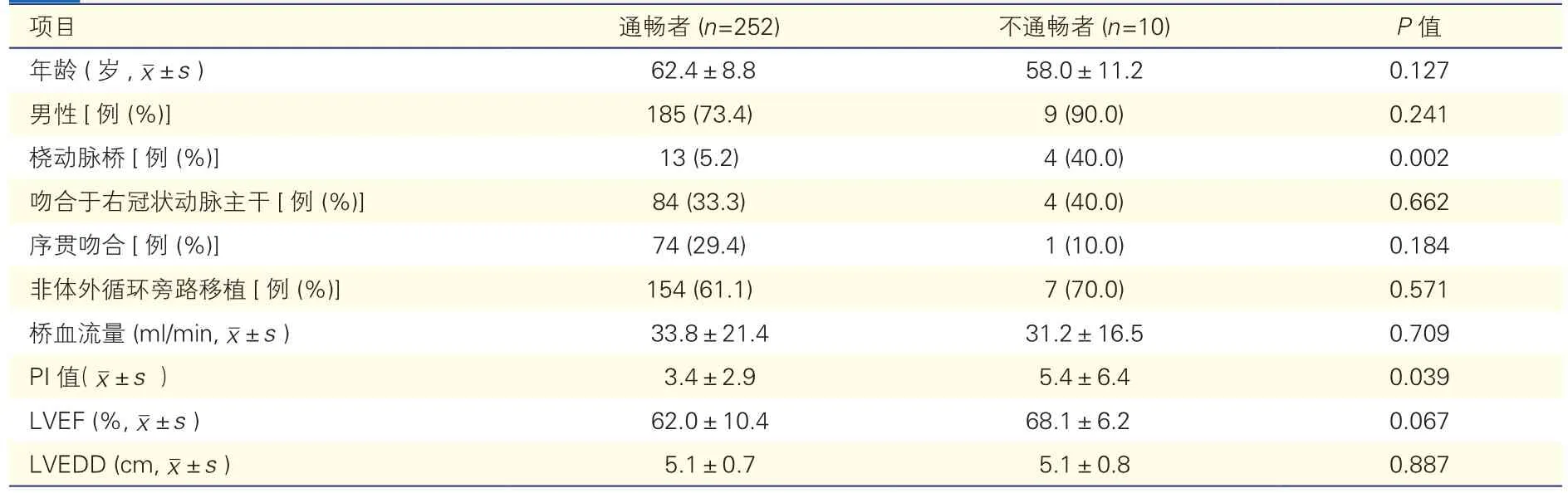
表5 241例患者对应的262支右冠状动脉桥血管通畅与否单因素分析
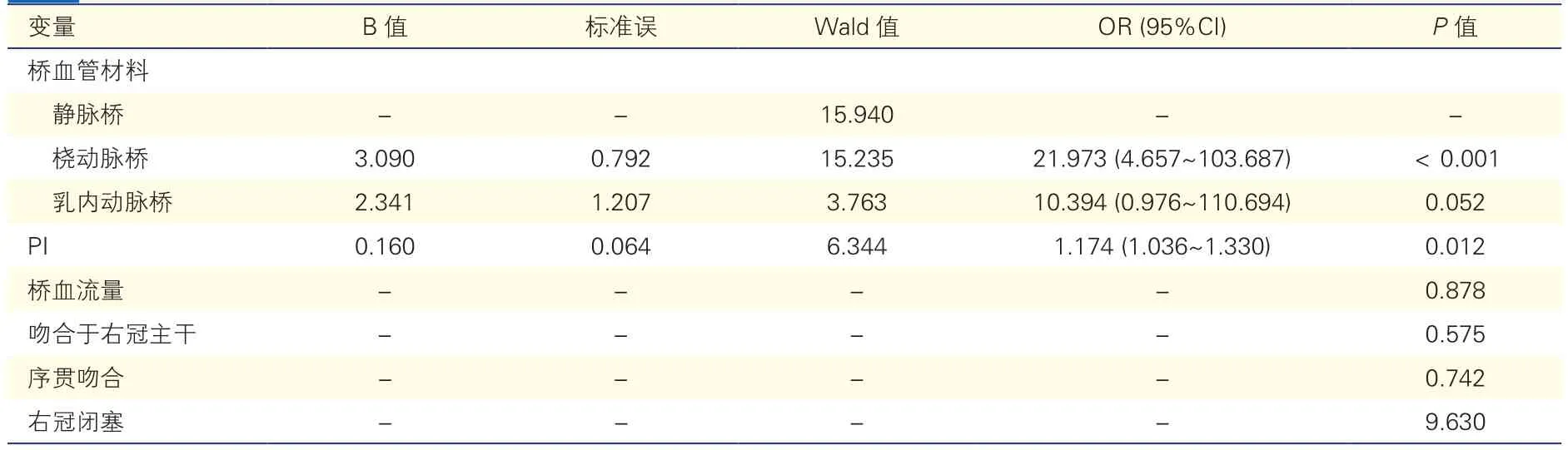
表6 患者术后早期桥血管通畅率相关因素Logistic回归分析
2.4 影响桥血管流量的因素(表7)
多重线性回归分析评估使用桡动脉桥、靶血管位点、序贯吻合与右冠状动脉闭塞性病变对术中桥血管流量的影响。得到的线性回归模型具有统计学意义 [F(4,257)=13.083(P<0.001)],调整R2=0.156。模型纳入的自变量中,靶血管位点及序贯吻合具有统计学意义。靶血管吻合于右冠状动脉远端分支的桥血管流量预测值差于吻合于右冠状动脉主干(B=-11.126,P<0.001),序贯吻合与非序贯吻合相比,其桥血管流量显著提高(B=19.954,P<0.001)。
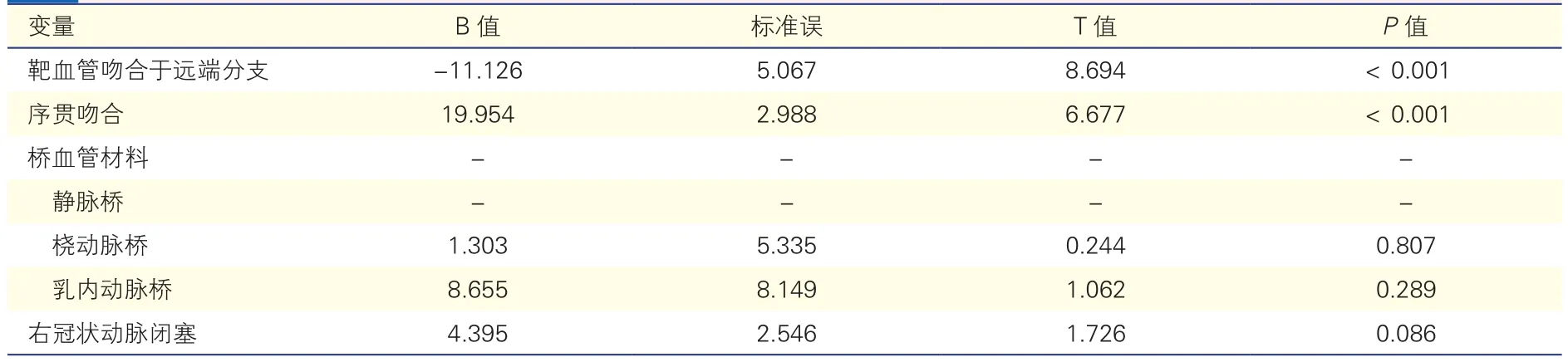
表7 术中影响桥血管流量的多重线性回归分析
3 讨论
本中心自2016年开始进行旁路移植策略研究,旁路移植术前每一位心外科医师基于冠状动脉造影制定患者的旁路移植策略,并收集实际旁路移植方式的资料。结果表明:(1)不同医师制定的术前策略中,关于右冠状动脉系统的靶血管位点和桥材料选择上差异最大;(2)术前制定的旁路移植策略与实际完成方式的符合率右冠状动脉系统最低[1]。这一结果反映了不同医师对于右冠状动脉病变的认知差异,也在一定程度上说明右冠状动脉病变的复杂性和较难预测性。
多数国人右冠状动脉主干走行于房室沟内,并发出PDA走行于后室间沟,为下后壁及室间隔的心肌供血;也多存在较大的PL,走行至左心室后壁,为相应区域供血。对于右冠状动脉旁路移植部位的选择,往往需要综合病变位置特点、靶血管条件、位点在术中是否好显露三个因素。对于病变,主干、PDA及PL段均可能会存在多节段、弥漫、闭塞等不同类型的病变,也存在后分叉处的重度狭窄;不同患者PDA和PL的条件存在差异,对于较小的分支需判断旁路移植的必要性;还有些理想的旁路移植部位却较难在术中显露出来,如过于靠近端的主干或较远的PL。多因素的混杂使得右冠状动脉旁路移植策略的制定和实施上存在难度。
既往对于右冠状动脉旁路移植选择主干或远端分支的研究不多,且尚存在争议。Songur等[2]针对右冠状动脉旁路移植靶点选择的研究显示,移植于右冠状动脉主干的静脉桥的远期通畅率显著高于移植至PDA。而Aksut等[3]的一项纳入92例患者的回顾性研究则指出,PDA桥的通畅性高于右冠状动脉主干桥,应作为旁路移植首选部位。研究者认为桥血管的远期通畅性仍与获取、吻合等技术相关,而位点的选择则是病变位置、特点、靶血管条件、显露程度、体外循环或非体外循环等因素被综合考虑后的结果。本研究显示,右冠状动脉旁路移植部位是术中桥血管血流量的独立预测因素,移植于右冠状动脉主干与移植于远端分支相比流量更高,但这一优势未体现在术后早期的桥血管通畅性上;同时,当右冠状动脉病变局限在主干、PDA和PL条件尚可时,多会选择主干旁路移植,而选择干预PDA和PL的患者中,分叉处病变、分支病变的比例更高;主干闭塞时,也有很大比例会选择干预PDA;非体外循环旁路移植更倾向于选择远端分支作为旁路移植位点。
值得指出的是,右冠状动脉主干的旁路移植部位往往选择在发出PDA前的主干上,但本研究241例患者中,有7例选择移植在发出PDA以后的主干部位,其中有4例为后分叉处的病变,1例为右冠状动脉全程的弥漫钙化;7例术中桥血流满意,术后1例桥闭塞,另6例通畅。
对于右冠状动脉闭塞性病变,造影所能提供的信息相对较少,闭塞远端情况可通过侧支显影部分评估,多仍需要结合冠状动脉CTA等其他手段以及术中判断。闭塞右冠状动脉的病变范围多位于近中段,可选择远段主干进行旁路移植;当判断出PDA条件良好时,也可作为闭塞冠状动脉的旁路移植位点。有些闭塞的血管提示病程较长、程度更重,主干和分支整体血管条件差,这类右冠状动脉的旁路移植部位较难选择,往往在术中选择条件相对尚可、较好显露的位置进行吻合,但桥血流情况难以保证。这提示应重新评估这类右冠状动脉干预的必要性。Borowski等[4]的研究认为,对于右冠状动脉慢性闭塞性病变的旁路移植策略,不应仅基于术前造影,还应结合室壁运动、存活心肌综合评估,因为这些因素会影响到桥血管血流的情况。
本研究中多数桥血管选择大隐静脉作为桥材料,桡动脉的使用是术后早期桥血管不通畅的危险因素,可能与其早期较高的桥血管痉挛及线样征发生率相关。近年来,多动脉桥的应用在逐渐增加,但在国内及欧美仍属少数[5]。动脉桥的优势体现在远期的通畅性上[6]。有研究报道[7],大隐静脉桥移植于右冠状动脉后的中期闭塞率在12.7%~37.0%,远期闭塞率为30%~68%,而桡动脉的5年闭塞率为10%~17%,远期17%~25%,优于静脉桥,但尚无证据支持这一优势能够转化为预后的改善。乳内动脉则理论上能够提供更好的通畅率[8]。目前对于桡动脉的应用,建议靶血管狭窄程度大于90%[9],而桡动脉在术后1年的随访中,出现线样征的比例较高。
本研究为回顾性研究,在分组中存在选择偏倚;冠状动脉造影的结果由临床心外科医生解读,存在一定主观性;尚无桥血管通畅性的中远期随访结果,有待后续研究的扩充;而研究中涉及的流量测定,亦受血压、探头型号等多种因素干扰。通过该研究可以看出,右冠状动脉病变的复杂性和不可预测性高,其旁路移植方式应综合考虑病变部位、特点、靶血管条件、术中显露等因素,制订个体化的右冠状动脉旁路移植策略。
利益冲突:所有作者均声明不存在利益冲突

