慢性肾脏病伴肌少症患者骨密度改变的临床研究
余明钿 张慧珍 洪富源 杨声平 张艳敏 陈文新*
1.福建医科大学省立临床医学院/福建省立医院核医学科,福建 福州 350001
2.福建医科大学省立临床医学院/福建省立金山医院超声科,福建 福州 350028
3.福建医科大学省立临床医学院/福建省立医院肾内科,福建 福州 350001
骨质疏松是一种骨量减低、骨强度受损、导致骨折风险增加的一种全身性骨病[1]。慢性肾脏病(CKD)是一种以肾功能逐渐丧失为特征的高发性疾病,在我国CKD的患病人数达到1.2亿,并且在持续增高[2]。肌少症已成为近年来国内外研究的热点,是与生理性衰老过程相关的综合性疾病,其在老年人中的主要表现为肌肉力量、质量和/或功能的丧失,易引起老年人跌倒、骨折、残疾、死亡等[3]。CKD及伴肌少症患者常伴骨代谢异常,较易继发骨质疏松,增加骨折风险,严重影响CKD患者生活质量。本研究以CKD及伴肌少症患者为研究对象,观察其骨密度变化情况。
1 材料和方法
1.1 研究对象
收集2017年至2018年在我院住院的CKD患者123例(CKD组),男性61例,女性62例,年龄33~85岁,平均年龄(59.8±12.6)岁,经临床医师确诊为CKD并进行保守治疗;对照组57例,男性21例,女性36例,年龄41~82岁,平均年龄(58.2±8.3)岁,均来自我院健康体检中心。研究对象的一般资料,饮酒、吸烟等生活习惯、生活地域相似。排除标准:所有植入金属材料史的患者,以及关节炎、帕金森病、肝脏疾病、截肢、癌症、神经性疾病和中风后遗症等患者。
1.2 研究方法
入组病例均测量6 m步速、记录双手握力和应用双能X线骨密度仪进行检测以获得髋部、腰椎骨密度和体质成分。CKD组通过核医学的核素肾动态显像来测得患者的肾小球滤过率GFR,依据GFR和美国肾脏病基金会(KDIGO)指南[4]对CKD组进行分期,分为CKD1、2、3、4、5期,因收集的病例数有限,将CKD1期和2期的病例合并为一组(CKD1组),CKD3、4、5期的病例合并为一组(CKD2组)。
1.2.1肾小球滤过率(glomerular filtration rate,GFR)检测:肾动态显像:显像剂99锝m-二乙三胺五醋酸(99Tcm-DTPA)由广东希埃医药有限公司福州分公司提供,放射化学纯度>95 %,体积<0.5 mL,饮水300 mL,受检者取仰卧,采用GE Discovery NM/CT 670型SPECT仪,探头对准双肾和膀胱,准直器为低能高分辨型。肘静脉“弹丸”式注射99Tcm-DTPA 185MBq,启动动态采集程序,勾画双肾感兴趣区,Gate法获得GFR值。
1.2.2双能X线骨密度仪(DXA)检测与诊断:应用DXA(美国HOLOGIC,型号:Discovery W)对所有受检者进行腰椎、髋关节骨密度(bone mineral density,BMD)测定;行全身扫描用于体质成份分析,测得四肢骨骼肌质量(ASM),相对四肢骨骼肌质量指数(RASMI),RASMI=ASM/身高2(kg/m2)。骨质疏松、骨量减少的诊断依据原发性骨质疏松症诊治指南(2017年)[5]。
1.2.3肌少症的评估与诊断:以日常步行速度通过6 m距离的测量方法获得受试者步速,评估肌肉功能[6]。通过液压式握力器(USA JAMAR)检测手握力,指导受试者手抓握力器手柄匀速加力至最大并坚持3 s,左右手各测3次,取其中最大数值为握力值。以握力值评估肌肉强度,RASMI作为肌肉质量的评估指标[6]。
以2016年中华医学会骨质疏松和骨矿盐疾病分会的步骤[7]进行评估、筛查;依据亚洲肌少症工作组提出的诊断标准诊断肌少症[8]。
1.3 统计学处理

2 结果
2.1 研究对象的骨密度
CKD1组55例,总GFR(80.8±12.6)mL/min;诊断骨质疏松13例,骨量减少30例,骨密度正常12例;CKD2组68例,总GFR(25.2±18.1)mL/min,诊断骨质疏松21例,骨量减少31例,骨密度正常16例。对照组与CKD2组在腰椎(L1-L4)、髋部及股骨颈T值差异均有统计学意义,CKD1组与CKD2组股骨颈骨密度差异有统计学意义。详见表1、图1。对照组的腰椎、髋部和股骨颈骨密度与CKD1组比较,差异均无统计学意义;CKD1组髋部骨密度与CKD2组比较,差异无统计学意义。
2.2 CKD患者罹患肌少症情况
CKD患者罹患肌少症情况,见表2。

图1 对照组与CKD各部位BMD T值比较Fig.1 The comparison of T values of bone mineral density at different body parts between control group and CKD2 group
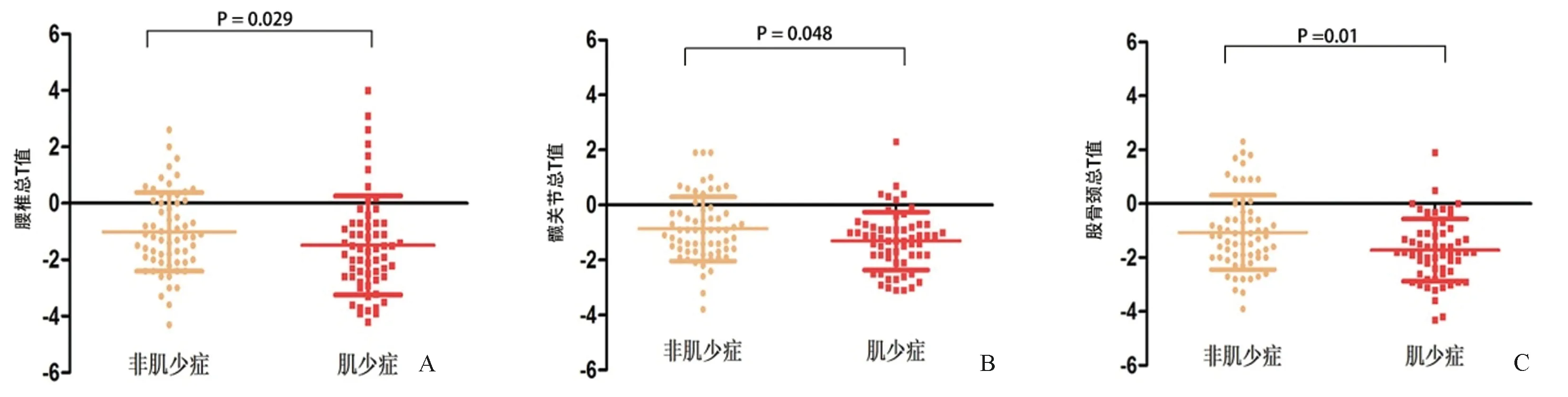
图2 CKD患者肌少症组和非肌少症组各部位BMD T值比较Fig.2 The comparison of T values of bone mineral density at different body parts between sarcopenia group and non-sarcopenia group in CKD patients
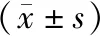
表2 CKD患者肌少症资料Table 2 The sarcopenia data in CKD
2.3 CKD伴肌少症患者BMD T值改变情况分析
CKD伴肌少症组60例,诊断为骨质疏松25例,非肌少症组63例,诊断为骨质疏松13例,肌少症组和非肌少症组骨质疏松的发生率分别为41.7%、20.6%。、差异具有统计学意义(χ2=6.367,P=0.012),见表3。
肌少症组BMD T值:腰椎-1.65(-2.60~-0.70),髋关节:-1.25(-1.88~-0.80),股骨颈:-1.80(-2.58~-1.10),非肌少症组BMD T值:腰椎-1.20(-2.00~0.10),髋关节:-0.90(-1.70~-0.30),股骨颈:-1.20(-2.00~-0.30)。肌少症组的腰椎、髋关节和股骨颈BMD T值与非肌少症组差异均具有统计学意义(Z=2.179,P=0.029;Z=1.975,P=0.048;Z=2.574,P=0.01)。见图2。
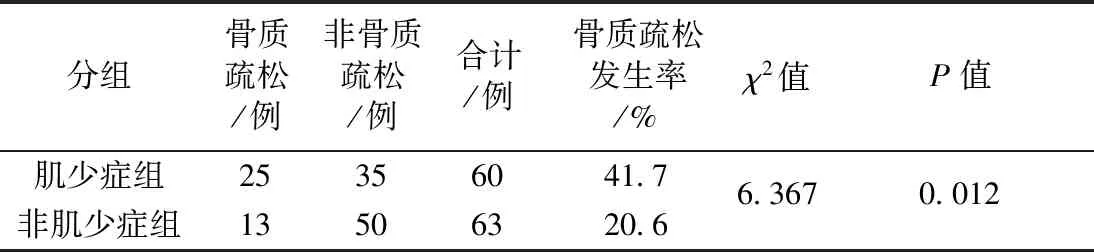
表3 肌少症组和非肌少症组骨质疏松发生率比较Table 3 The incidence of osteoporosis between sarcopenia group and non-sarcopenia group
3 讨论
CKD是一种日益严重的国际健康问题,其是一种分解代谢状态,不同阶段均可能继发不同程度的蛋白摄入减少、蛋白质-能量高消耗,代谢性酸中毒、性激素减少、肌肉生长抑制素过度表达等[9],且可能导致肢体运动减少,骨骼肌强度减低、肌纤维质量减少,代谢能力降低和耐力减低而发生肌少症。
CKD患者骨的异常主要包括矿化、转运和骨量异常,易导致继发性骨质疏松症,骨强度受损程度相对自然衰老更为严重。本研究表明,随着CKD的进展,CKD1组和CKD2组患者各部位的骨密度均呈下降趋势,CKD2组各检测部位骨密度均显著低于对照组,提示随着肾功能的下降,CKD患者发生骨折的风险明显增加,与文献报道相似[10-11]。据美国CKD数据库管理的数据调查报告,透析患者的髋部骨折风险是一般人群的7.5~13.6倍[12]。CKD继发甲状旁腺功能亢进等也是导致CKD患者罹患骨质疏松的原因。
人体的肌肉与骨骼都来自于胚胎发育阶段的间充质祖细胞,不仅在解剖位置上毗邻,还具有相似的内分泌和旁分泌调节功能,相似的信号调节通路,并有共同的治疗靶点[13-14],因此在两者的发生、发展中有着千丝万缕的联系,有时将二者的异常作为“活动功能障碍综合征”[15]进行研究。肌少症者罹患骨矿含量减少或骨质疏松症的风险明显高于一般人群[16];一项对679例英国老年患者的横向研究显示,肌少症较非肌少症患者罹患骨质疏松的风险增高达2倍[17]。本研究发现,在CKD患者中,肌少症组骨质疏松的发生率也显著高于无肌少症组。因此肌少症与骨密度减少往往同时存在,导致患者体力活动减少,骨骼肌对骨架结构的刺激减弱,又继而造成成骨细胞的作用减退。
总之,CKD伴肌少症患者罹患骨质疏松的风险较高,导致患者活动能力下降,骨折、跌倒的风险增加,是严重降低CKD患者生活质量甚至是导致死亡的病因之一。CKD中晚期患者尤其应常规监测骨密度,有效预防发生骨质疏松的并发症,提高患者生活质量。

