氯化锂对骨质疏松大鼠股骨干骨折愈合早期影响的研究
姜劲松 李精敏 李琦
山西省运城市中心医院,山西 运城 044000
骨质疏松性骨折是一种临床上常见的疾病,给患者和家庭带来严重的影响;及时、可靠的骨折愈合对于改善骨质疏松患者的早期活动能力、降低骨折复发风险、减轻由此给患者和医疗系统带来的社会经济等负担至关重要[1]。在这些患者中,由于术后并发症、内植物失败和医学合并症的高风险,骨折愈合过程往往是漫长而复杂的。即便骨折可以愈合,由于骨质疏松状态的影响和骨修复能力变差,达到愈合的时间可能更长[2-3]。在骨折愈合过程中,当富含软骨细胞的软骨痂转变为富含成骨细胞的矿化基质时,Wnt信号达到高峰;因此,通过促进Wnt通路的上调提供一种促进骨折愈合的策略。锂是GSK-3β抑制剂,在典型的Wnt通路中能促进β-catenin的表达[4]。锂可以促进骨合成代谢作用,促进成骨细胞的分化和增殖[5-6]。但是关于锂是否能够促进骨质疏松骨折愈合的研究,目前国内尚未见报道。因此,本研究的目的是评价锂在骨质疏松性骨折早期愈合中的作用。
1 材料和方法
1.1 动物
20只24月龄Sprague-Dawley(SD)雄性大鼠购买至上海实验动物有限公司。大鼠饲养在温度受控的室内(25 ℃),恒定湿度(40%~50%)并可以自由进行饮食。大鼠适应性饲养1周后随机分成治疗组和对照组,每组10只。
1.2 模型建立和治疗
在全麻下制作右侧股骨干中段骨折模型。通过腹膜内注射戊巴比妥钠(1%,0.4 mL/100 g,Sigma-Aldrich,St Louis,MO,USA)麻醉大鼠,待麻醉满意后然后将大鼠放置并固定在一个位置,剃除右大腿毛发并消毒。通过股骨外侧制作1.0 cm切口,剥离肌肉后暴露股骨干,使用线锯(RA-II,7.2 V,Kangyu Medical Instruments Co.,Ltd.,Guangzhou,China)在股骨干中段制作股骨干骨折模型。将经过消毒的克氏针(ø1 mm,Jinhuan Medical Products Co.,Ltd.,Shanghai,China)从股骨远端髓腔插入并到达股骨近端。生理盐水冲洗骨折部位后,逐层缝合筋膜和皮肤。随后治疗组每日给予氯化锂200 mg/kg灌胃进行干预[7],对照组给予同样的生理盐水处理。
1.3 样品获得和相关指标检测
大鼠股骨骨折模型建立后4周,经腹主动脉抽血并过量麻醉后行安乐死,所有大鼠在安乐死前禁食8 h。取下右侧股骨后对表面软组织和肌肉进行清理。股骨使用Micro-CT扫描,生物力学测试用于评估骨折愈合情况。其余的股骨保存在中性缓冲甲醛(10 %,pH 7.4)中进行组织学检查。
骨折愈合情况使用锥形束型台式Micro-CT(Micro-CT40,Scanco Medical AG,Bassersdorf,Switzerland)扫描分析,获得各向同性体素尺寸为10.5 μm(70 kV,114 μA)180个投影。使用具有协议(sigma=1.0和support=1.0)的三维高斯滤波器抑制灰度图像的噪声。使用已建立的方案将新形成的骨痂组织与旧皮质区分开(较低衰减=165和较高衰减=368)。密度最高的组织代表高度矿化的新骨痂组织,而低密度组织代表新形成的骨痂组织。获得骨折部位上下5 mm(共486个切片)区域作为感兴趣区域(ROI)。使用手动绘制的轮廓在二维(2-D)CT图像上选择ROI。使用制造商软件计算骨量/总体积百分比(BV/TV,%)、小梁厚度(Tb.Th,mm)、小梁数(Tb.N,1 / mm)、小梁分离(Tb.Sp,mm)和骨小梁骨密度(mg HA /cm)。多平面重组用于获得三维图像。骨密度(bone mineral density,BMD)阈值(211 mg/cm3)将矿化组织与周围物质分离。
待Micro-CT检测后取出克氏针,双侧固定。运用最大载荷为225 N的试验机(BOSE 3520-AT,Eden Prairie,MN)和内置软件通过三种弯曲试验来评估生物力学性能。大鼠股骨水平放置在机器的固定装置(23 mm跨度)上。以2 mm/min的速度压迫骨折中心部位直至骨折。测量的参数包括最大载荷,刚度(由应力-应变曲线的斜率得到)和杨氏模量。
用4 %多聚甲醛PBS(pH 7.27.4)溶液固定标本,于4 ℃下脱钙8周,在分级乙醇和石蜡包埋中进行标准脱水处理。从截骨部位切取矢状面5 μm切片(MicromHM 360,Waldorf,德国),然后进行苏木精-伊红(HE)染色,按标准方法进行组织学评价。在光学显微镜(日本奥林巴斯,B2021T-PHD-J11)下,使用附在显微镜上的AxiocamICc3数码相机(CarlZeiss)获取组织学图像,并用内置软件进行处理。
治疗结束时处死大鼠,获取血清样本,用酶联免疫吸附试验(ELISA)试剂盒测定各组动物的血清Ⅰ型胶原氨基端延长肽(P1NP)和β-I型胶原羧基端肽(CTX)水平。CTX-I是骨吸收的生物标志物,P1NP作为骨形成的生物标志物,用商品化试剂盒(Cusabio,中国武汉;CTX的批内和批间变异系数分别为<7%和<8%;批内精密度:CV<6%;批间精密度:CV <7%)定量。
1.4 统计学分析
数据分析均采用SPSS 19.0进行,采用Mann-WhitneyU检验比较各组大鼠血清指标。采用Wilcoxon秩和检验对各组参数进行分析。采用卡方检验比较各组的组织学参数。统计学意义设定在P<0.05的水平。
2 结果
2.1 实验动物一般情况
在实验期间未发现有动物死亡,治疗期间未发现动物有明显异常和切口感染,所有大鼠均完成4周的治疗。
2.2 Micro-CT分析
图1显示了两组的三维重建图像。骨折周围骨组织的组织形态计量学显示,治疗组在4周时有明显的、更多的骨痂形成,治疗组4周时BV/TV、Tb.Th、Tb.N、Conn.D及BV、TV密度均显著高于对照组(P<0.05),Tb.Sp显著低于对照组(P<0.05)。

图1 Micro-CT三维重建观察骨折愈合情况及检测的微观结构参数 A:骨折部位三维重建结果;B:BV/TV;C:Tb.Th;D:Tb.N;E:Conn.D;F:Tb.Sp;G:BV密度;H:TV密度。注:与对照组比较,*P<0.05。Fig.1 Micro-CT three-dimensional reconstruction to observe fracture healing and detect microstructure parameters A:three-dimensional reconstruction results of fracture site;B:BV/TV;C:Tb.Th;D:Tb.N;E:Conn.D;F:Tb.Sp;G:BV density;H:TV density.
2.3 组织学研究
术后4周时,治疗组骨折部位周围组织切片的图像显示出更多软骨内骨化,还能观察到一定量的皮质骨连接。然而,对照组的骨痂组织主要由纤维软骨组成,并且观察到较少稀疏分布的编织骨或皮质的重建。见图2。
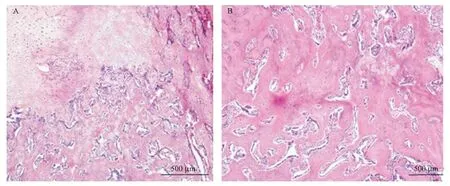
图2 治疗4周时股骨骨折部位的H&E染色切片 A:对照组;B:治疗组。Fig.2 H&E stained sections of the femoral fracture at 4 weeks of treatment A:control group;B:treatment group.
2.4 生物力学结果
术后4周时,治疗组的极限负荷显著高于对照组。与对照组相比,能量参数显示治疗组显著增加。就刚度而言,与对照组相比,治疗组有明显改善。此外,治疗组显示出比对照组更高的弹性模量。见图3。
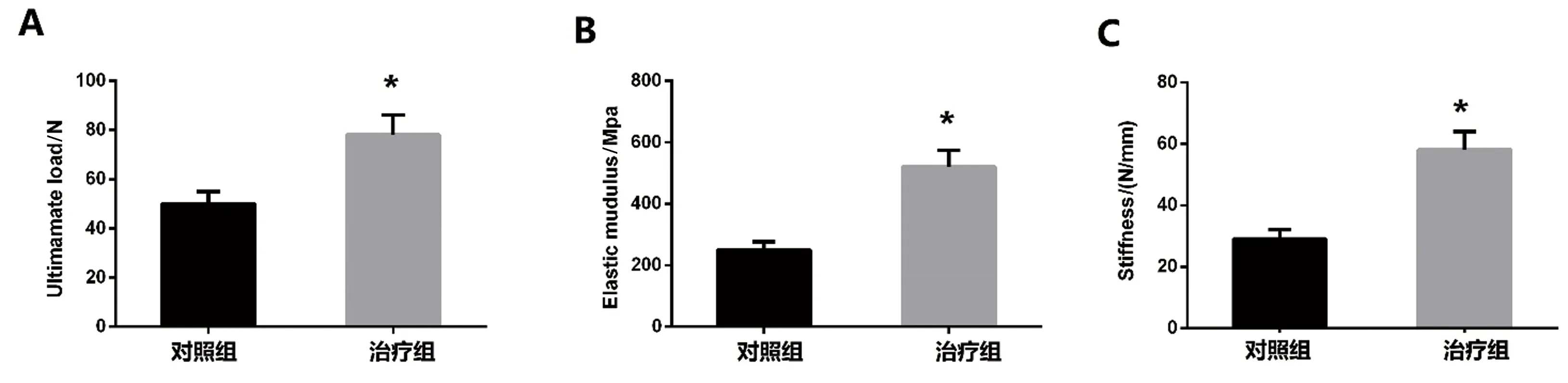
图3 治疗4周对骨折部位生物力学的影响 A:最大载荷;B:弹性模量;C:刚度。注:与对照组比较,*P<0.05。Fig.3 Effect of 4 weeks of treatment on biomechanics of fracture site A:ultimate load;B:elastic modulus;C:stiffness.
2.5 骨代谢指标比较
与对照组相比,在治疗组中观察到骨吸收标志物(CTX)和骨形成标志物(PINP)的血清水平显著改变。老年大鼠给予锂治疗后血清CTX水平显著降低,而PINP水平显著增加,和对照组比较有显著统计学意义(P均<0.05)。

图4 血清骨转换标志物水平的改变 A:PINP;B:CTX。注:与对照组比较,*P<0.05。Fig.4 Changes in serum bone turnover marker levels A:PINP;B:CTX.
3 讨论
本研究使用老年大鼠股骨干模型模拟骨质疏松骨折,使用氯化锂干预4周后,通过生化、影像学以及组织学来观察骨折愈合情况。结果显示,氯化锂干预后能显著降低大鼠体内骨吸收指标水平,并且促进骨形成,同时显著加速骨折愈合。这些结果表明,氯化锂使用可以一定程度地改善骨质疏松骨折愈合,不失为一种辅助治疗方案。
骨质疏松症的病理状态伴随微结构损伤,过度炎症信号传导和机械不稳定严重损害了骨质疏松性骨折的早期愈合。因此,早期药物干预对于预防骨质疏松性骨折中不愈合的发生是有益的和必要的。Wnt /β-catenin信号传导途径(Wnt /β-catenin)在骨的形成和再生中也具有重要作用。Wnt /β-catenin的激活通过Wnt与低密度脂蛋白受体相关蛋白5和6共受体以及7跨膜结构域跨越的受体的结合来实现[8]。稳定的β-catenin在胞质溶胶中聚集并易位至细胞核。转录共激活因子随后与T细胞因子/淋巴增强子结合因子(TCF / LEF)相互作用。TCF / LEF是转录因子,可以介导Wnt对基因转录的影响,从而上调成骨细胞增殖[9]。Wnt /β-catenin途径通过刺激成骨细胞的增殖和分化而在骨组织再生中起重要作用。氯化锂可以抑制GSK-3β的活性,GSK-3β被认为是Wnt /β-catenin的关键调节因子[8]。通过小鼠锂处理激活Wnt /β-catenin途径中β-catenin与骨量增加和骨折愈合改善相关[10]。本研究中使用锂干预老年大鼠骨折,发现骨折愈合显著加速,这表明氯化锂在骨质疏松骨折治疗的有益作用。
骨折愈合过程非常复杂,主要分为四个紧密连接的阶段,这些阶段是作为应对骨折出现后而开始的。骨的形成和再吸收之间的平衡在骨折修复过程中起重要作用。PINP和CTX血清水平表明老年骨质疏松大鼠骨形成相对不足。本研究采用开放式制作骨折模型,由于骨折模型中的软组织剥离,使骨膜受到严重损伤,并且软骨内骨化在股骨骨折愈合中起着更重要的作用。由血肿形成的半刚性纤维软骨骨痂组织(软愈伤组织)在骨折愈合的早期阶段提供初始稳定性。治疗组术后4周时观察到最大体积的软愈伤组织和一定量的编织骨,同时生物力学也有一定的改善。骨折愈合的最后阶段主要是受破骨细胞活性影响的编织骨的重塑过程。根据骨折修复发生的位置,一些初级矿化软骨痂组织逐渐改变并重塑为板层骨或海绵状骨。在对照组中,组织学显示一部分编织骨在4周时已经形成。然而,治疗组中的愈伤组织可见大量小片层和更多编织骨组成。通常,在正常骨折大鼠中,纤维软骨/软骨的矿化在4周时几乎完成[11]。本研究中采用老年骨质疏松大鼠模型,骨吸收增强和骨形成能力不足,纤维软骨/软骨的重塑过程延迟[12-14]。Micro-CT分析和生物力学结果进一步证实了这点。
当然,本研究也有其局限性。首先,本研究只观察了4周时的骨折愈合情况,即骨折早期愈合的影响,关于8周以及12周时骨折愈合情况尚不清楚;其次,本研究没有进一步观察骨折愈合过程中Wnt /β-catenin信号通路变化,因此促进骨折愈合的具体机制不明了,是否是通过Wnt /β-catenin信号通路来实现的,尚不得而知,虽然理论上可能通过此通路来完成;最后,本研究使用的模型是老年大鼠,是否适合绝经后骨质疏松状态还需进一步研究。
总之,本次研究表明氯化锂对骨质疏松性骨折愈合在骨微结构、力学性质和组织学方面存在短期影响。

