超快速液相色谱-串联质谱法测定生鲜蔬菜中22种农药残留
□ 陈 婷 彭 涛 吴福祥 张 文 闫 君 杨志敏 张 婕 兰州市食品药品检验所
目前世界上生产的农药制剂有千余种,因农药施用不规范等问题,农药残留污染正严重威胁着人们的食品安全,并成为主要的蔬菜质量安全问题之一[1—3]。因此,各国也都在蔬菜农药残留控制与管理方面做了大量工作,制定了严格的限量标准。近10年来,尽管我国蔬菜农药残留检验检测合格率逐年上升,污染值有所下降,但仍然存在着不少制约因素和风险隐患[4]。因此,建立一种能够同时快速监测蔬菜中多种农药残留的检测方法具有非常重要的理论和实践意义。
近年来,随着农药残留检测项目的日益增多以及限量要求的不断严格,液相色谱—串联质谱(LC—MS/MS)技术由于具有灵敏度高、方法精确等特点在多组分农残测定中得到广泛应用[5—9],为当前多组分农药残留分析提供了新型技术。本文参考EN 15662—2008欧洲标准中QuEChERS提取法及 GB/T 20769—2008 国家标准[10—11],采用LC—MS/MS分析检测技术,以多种性质差异较大的农药残留作为研究对象,其中大部分不适宜用气相或气相色谱—质谱方法分析,但在蔬菜生产中使用率和检出率都较高,建立了蔬菜中22种农药残留的快速筛查分析检测方法,为蔬菜中多种农药快速检测提供准确、可靠的分析手段。
1 实验部分
1.1 仪器与试剂
Shimadzu LC—20A 超快速液相色谱仪(UFLC,日本岛津公司);AB API 3200三重四极杆质谱仪(美国AB公司);旋涡混合器(上海琪特分析仪器有限公司);KS501摇床(德国IKA公司);乙腈、丙酮、甲醇与二氯甲烷(色谱纯,美国Fisher公司);提取剂包(4.0 g无水硫酸镁,1.0 g氯化钠,1.0 g柠檬酸钠,0.50 g柠檬酸二钠均为分析纯,国药集团化学试剂有限公司);试验用水(美国Millipore公司);农药标准品购自国家标准物质中心,纯度为97%~99.9%。
1.2 标准溶液的配制
准确称取一定量的各农药标准品至10 mL容量瓶中,选用甲醇或丙酮进行溶解并定容至刻度,配成标准品储备液,将上述标准品储备液根据试验需要,分别用甲醇稀释成适当浓度的混合标准工作溶液,避光,0~4 ℃下保存。
1.3 样品处理
取蔬菜样品搅碎作为试样,准确称取10 g试样,精确至0.01 g,置于50 mL离心管中,加入10.0 mL乙腈、提取剂包6.5 g,1颗陶瓷均质子,盖上离心管盖,剧烈震荡10 min后以3 900 r/min离心5 min,取上层乙腈提取液 500 μL,加入甲醇 250 μL,涡旋30 s,加入超纯水250 μL,涡旋30 s,混匀,过0.22 μm有机微孔滤膜,滤液待LC—MS/MS检测。
1.4 色谱条件
色谱柱:CAPCELL PAK C18(50 mm×2.0 mm,2.5 μm);流速:0.3 mL/min;柱 温:40 ℃; 进 样 体 积:5 μL;流 速:0.3 mL/min; 流 动 相: 甲醇(A)—0.1% 甲 酸 水(B),梯度 洗脱:0~ 0.25 min,90% A;0.25~11.0 min,90% ~ 5%A;11.0~12.5 min,5%~90%A。
1.5 质谱条件
离子源:ESI电离源,离子源温度500 ℃;正离子模式监测;监测模式:MRM模式;喷雾电压:5 000 V;气帘气压力1.4×105Pa;雾化气压力70.0 psi;辅助雾化气压力55.0 psi,以上3种气体均为氮气。
2 结果与讨论
2.1 提取溶剂的选择
本试验分别采用二氯甲烷、丙酮、乙腈作为提取溶剂进行提取,结果表明,采用二氯甲烷作提取溶剂时氨基甲酸酯类农药提取率偏低,均低于60%;采用丙酮作为提取溶剂时,蝇毒磷和甲胺磷提取率偏低,分别为49%、54%,不能满足同时提取22种农药的要求,而用乙腈提取时,提取率均达到要求。因此,为达到同时提取多种农药残留的要求,本试验首选乙腈作为提取溶剂。考虑到生鲜蔬菜基质的特点,使用适当酸化的提取溶剂可将其组织酸化,促进农药的溶出,进而提高提取效率。本试验比对了乙腈和含0.1%乙酸的乙腈溶液的提取效果,结果发现含0.1%乙酸的乙腈溶液作为提取溶剂时22种农药的提取率均高且稳定,因此本试验选用含0.1%乙酸的乙腈溶液作为提取溶剂。
2.2 色谱及质谱条件的优化
确定了以甲醇—0.1%甲酸水溶液作为流动相后,分别优化离子源温度、雾化气、气帘气、辅助气等参数。优化后的监测离子、碰撞电压(CE)、去簇电压(DP)、碰撞室入口电压(EP)、碰撞室出口电压(CXP)等参数见表1。然后在最优条件下检测添加了0.05 mg/kg的22种农药混合标准溶液的花椰菜得出,22种农药在13 min内均出峰,且分离度与峰形较好(总离子流色谱图见图1)。

图1 花椰菜空白基质中添加0.05 mg/kg的22种农药混合标准溶液时的总离子流色谱图
2.3 基质效应
本试验通过比较花椰菜、芹菜、辣椒空白基质混合标准溶液与甲醇混合标准溶液的斜率,评价基质效应,计算公式:基质效应(ME)=基质匹配校准曲线斜率/纯溶剂标准曲线斜率×100%。当ME(%)在±0~20%范围内对结果的影响可忽略不计;ME(%)在±20%~50%范围内表示有基质效应;ME(%)>50%或<—50%,则样品的基质效应对结果的影响不可忽略。试验发现,不同农药在不同基质中的ME不同,绝大多数表现出抑制效应,因此,本试验采用基质配制标准曲线进行校正。
2.4 方法学验证
2.4.1 方法的线性范围、标准曲线与检出限
将22种农药的混合标准液用花椰菜空白基质提取液配成0.01~200 μg/L的系列混合标准溶液,在优化测定条件下进行LC—MS/MS测定,22种农药基质标样的响应值与质量浓度在一定浓度的线性范围内均呈良好的线性关系,相关系数均高于0.99。以3倍信噪比(S/N)确定各农药的检出限(LOD),得出22种农药的检出限范围为0.4~1.2 μg/kg,以10倍信噪比(S/N) 确定各农药的方法定量限(LOQ),范围为 1.2~ 4.0 μg/kg,结果见表2。
2.4.2 方法的回收率和精密度
采用花椰菜空白样品,以各农药定量限、5倍定量限和10倍定量限分别作为添加水平,进行回收率和精密度试验,每个添加水平重复5次,计算各农药的平均回收率和相对标准偏差,结果见表2,在各添加水平范围内的平均回收率范围为79.1%~117.6%,RSD均 小 于10%,符合国家标准农药残留分析测试要求。
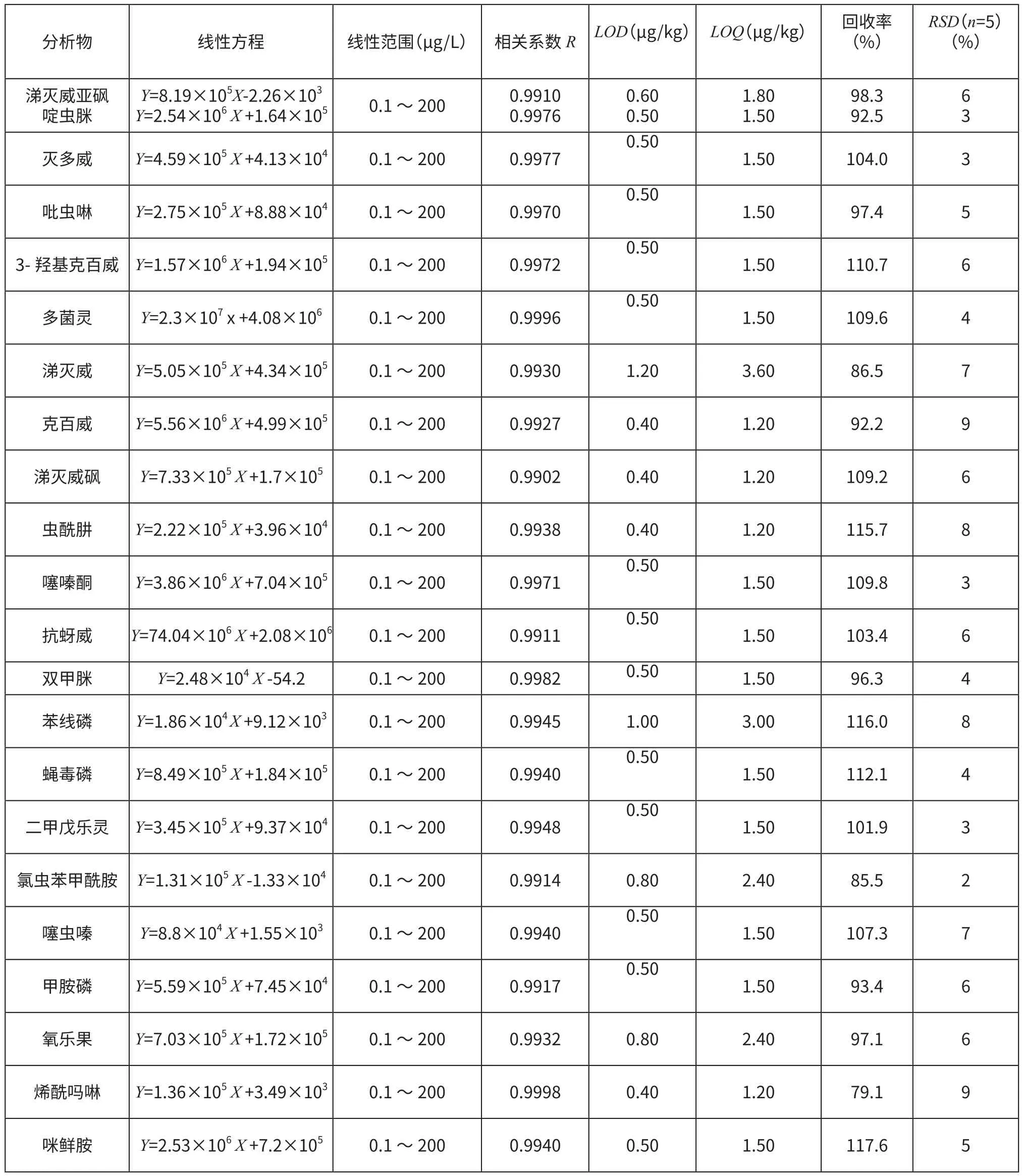
表2 22种农药的方法学验证实验结果
2.5 实际样品测定
采用本方法对市售的菠菜、白菜、番茄、生姜等7类蔬菜125个样品进行快速检测,其中检测出多菌灵等农药残留。对检出的蔬菜 农 药 采 用GB/T20769—2008方法进行确证,结果表明二者数据相近,该方法准确性较高(结果见表 3)。

表3 蔬菜样品快速检测结果与GB/T 20769-2008方法检测结果的比较
3 结论
本文通过超快速液相色谱仪(UFLC)与三重串联四极杆质谱的联用,建立了生鲜蔬菜中22种农药残留的LC—MS/MS快速检测方法,可同时实现蔬菜中22种残留农药的定性与定量分析。该方法具有良好的检测灵敏度和重复性,且省时省力,适用于蔬菜中多农药残留的快速、准确检测分析。

