微流道精密磨削技术及自驱动检测芯片实验研究
谢 晋,郭奥钿,卢 阔,罗敏健,申洪杰
(华南理工大学 机械与汽车工程学院,广东 广州 510640;广州迪澳生物科技有限公司,广东 广州 510663)
1 引 言
微流控芯片技术正在应用于快速生物病毒检测,促进新兴科技及产业发展[1]。通常,芯片材料选用陶瓷、硅质材料、高聚物材料等,但加工机理和工艺都不同[2]。例如,光固化3D工艺制备快速检测血型的微流控芯片,检测时间约为3 min[3],但其微流道尺度为毫米级。虽然YAG(Yttrium Aluminium Garnet)雷射在硅芯片上可制备出深宽均为150 μm的微流道,但表面不平整[4]。超快激光可在有机玻璃(Polymethyl Methacrylate,PMMA)上制备宽度20~90 μm的流道[5],但其热熔去除会使微流道结构表面粗糙。这些物理加工方法会导致表面粗糙和结构不规则,使得微流体流动困难,产业化过程中需要离心机等外加驱动。
在芯片加工和封装方面,软光刻法和紫外光键合可制作PMDS(Polydimethy lsiloxane)被动微混合器,其混合系数可达到60%[6-7]。而且,微流道阳模3D打印与PDMS倒模相结合,在非键合封装条件下制备PDMS微流控芯片[8-9]。但是,芯片的微流道结构精度难被控制。
在微液体流动机理方面,研究主要关注液滴生成与运动、连续介质流动等流体动力学[10],但尚未详细涉及微流道拓扑结构。为了驱动微液滴,通过微阵列电极的电势梯度改变其接触角[11],也有通过热毛细管的热梯度产生表面能梯度[12]。微流控芯片已经被用于登革热病毒检测[13]。但是,这些微流动的实际应用需要电场、加热等外围装置。
在微流控芯片设计上,主要考虑Y型和S型混合流道,通过蠕动泵的负压驱动芯片,在线检测发酵的葡萄糖[14]。而且,设计浓度梯度的微流控芯片,快速筛选抗白念珠菌药物[15]。设计聚苯乙烯声学分离芯片,从含菌血液中分离40%~60%的细菌[16]。此外,圆台形微孔阵列芯片可以在1 cm2内配对约6 000个异型细胞对[17]。但是,尚未有自驱动的微流控芯片用于生物病毒检测。
因此,依据微流道结构的表面张力等,设计自驱动的微流控芯片,实现了无需外加离心力就可以快速检测出病原体DNA。采用超硬金刚石微磨削技术,在石英玻璃表面加工出高精度的微V槽流道。着重研究微V槽微流道的表面粗糙度、尖端角度、梯度等拓扑结构参数对自驱动性能的影响。最后,研制出用于布鲁氏菌检测的自驱动微流控芯片。

图1 金刚石砂轮微尖端修整工艺Fig.1 Micro-tip truing process for diamond grinding wheel
2 微流道精密磨削工艺及技术
精密微磨削取决于工具尖端在位修整。基于多轴数控技术,开发超硬金刚石砂轮微尖端的精密修整工艺[18],可不依赖修整工具形状,如图1所示。进而开发物理机械复合去除的脉冲放电修整技术,如图1(b)所示,与机械修整技术相比提高效率约59倍[19]。
图2为砂轮微尖端数控修整的误差补偿前后轮廓图。金刚石砂轮尖端角度α可修整到60°±2.0°和尖端半径r为58.84 μm。开发误差补偿的数控修整工艺,其角度偏差达到±0.6°,尖端半径r达到25.0 μm。进而,调整工艺,α偏差可为±0.5°,r约为5 μm。

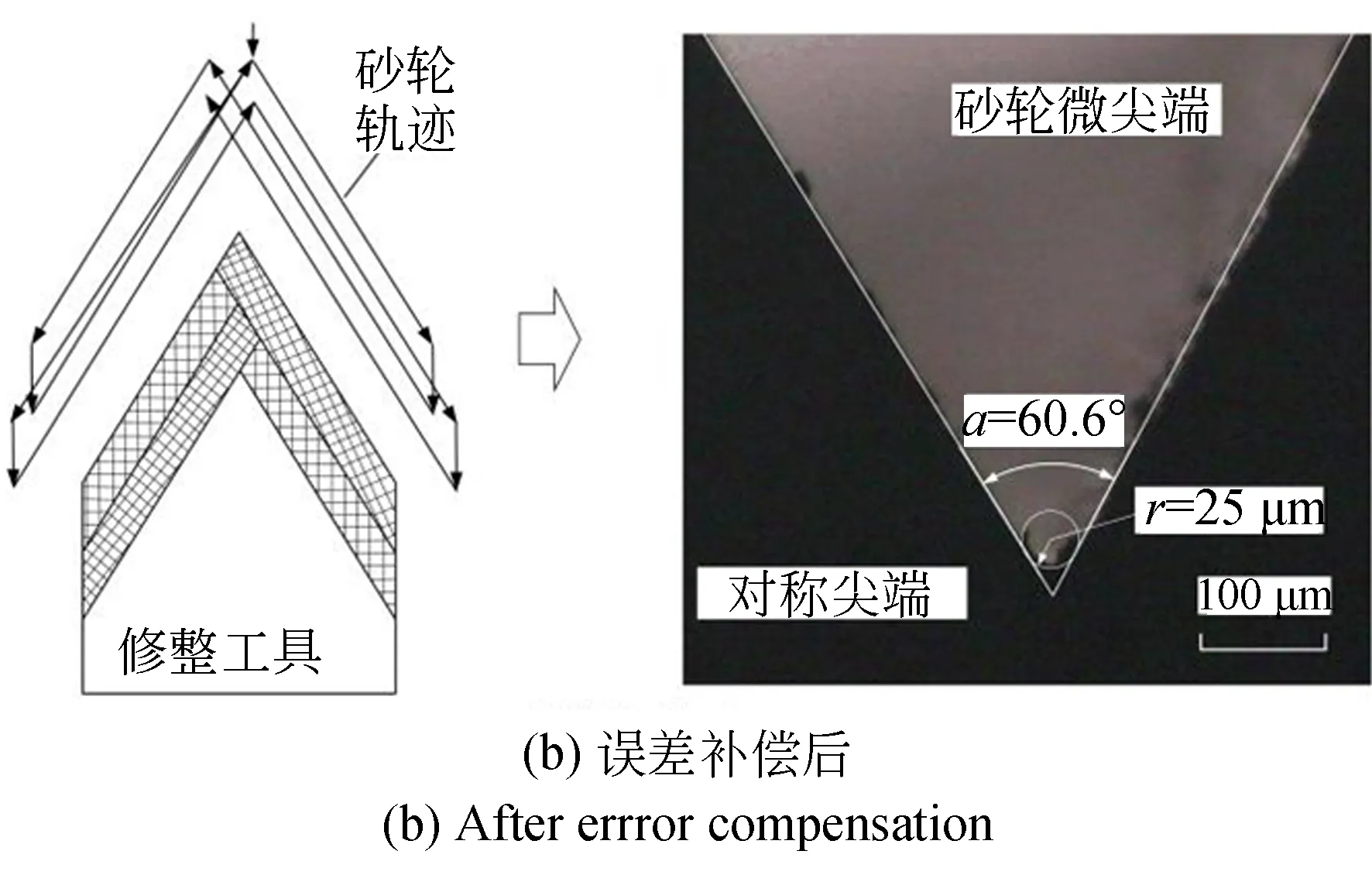
图2 微尖端修整的误差补偿Fig.2 Error compensation of wheel micro-tip truing
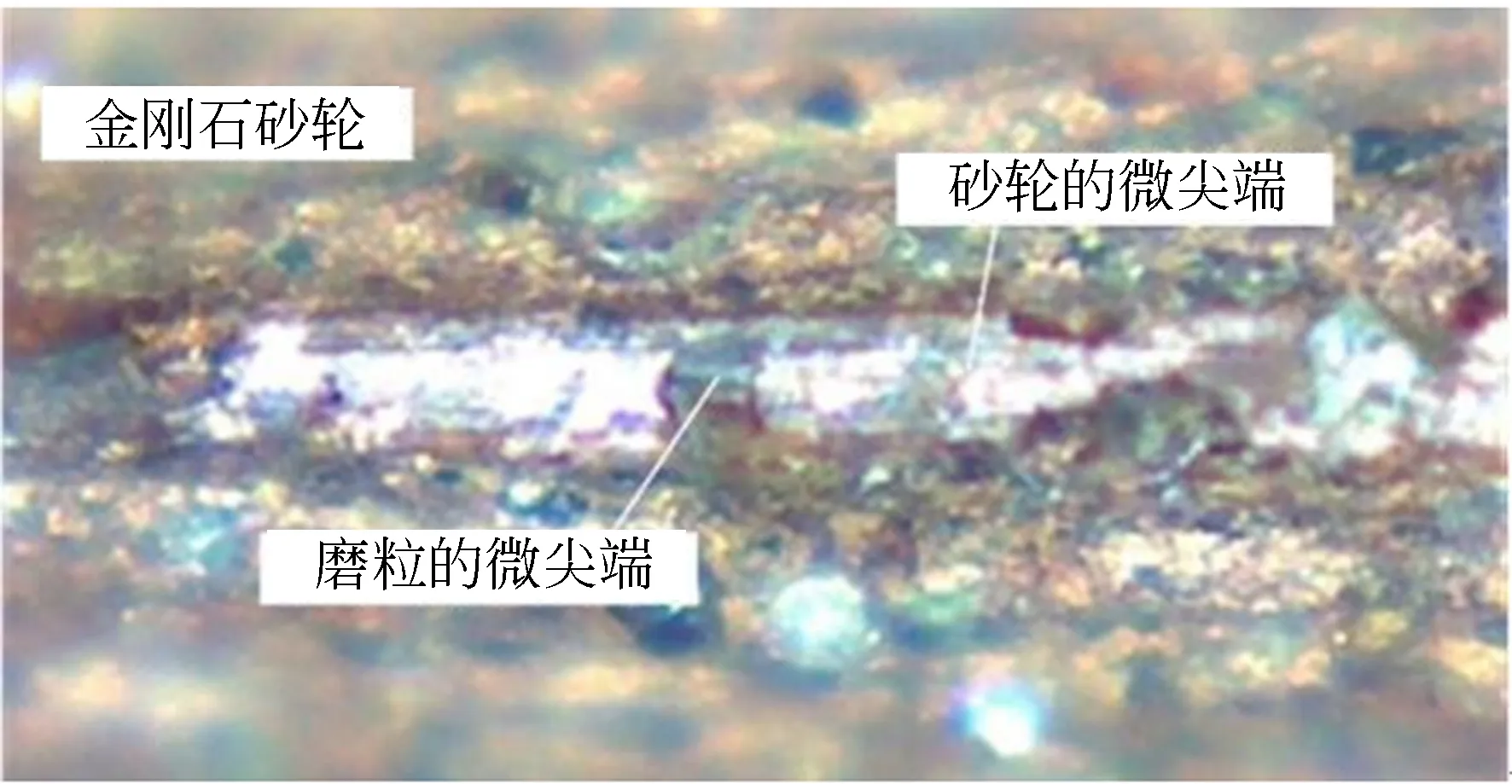
图3 砂轮微尖端的金刚石磨粒形貌Fig.3 Diamond grain shapes on the trued wheel micro-tips
图3为砂轮微尖端上磨粒形貌。可以发现:修整后的砂轮微尖端上分布的金刚石磨粒切削刃也能被修整成同一角度。因此,研发的砂轮微尖端精密修整工艺也可以使随机分布的微磨粒出刃高度和方向与砂轮微尖端的切削方向保持一致。
图4为石英表面的微V槽阵列形貌图。在vf=500 mm/min,N=2 400 round/m和a=20 μm的磨削条件下,采用砂轮微尖端,控制多个磨粒塑性域切削深度[19],在石英玻璃表面进行机械复制的微磨削。可以发现,微V槽流道边沿无破碎,表面光滑,角度α偏差与砂轮微尖端偏差基本一致,小于1°,尖端半径r约为15 μm。因此,相比激光等物理加工,金刚石微磨削技术可以加工出高精度V尖角的微V槽流道。通过数控技术可以加工出有梯度的微V槽流道。

图4 石英玻璃表面微V槽磨削加工Fig.4 Micro-V-groove grinding on quartz glass surface
3 微流控芯片的设计
图5为微V槽流道的液体自驱动几何模型。其拓扑结构特征化参数为:微V槽的角度α、尖端半径r和梯度η。当微流体进入微流道后,底部尖角及纳米裂纹流道对微流体产生吸附力,形成微流体前端凹面[20]。它可以破坏最小表面的表面能状态,形成前端表面张力,导致微流体自动填充凹面,减少前端表面积和降低表面能,诱导和驱动微液体流动。
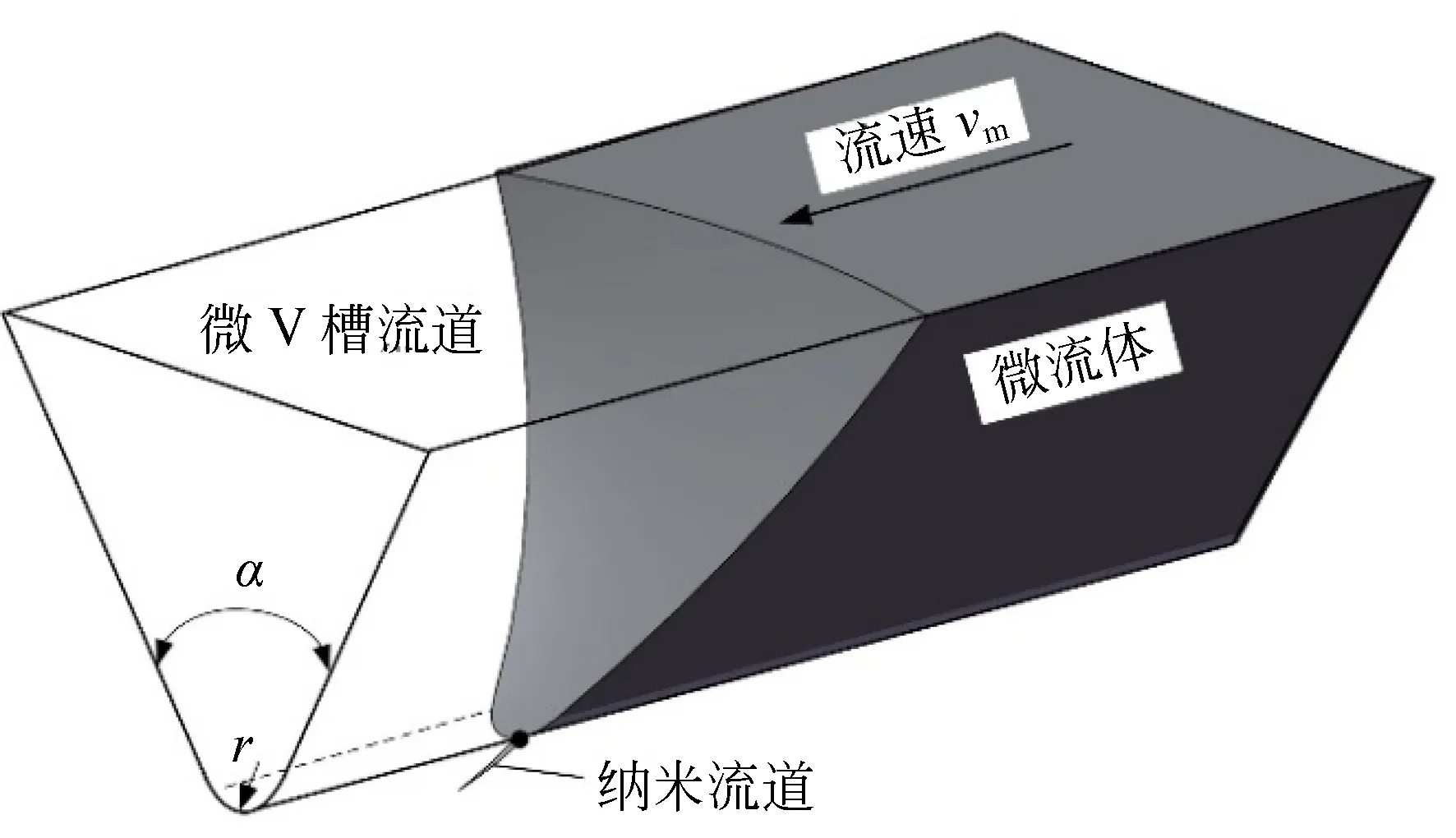
图5 自驱动流道的几何拓扑模型Fig.5 Geometric topography of self-driven channel
图6为微流控芯片设计图。芯片尺寸为60×60×3 mm,有进样口、样品缓冲室、反应池(φ5 mm)和气压控制池(φ4 mm)等,通过微流道相互连接。在设计中,采用直线梯度的微V槽流道的流道(图6(b)),防止微液体回流,取代矩形的环形流道(图6(a))。
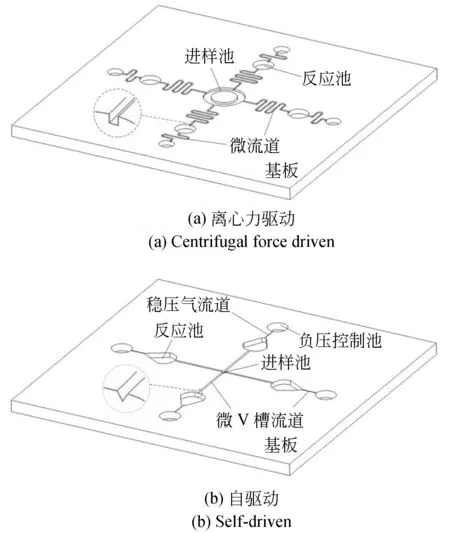
图6 病原体检测的微流控芯片设计Fig.6 Design of microfluidic chip for pathogen detection
结合环介导等温扩增技术(Loop-Mediated Isothermal Amplitication,LAMP)技术,开发病原体检测试剂盒和可见光波段的荧光反应染料,检测病原体核酸。在芯片上实现检测液预埋、检测样本进样和混合、等温核酸扩增和光学测试。
4 微V槽流道的自驱动拓扑结构特性
图7为微V槽流道表面粗糙度不同的流速测量。将微流控芯片固定在检测平台上,采用视频逐帧处理记录微流体流动过程,每条微流道重复进行3次流速测量。实验发现,当微V槽流道角度α为60°时,表面粗糙度Ra为104.0 nm的流速vm为5.9 mm/s,而Ra为31.2 nm的流速vm为18.7 mm/s,提高流速3倍以上。这表明:纳米粗糙表面有利于提高微液体流速。
采用同样方法可以测得,当微V槽流道角度α为120°时,微液体流速vm为16.5 mm/s。其角度α为60°时,流速增加到18.7 mm/s,流速增幅约为13%。进一步实验发现,当微流道梯度η为0.42°时,微液体流速vm为3.8 mm/s,比无梯度的2.5 mm/s流速提高约52%。此外,微流道条数越少,流速越高。这表明,更小微V槽角度,更大梯度和更少流道数有利于微流体自驱动流动。

图7 不同表面粗糙度Ra的微液体流速测量Fig.7 Flowing velocity measurement with different surface roughness Ra
图8为两种不同液体的混合面积图及变化曲线。该实验结果显示,在面积S为12.6 mm2和20.6 mm2的流池里,微液体的混合速率分别为18.2 mm2/s和36.2 mm2/s。这表明,微液体从微V槽中快速流出,可与流池里的液体快速混合。而且,自驱动与负压相结合可以将流速提高约1倍,微液体从进样室流到反应室只需0.14 s。
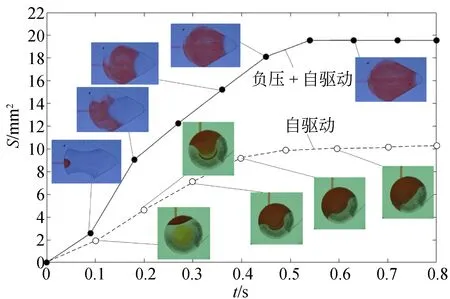
图8 流池的微流体混合面积S随时间变化图Fig.8 Microfluid mixing area S versus time in reaction cells
图9为有无纳米裂纹流道的微液体流速vm。检测数据是来源于前期研究实验[20]。结果显示:有纳米流道的位置可以将流速vm提高30%~71%,有利于微液体在驱动。这说明,微V槽尖端分布纳米流道可驱动微液体流动。为了验证其纳米裂纹流道的存在,进行金刚石切削刃(四面顶锥)的石英玻璃表面切入压印实验,压力1.961 N,切削刃端的裂纹扩展如图10所示。
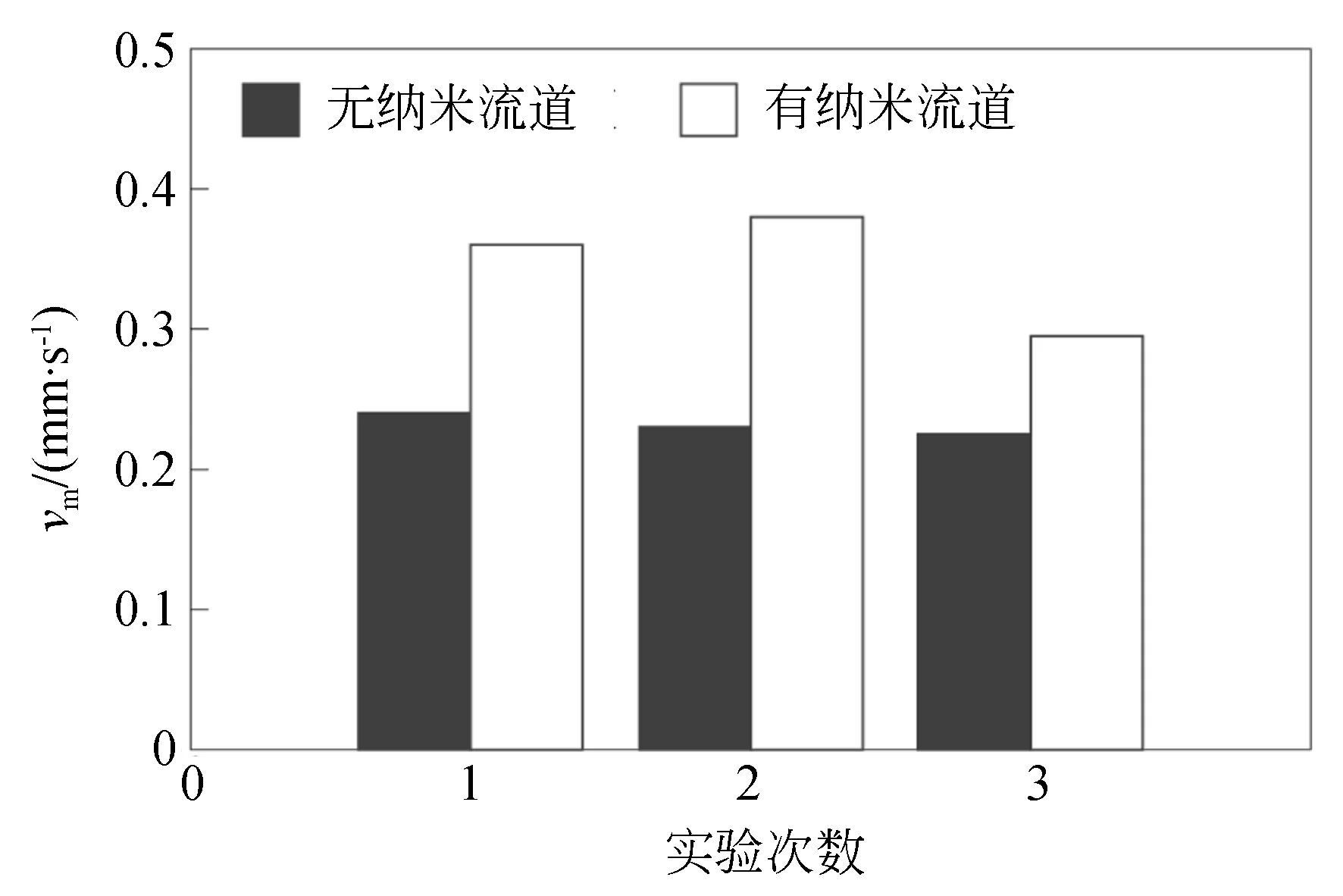
图9 有无纳米流道的微液体流速vmFig.9 Flowing velocity vm with or without nano-channels

图10 金刚石切痕端的纳米流道形貌Fig.10 Morphology of nano-channels at the diamond cut end
从图10中可以看到,其前端因裂纹可以产生纳米流道,其宽度小于160 nm,深度约50~100 nm,深宽比为0.3~0.7。这可以说明:在微V槽流道的磨削中,磨粒切削刃尖端的机械压入会在微V槽尖角处滋生裂纹,进而产生纳米流道,诱导微液体自驱动运动。
5 病原体检测实验
布鲁氏菌病(Brucella. spp),是一种由布鲁氏菌引起的,导致繁殖能力降低的人兽共患病。环介导等温核酸扩增技术是链置换型DNA聚合酶的分子生物学方法,用于检测布鲁氏菌。先开发病原体核酸检测用的DNA提取试剂盒(T003S/L)和布鲁氏菌核酸检测试剂盒,对应的检测靶标基因为布鲁氏菌Omp25基因,然后开发检测双链DNA的荧光染料SYBR GREEN,染料底色为橘黄色,发生扩增反应为绿色,则检测样品中含有布鲁氏菌。
实验步骤:
(1)提取病原体核酸;
(2)将芯片超声波酒精清洁5 min,再蒸干酒精;
(3)配置样品待检液:12.5 μL缓冲液,0.5 μL无菌水,2 μL待检样品,共15 μL;
(4)配置预加载检测试剂:8 μL无菌水,1 μL Bst酶,1 μL引物,共10 μL;
(5)将10 μL预加载检测试剂加入反应池,然后PET薄膜封装;
(6)在真空桶中抽走芯片空气,形成负压;
(7)在样品缓冲室中加入样品待测液,然后刺破贴膜启动负压引流,将样品引入;
(8)LAMP扩增检测:刺破气压控制室,放置于恒温金属浴仪器中在63 ℃下恒温保持45 min;
(9)取出芯片,在紫外灯下观察。
6 检测结果与分析
在实验中,将空肠弯曲杆菌、布鲁氏菌和小肠结肠炎耶尔森氏菌3种病原体的靶标基因对应的检测试剂和阴性对照检测试剂分别加入到芯片的反应池,如图11所示(彩图见期刊电子版)。结果显示,空肠弯曲杆菌检测试剂、小肠结肠炎耶尔森氏菌检测试剂以及阴性对照试剂与布鲁氏菌的Omp25基因不发生扩增反应,呈无色的阴性。但是,布鲁氏菌检测试剂与布鲁氏菌的Omp25基因发生扩增反应,呈绿色的阳性。而且,特异性良好,未出现扩增产物扩散和试剂污染。
图12为LAMP病原体检测灵敏度的实验结果(彩图见期刊电子版)。在实验中,将含有布鲁氏菌基因组DNA的待测样本引入进行核酸扩增反应。将待测样本以10倍梯度进行浓度稀释,重复实验,发现不同浓度的检测样本均出现良好的结果。此外,布鲁氏菌基因组DNA样本与布鲁氏菌检测试剂发生扩增反应,上孔、左孔和下孔均显绿色,而右孔显橘黄色,这说明样本与对照检测试剂不反应。由此可知,布鲁氏菌DNA的最低检测浓度可以达到100 ag/μL及以下。

图11 特异性检测实验Fig.11 Specific detection experiment

图12 梯度浓度布鲁氏菌基因组DNA检测Fig.12 Gradient concentration detection of Brucella genomic DNA
7 结 论
开发金刚石砂轮微尖端的精密修整工艺,将砂轮及其尖端上磨粒修整成同一角度60°,其角度端偏差达到±0.5°。在塑性域削加工的机械复制下,可将石英玻璃芯片表面磨削出高精度的微V槽流道,其表面粗糙度达到30 nm、尖端半径达到15 μm。
石英玻璃微V槽磨削需要工艺时间,但石英玻璃芯片可重复使用。该技术可加工玻璃和PMMA芯片模压成型的模芯,用于微流控芯片的快速生产。
在微流控芯片中,微V槽角度和表面粗糙度越小以及梯度越大,流速越快,且深宽比为0.3~0.7的纳米流道也可诱导微液体流动。此外,通过微V槽流道的液体也可以经过微流池90°边角的微V槽快速流入,与其他液体混合。微液体从加载室流到反应室只需0.14 s。
根据微液体自驱动的微流道拓扑结构尺度效应,设计自驱动的微流控芯片。在检测实验中,布鲁氏菌检测试剂与布鲁氏菌的Omp25基因发生扩增反应,结果呈绿色的阳性,而且,特异性良好,未出现扩增产物扩散和检测试剂污染等干扰问题。布鲁氏菌的病原体核酸检测灵敏度可以小于100 ag/μL。

