银纳米粒子的抗菌活性研究进展
刘 静,薛 岚,郭晓媛,王春章,李明雪
(河南大学 化学化工学院, 河南 开封 475004)
广谱抗生素的长期大量使用使许多细菌多药耐药病原体增加,导致最常见的细菌性疾病的发病率和死亡率明显上升[1].对于近来由于抗生素使用不当而产生的耐药基因,尝试减少对相应抗生素的使用量成为当务之急.细菌多药耐药性的产生包括将抗生素从细胞中去除、修改抗生素靶位、改变酶活性使抗生素失活、改变代谢途径等多种不同机制[2].细菌对于新开发的抗生素的抗药性的出现,要求当前需要对抗菌化合物的创新、监测抗生素的消耗、产生耐药性的机制等做出研究.同时有必要优化抗生素的药代动力学和药效学,以改善治疗效果同时降低毒性和产生耐药性的风险.银纳米粒子(Ag NPs)由于其高的比表面积、显著的物理和化学性质以及生物活性和安全性被广泛用作细菌的杀菌剂[3-4].它们不仅对革兰氏阳性菌、革兰氏阴性菌、病毒和真菌有效,而且与许多其他抗菌物质相比,诱导微生物产生耐药性的倾向较低,这使得其成为解决细菌对抗生素产生耐药性问题的新途径[5].研究表明,将Ag NPs与抗生素有效结合制备非传统的抗菌剂,对于克服几种病原微生物对大多数常用抗生素产生的耐药性非常重要.二者的有效结合将产生协同抗菌作用,在抗生素治疗效果不佳时,Ag NPs可作为高效的传输系统,使抗生素和Ag NPs共同作用表现出良好的抗菌效果[6].Ag NPs作为杀菌剂已经有几百年的历史,但其详细的作用机制仍然未知,是当下一项需要深入研究的重要课题.美国国立卫生研究院(NIH)报告:全世界约80%的细菌感染是以形成生物膜的形式,其中大多数细菌产生生物膜后使可用的抗生素和抗菌产品/消毒剂的药效降低或无效.Ag NPs具有的抗生物膜形成的活性似乎为解决此问题提供了新思路[7].
1 银纳米颗粒的抗菌活性
1.1 纳米银的抗菌活性
众所周知,纳米科学和纳米工程的快速进步为纳米医学开辟了新领域.Ag NPs因其显著的抗菌活性在科学领域引起了广泛关注.由于对哺乳动物的低细胞毒性和强大的生物活性,它被用作革兰氏阳性细菌、革兰氏阴性细菌、真菌和病毒的有效抗菌剂[5].近年来,越来越多研究报道Ag NPs对于生产一类新型的抗菌剂具有广阔的应用前景,将Ag NPs与传统抗生素联合使用时会表现出比单独使用更优秀的医学效果,因此二者的结合被认为是抗生素的可行替代品,在解决细菌多药耐药性的问题上有着广阔的发展空间[8].目前已知Ag NPs的高效抗菌作用,但尚未充分阐明其作用机理.实际上,杀菌效果似乎与纳米颗粒与微生物相互作用的多方面因素有关.Ag NPs能够与各种细菌的细胞表面发生相互作用并能影响生物膜的生长和成熟.大量研究表明,Ag NPs可以锚定在细菌的细胞壁,破坏细胞膜,导致膜结构发生改变,使细菌膜的渗透性增加,内容物泄露从而使细菌死亡.另外,纳米颗粒的大小[9]、浓度[8]均可影响Ag NPs的杀菌作用效果.
1.2 影响Ag NPs抗菌活性的因素
1.2.1 Ag NPs的尺寸和电位
在多项研究中表明,Ag NPs的抗菌活性强烈依赖于其颗粒的大小[9-10].随着Ag NPs的尺寸从块状到纳米级的减小,其抗菌性能随之增强.这可能与金属银以纳米粒子的形式发挥抗菌作用时增大的比表面积和增多的表面原子数目有关.观察到当纳米尺寸从83 nm减小到59 nm时对临床重要的革兰氏阳性菌和革兰氏阴性菌的抗菌活性提高了近38%~50%[11].当Ag NPs的尺寸为(10±5) nm左右时,对需钠弧菌的MIC(最低抑菌浓度)和MBC(最低杀菌浓度)分别为1.0 mg/L和l.1 mg/L[12].总之,当Ag NPs在更小粒径的情况下,具有更强的杀菌性.另外,Ag NPs在正电位的情况下,与膜的相互作用效果以及使细胞死亡的损伤更加明显.原因是当具有正ζ电位的纳米粒子遇到大多数表面带有负电荷的微生物细胞膜时,二者之间会产生静电力[13],从而促进两个实体之间的紧密吸引和黏附作用,使Ag NPs尽可能多地穿透细菌细胞膜,使细菌细胞内容物泄露,导致一些基本的细胞功能受到损害,使带正电荷的Ag NPs比带负电荷的Ag NPs具有更强的抗菌活性[14].因此,控制ζ电位与纳米颗粒的尺寸可以更有效地增强纳米粒子的抗菌活性.
1.2.2 Ag NPs的浓度
杀菌效果与Ag NPs浓度之间有着直接的关系.Ag NPs是对抗大肠杆菌、伤寒沙门氏菌、霍乱弧菌和金黄色葡萄球菌的有效抗菌剂[15-17].JAIN等发现:尺寸范围为7~20 nm的球形微粒Ag NPs,即使在非常低的浓度下对革兰氏阳性菌和革兰氏阴性菌也有着很强的抗菌活性[18].Ag NPs的有效抗菌浓度存在最低值和最高值,当单位面积细胞壁上粘附的Ag NPs数量达到最低要求时,可以抑制或者有效降低病原体的活动,若低于最小抗菌浓度则无法达到良好的抑菌效果;当单位面积细胞壁吸附的Ag NPs达到一定浓度时,抗菌效果最强.因此在使用Ag NPs抗菌剂时,需要控制Ag NPs在一个适宜的浓度值,从而达到最佳的抗菌效果.
1.2.3 Ag NPs的形状
越来越多的科学证据表明,Ag NPs的活性不仅取决于其粒径的大小和浓度,还取决于形状[10].在这方面,似乎三角形纳米颗粒对大肠杆菌作用效果更加显著,可在低浓度下对病原体有效抑制.PAL[19]等研究了球形、棒状和三角形三类不同形状的Ag NPs,评估它们在溶液和琼脂板上对大肠杆菌的抗菌效果.结果证实三种不同形状的Ag NPs都具有一定的抗菌活性,但三角形的纳米颗粒具有最高的抗菌活性,其次是球形和棒状.原因可能是三角形的几何形状会增大纳米粒子的比表面积,有利于Ag NPs与细菌表面的相互作用,增强表面结合的概率从而确保更好的抗菌活性.同时在另外一项研究中,合成了平均尺寸为40 nm的球形、三角形和六角形的Ag NPs,对革兰氏阴性大肠杆菌的抗菌作用进行定性评价.结果表明在采用抑菌圈法和生长曲线法下均证实六角形的Ag NPs抗菌效果最好,杀菌作用甚至强于氨苄西林[20].YOUSAF[21]等最近也对形状与抗菌活性的相关性进行了研究,他们分别由水、乙醇和甲醇萃取物合成平均直径为20.77、18.53和14.27 nm的具有球形、矩形和立方体形状的Ag NPs.实验中所有产物均稳定且已被纯化,结果表明球形的Ag NPs 有更强的抗菌效果.总之,越来越多的文献证明了Ag NPs的形貌可以在很大程度上影响最终的抗菌活性.
2 银纳米粒子的抗菌机制
众所周知,Ag NPs可以破坏多个耐药菌株,具有强大的杀菌潜力.针对Ag NPs的杀菌机制已有广泛的研究,但其确切作用仍未详细阐明.在目前的研究中已有两种机制被广泛认可,即接触杀灭作用和离子介导的杀灭作用.
2.1 直接接触微生物的抗菌机制
Ag NPs具有比散装银更出色的理化和生物学特性.据报道,细胞表面不光滑,Ag NPs可以锚定在细菌细胞壁上,并因此而渗入细菌壁.以大肠杆菌为例,其外膜结构主要是由脂多糖(LPS)分子构成,膜的通透性的改变是由LPS分子和膜蛋白的逐渐释放引起的.这种作用将引起细菌膜的物理变化,改变其通透性,使得细菌无法适当的调节质膜的运输,从而导致细胞内容物泄漏和细菌死亡[22].有证据证实了Ag NPs对革兰氏阴性细菌的抗菌作用强于革兰氏阳性细菌[23].这是由于表面有一层较厚的肽聚糖(20~80 nm)的革兰氏阳性细菌对Ag NPs的抗性强于表面是一层较薄的LPS的革兰氏阴性细菌,厚度存在差异可以防止AgNPs的渗入,导致他们对Ag NPs敏感程度不同[9].已经证明细菌的细胞膜由于存在羧基、磷酸基和氨基等基团而具有负电荷.带有正电荷的Ag NPs和带负电荷的微生物细胞膜之间存在静电吸引,从而促进Ag NPs附着在细胞膜上.因此,可以通过改变Ag NPs的表面电荷以获得更强的吸引力来增强抗菌效果[14].硫和磷在细胞膜上大量存在,银对硫或磷的高反应活性是其抗菌性能的关键因素之一[11].例如当Ag NPs渗透到微生物细胞内部时,它能与蛋白质反应即与巯基快速结合,改变蛋白质的三维结构,导致多种酶活性的降低或丧失,从而导致细菌死亡[24].总的来说,纳米粒子与细菌的结合取决于相互作用的有效表面积.越小的纳米粒子与细菌细胞接触的表面积越大,并且与较大的纳米粒子相比可以更容易的渗透细胞壁到达细胞质,杀菌效果就越强[13].附着在细胞膜上的Ag NPs与细胞结构和生物分子(例如蛋白质、RNA、DNA、多肽)之间的相互作用将导致DNA的复制和转录受到破坏、糖代谢的阻断等一系列阻碍细胞分裂和繁殖的过程,最终导致细胞坏死和死亡[25].此外,Ag NPs的另一重要的毒性机制是氧化应激的增加,这与高水平的活性氧(ROS)和自由基(如过氧化氢、超氧阴离子、羟基、次氯酸和单线态氧)等的产生有关[26].这些本是呼吸过程的自然副产物,在正常情况下,细胞可通过还原型谷胱甘肽(GSH)等抗氧化剂使细胞免受氧化应激,将ROS保持在一个较低的水平.然而,纳米颗粒表面可以作为ROS形成的催化表面,破坏系统的消除机制,从而增加活性氧和自由基的浓度[27].另外Ag NPs可以下调超氧化物歧化酶和过氧化氢酶等抗氧化酶的表达,通过系列反应导致ROS含量升高,进而产生凋亡反应、脂质过氧化、GSH耗竭和DNA损伤[28].同时,Ag NPs可能会突破肽聚糖和胞质外膜的屏障,破坏呼吸链脱氢酶,抑制细胞呼吸[29].
2.2 银离子释放介导的抗菌机制
有一些证据表明,Ag NPs溶解后释放的银离子(Ag+)是抗菌活性的主要贡献者.Ag NPs经氧化可以持续释放Ag+进入细菌.NAGY等将Ag NPs嵌入沸石膜进行实验,在两小时内当Ag+浓度为0.05 mg/L时大肠杆菌的生存能力被完全降低.重复使用后,膜的效率下降,随着Ag+的释放量减少,杀菌作用也明显减弱.因此可推测出Ag NPs在抗菌过程中的抗菌活性与Ag+的环境浓度成正比[28].Ag+的抗菌作用与细菌内膜的反应密切相关.例如,Ag+在释放的30 min内进入细胞,与细胞质、蛋白质和核酸结合形成稳定的键,导致物质失活.通过透射电镜图像(图1),可观察到明显的细胞溶解和细胞质渗漏[30].Ag+与酶及结构蛋白和功能蛋白(这些蛋白质参与跨膜ATP的产生并介导跨细胞膜的离子转运[31])尤其是与半胱氨酸的巯基相互作用[32].已证实了微摩尔级的Ag+可以限制呼吸链脱氢酶或阻碍呼吸,以及限制膜对质子和磷酸盐的渗透性[28].
Ag+作为重金属离子可引起微生物细胞氧化应激的增加,这是另一种抗菌机制[32].有一项研究制备不同配体包括柠檬酸、巯基丙酸、巯基乙酸和巯基丙磺酸包覆的大小约10 nm的Ag NPs,并以大肠杆菌为模型研究了其抗菌机理.发现在细胞内Ag NPs释放的Ag+与膜上的呼吸链蛋白相互作用,中断细胞内O2的还原,诱导产生ROS,最终导致细菌死亡[33].
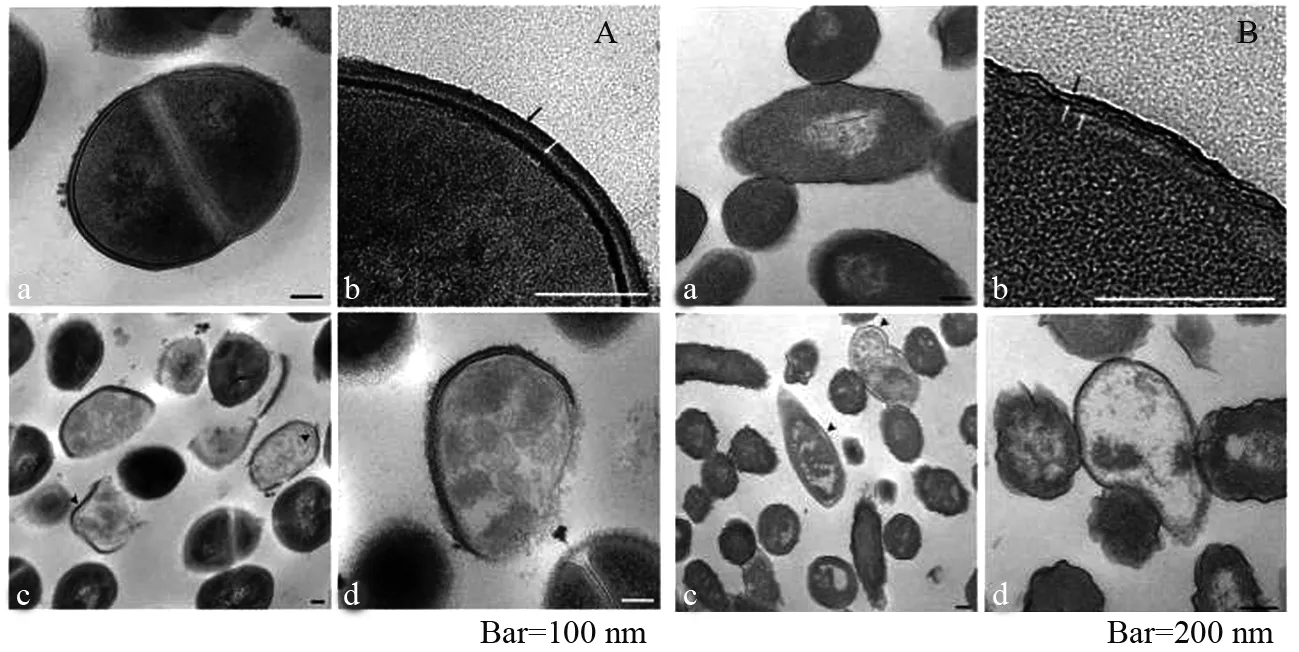
图1 金黄色葡萄球菌和大肠杆菌内部形态(A)和(B)通过TEM观察(a,b)是未经处理的细菌、 (c,d)是在Ag+(0.2 mg/L)处理2 h.黑色和白色箭头分别表示肽聚糖和胞质膜(A),外膜、肽聚糖和胞质膜(B).箭头表示细胞膜与细胞壁分离Fig.1 Internal morphology of S. aureus and E. coli (A) and (B) was observed by TEM (A, B) as untreated bacteria, (c,d) is treated at Ag+ (0.2 mg/L) for 2 h. The black and white arrows represent the peptidoglycan and cytoplasmic membrane (A), and the outer membrane, peptidoglycan and cytoplasmic membrane (B), respectively. The arrow represents the separation of the cell membrane from the cell wall
尽管Ag NPs可以通过上述两种不同的作用方式杀死细菌,但抗菌机制通常被认为是Ag NPs和Ag+产生的协同作用.已有证据通过比较合成的壳聚糖/银纳米和壳聚糖/Ag+的生物复合材料对金黄色葡萄球菌和大肠杆菌的抗菌活性,与相同浓度的银离子复合材料相比与纳米粒子复合后效果更佳.抗菌活性随着Ag NPs和Ag+离子浓度的增加而增加.因此,Ag NPs和Ag+离子(后者存在于Ag NPs表面)的协同作用促进了抗菌活性的增强[33].然而对于二者具体的协同作用机制还需要进行更深入的研究.图2是针对目前所探讨到的模拟的银纳米粒子与细菌的作用机制.
3 Ag NPs抗生物膜活性
3.1 生物膜的形成与致病性
细菌生物膜通常由自形成的胞外聚合物物质(EPR)进行保护,该类聚合物由(菌)表多糖,脱氧核糖核酸以及脂质构成.生物膜对大多数传统抗生素有着极大的限制力(高达1 000倍),它是通过胞外多糖来限制扩散或中和抗菌药物的途径来减少抗生素的渗透.总之,生物膜一旦在游离活细胞形成,就会使抗生素难以与微生物作用,进而影响抗生素的治疗效率.目前,与人类感染相关的生物膜形成的细菌包括革兰氏阳性细菌和革兰氏阴性细菌[33-36].生物膜的形成被认为是细菌从感知环境条件开始的,环境条件的改变触发了表面形成生物膜.这些环境信号因生物而异,包括培养基的营养含量、温度、渗透压、pH、铁和氧气等[37].生物膜形成是一个复杂的过程,可以分为以下阶段:1)可逆附着相,其中细菌非特异性地附着在表面;2)不可逆附着相,涉及细菌细胞与表面之间的相互作用,使用细菌粘附素,如菌毛和脂多糖(LPS);3)由驻留的细菌细胞产生胞外聚合物物质;4)生物膜成熟阶段,即细菌细胞合成和释放信号分子,以感知彼此的存在,从而导致微结构域的形成和生物膜的成熟;5)分散/分离阶段.细菌细胞离开生物膜,恢复到独立的浮游生物生活方式[38].图3模拟了生物膜形成的过程[38].
生物膜的致病性可以归纳为以下特性:微生物在生物膜中高密度地附着在固体表面上,通过分泌EPS在生物或非生物表面形成异质实体,对膜内细菌提供了一个稳定的环境.生物膜中细胞的基因型和表型特征与自由漂浮的细胞不同,这些差异使它们对抗生素有很强的抵抗力.生物膜保护单个细胞免受不利因素的影响,如免疫防御系统、营养限制等等.从生物膜释放的细胞可以迁移到血液中,导致系统性感染,最终使疾病死亡率升高.另外,生物膜的存在还可能对几种工业过程有害,因为它们会导致流体系统的机械堵塞、传热过程的干扰和金属表面的腐蚀.因此,迫切需要开发具有抗菌和抗生物膜形成的持久生物医学材料或装置[39-41].
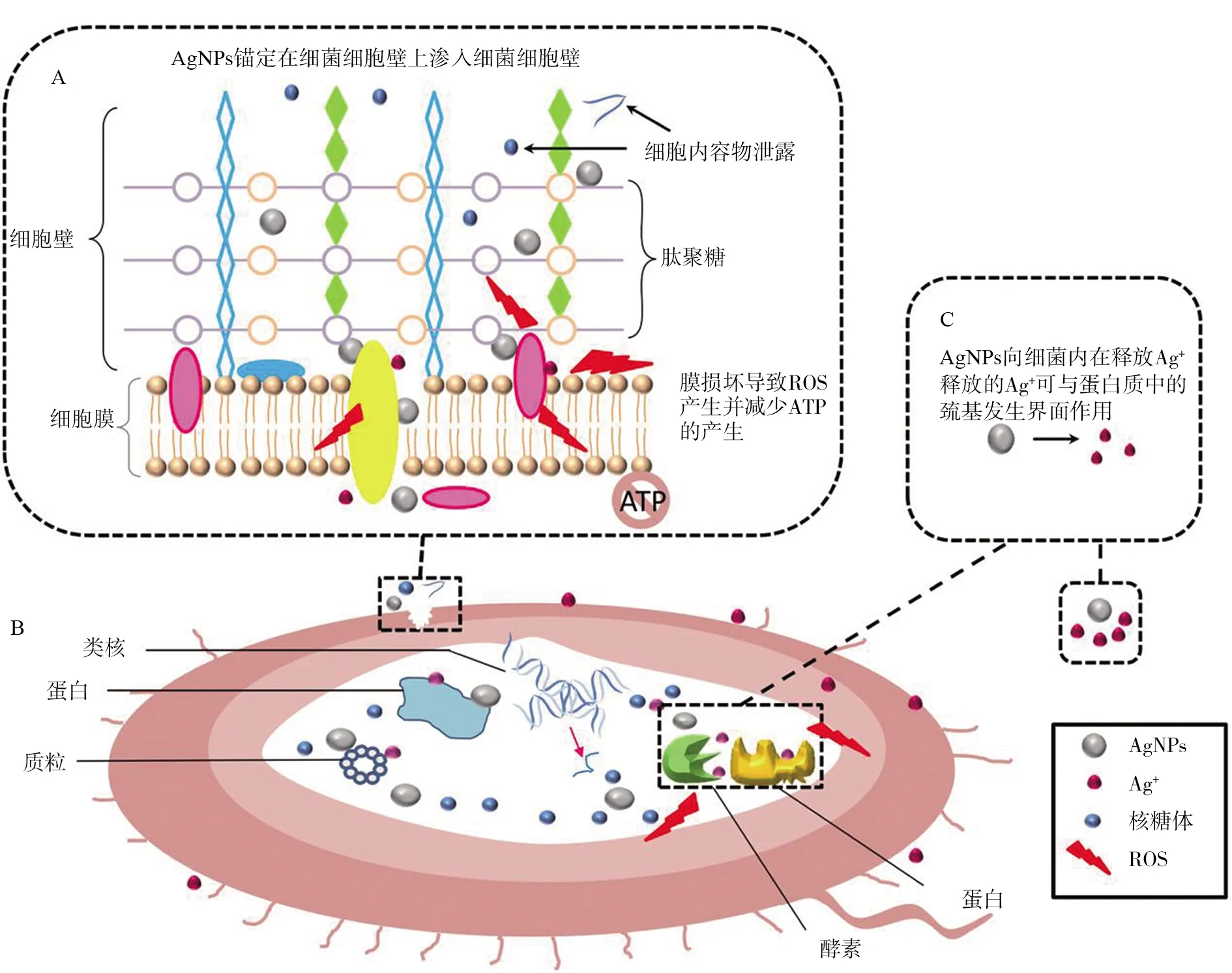
图2 (a)Ag NPs锚定在细菌细胞壁上,渗入细菌,使膜损伤和细胞内含物泄漏.Ag NPs或Ag+与细胞膜中蛋白质结合,后者参与跨膜ATP的产生;(b) Ag NPs渗透到细胞内部和释放的Ag+与细胞结构和生物分子(例如蛋白质、酶、脂质和DNA)相互作用使ROS增加,脂质过氧化和DNA损伤;(c) Ag NPs可以持续释放Ag+进入细菌与蛋白质和酶相互作用Fig.2 (a) Ag NPs is anchored to the bacterial cell wall and penetrates the bacteria, causing membrane damage and cell inclusion leakage.Ag NPs or Ag+ binds to proteins in the cell membrane, which is involved in the production of transmembrane ATP; (b) Ag+, which penetrates into cells and is released by Ag NPs, interacts with cell structures and biomolecules (such as proteins, enzymes, lipids and DNA) to increase ROS, lipid peroxidation and DNA damage; (c) Ag NPs can continuously release Ag+ into the bacteria and interact with proteins and enzymes
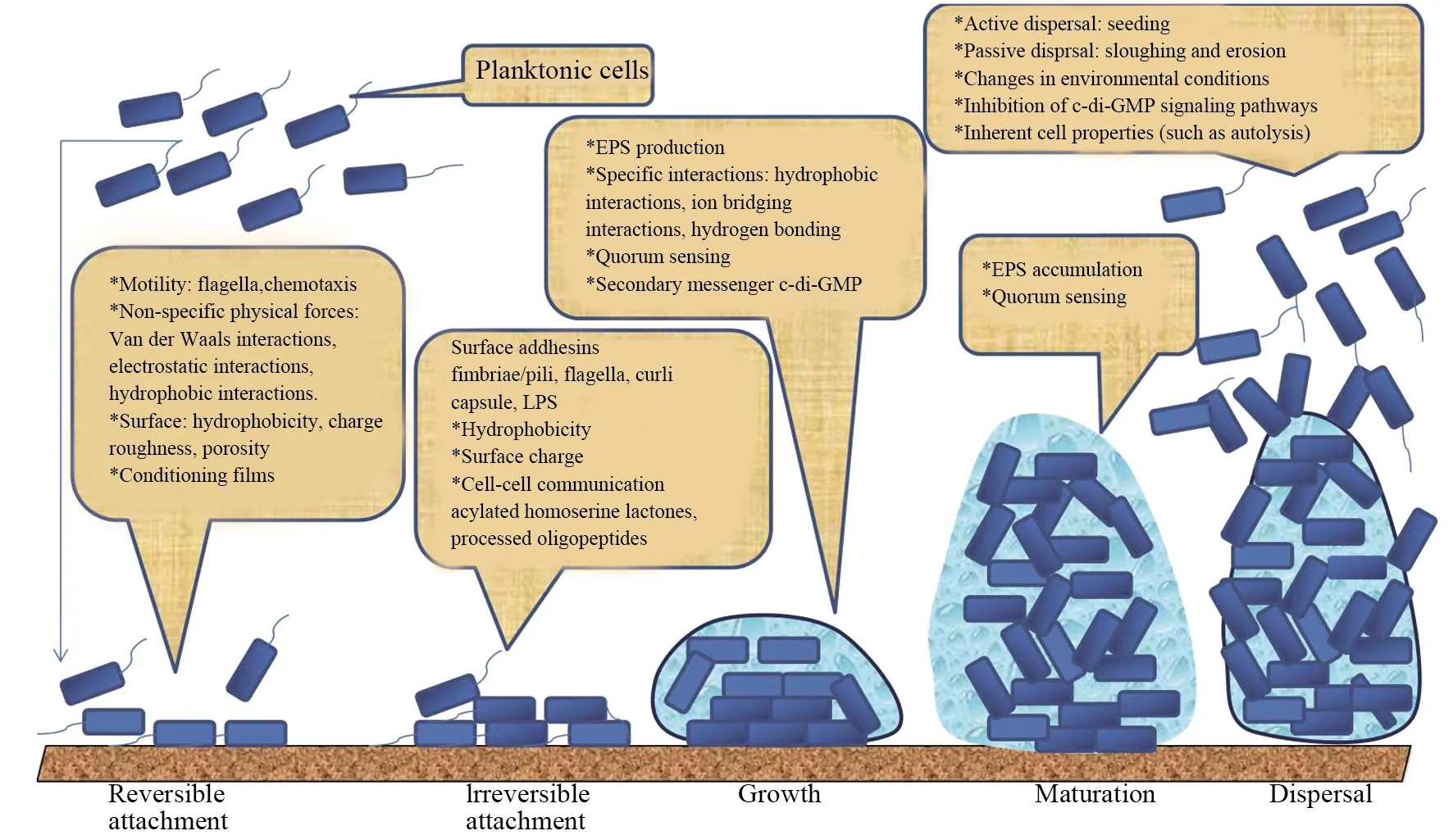
图3 生物膜的生长和扩散主要经历的五个阶段Fig.3 Five main phases leading to the development and dispersal of biofilm
3.2 Ag NPs抗生物膜形成活性的应用
Ag NPs的抗生物膜形成的活性已在许多研究中得到证明[42].KALISHWARALAL等研究了生物合成的Ag NPs对铜绿假单胞菌和表皮葡萄球菌上形成的生物膜的体外活性,结果发现经Ag NPs治疗2 h,生物膜减少了95%和98%,表明Ag NPs能够以快速、高效的方式防止铜绿假单胞菌和表皮葡萄球菌形成生物膜[43].另外一项研究与此报道结果一致,利用Ag NPs修饰的氧化石墨烯(GO)片形成的纳米复合材料,证明了用1 mg/L的Ag NPs处理铜绿假单胞菌细胞时高达95%的生物膜消除,表明此复合材料可以高效地抑制微生物粘附细胞的生长,从而阻止生物膜的形成,为临床的替代疗法开辟了道路[41].目前,已经报道了利用不同物质合成的对抗生物膜形成有效的化合物:1)已成功将姜黄素与Ag NPs联合制备出可有效抑制和消除生物膜的组合复合物.LOO等报道的一例平均尺寸为30 nm的组合化合物,不仅可以有效地消除已建立的成熟生物膜,抑制生物膜的形成,而且被该化合物处理过的细胞具有较强的绿色荧光强度,为观察实验结果提供了方便的路径[36].2)利用植物衍生药物成分槲皮素与Ag NPs结合,制备出具有优异抗生物膜形成的功能复合材料.YU等报道了该化合物在浓度为1 mg/L对大肠杆菌有明显的抑制作用,当浓度为5 mg/L时能通过抑制生物膜形成的相关基因的转录来分解生物膜的结构,甚至杀死生物膜中的细菌.这些数据表明该化合物与一种高效抗生素相当,具有相当大的应用价值和开发潜力[44].3)淀粉被成功用于制备对铜绿假单胞菌和金黄色葡萄球菌产生的生物膜具有破坏作用的Ag NPs;MOHANTY等[45]使用一种简单且环境友好的方法使用淀粉制备无毒Ag NPs的稳定胶体.他们测试了不同浓度的Ag NPs对铜绿假单胞菌和金黄色葡萄球菌形成生物膜的影响.在微摩尔浓度下,更长的处理时间(48 h)将抗生物膜形成的效率提高到约65%,生物膜形成减少了88%.用Ag NPs处理比用抗菌肽(LL-37)处理的铜绿假单胞菌的生物膜形成能力减少约3倍.用Ag NPs处理铜绿假单胞菌的多药耐药菌株,以研究与敏感菌株相比最终增加的耐药性.在多药耐药菌株中,当浓度为20 mg/L时,Ag NPs的抑制率达67%,在105CFU/mL的最佳细菌浓度下对耐药菌株生物膜的形成抑制率为56%.证明多药耐药细菌衍生的生物膜并未显示出对银的耐药性,因此,Ag NPs可作为一种潜在的替代治疗方法,以减少由铜绿假单胞菌感染引起的疾病的严重程度[46].Ag NPs也被证明通过扰动分子间力破坏生物膜基质.在一项研究中,通过共聚焦激光扫描显微镜(CLSM)技术分析了从感染伤口分离出的耐甲氧西林金黄色葡萄球菌(MRSA)和耐甲氧西林表皮葡萄球菌(MRSE)形成的生物膜,经Ag NPS处理24 h的MRSA和MRSE生物膜形成抑制率超过95%.并证明浓度低于50 mg/L的Ag NPs可获得完全的抗生物膜形成的活性[47].Ag NPs的抗生物膜形成的活性也在其他研究中得到了证明,这些研究主要集中于对常规抗生素具有抗性的细菌[47-50].GURUNATHAN等[51]采用异叶菊叶提取物报道了一种简单、可靠、成本效益高、绿色环保的合成Ag NPs的方法.用一系列试验评价了抗生素或Ag NPs或二者联合作用对铜绿假单胞菌、福氏志贺氏菌、金黄色葡萄球菌和肺炎链球菌的抗菌和抗生物膜活性,为Ag NPs的抗菌和抗生物膜效应提供了依据,结果显示出联合应用时氨苄西林和万古霉素对革兰氏阴性或革兰氏阳性细菌的效应明显增强.这些数据表明,将Ag NPs与抗生素联合可能是一种针对细菌感染性疾病的替代治疗策略.目前,Ag NPs已成功地涂覆在医疗设备上,用于无感染移植[52-54].Ag NPs也被涂覆在各种织物上:纳米银的涂层不仅赋予纤维金属特征,使纺织品导电,而且赋予纺织品抗菌性能[55-56].此外,经过Ag NPs处理的伤口敷料已被广泛用于治疗烧伤[51]、开放性伤口和慢性溃疡的感染[57-58],或作为避孕药具、水消毒剂和房间喷雾剂销售[59].总之,目前关于Ag NPs的应用结果令人欢欣,未来有望成为一种十分有用的新型材料.
4 银纳米与抗生素的联合
5 银纳米粒子的毒性
由于银在实际应用中所引发的毒性和环境安全性等问题,评估Ag NPs的毒性成为了一项重要研究课题.随着Ag NPs的普遍使用,每年有大量的银释放到河口或海洋水生系统中,这些银纳米材料进入环境后,会对植物、水生生物和人类造成不可逆转的危害[70-71].银离子沉积在皮肤上会造成银中毒,沉积区域会变成青灰色.临床上,在皮肤、肝脏和脾脏等软组织局部沉积银会引起过敏反应,对血管、胃肠道都具有一定的毒性[72].与亚微米颗粒相比,长时间吸入Ag NPs,即使剂量很低,也会引起肺功能的变化以及炎症[73].另外,LARESE等报道了在体外使用平均尺寸为25 nm的聚乙烯吡咯烷酮修饰的Ag NPs,在静态扩散实验中Ag NPs会渗透到被切除的人皮肤的表皮上层[74].因此,有必要考察Ag NPs对皮肤的渗透能力,更准确地评估Ag NPs的毒性.目前,科研工作者正努力设计具有不同化学表面修饰的Ag NPs,寻求最大功能性与最小毒性之间的平衡,同时在体内和体外对纳米材料进行遗传毒性评价,将体内结果与体外结果相结合进而使Ag NPs在未来应用中更好地造福于人类[75-76].
6 总结与展望
众所周知,纳米技术在生物医学和工业应用中的潜在好处已被广泛挖掘,有望在未来医学中成为最有希望的新手段. Ag NPs具有很强的抗菌和抗病毒活性,具有与各种微生物相互作用、影响细菌生物膜的生长和成熟的能力,可用作广谱抗菌剂.然而,在Ag NPs应用于生物医学领域中会引发系列重要问题,例如毒性和环境安全性.了解在特定无机配体存在下导致Ag NPs转化的溶解动力学对于确定其抗菌活性和对环境的总体毒性至关重要.因此还需要大量的研究来筛选进行抗菌实验时所用的培养基从而更有效地降低其对环境的毒性. Ag NPs的抗菌作用虽已被广泛接受,但其详细作用机理还有许多不完善的地方.如今,更准确的定义Ag NPs的作用机制已成为生物医学研究的重点,因此有必要对其抗菌机制、生物活性和生物相容性等进行更深入系统的研究.为开发高效、低毒、更好解决多药耐药问题的新型抗菌材料提供理论指导.

