ABTS自由基显色分光光度法测定酵素中的黄酮
王明瑞, 侯彦喜, 叶 超
(1.开封大学 材料与化学工程学院,河南 开封 475000;2.开封市发酵食品工程技术研究中心,河南 开封 475000)
以水果、蔬菜、药材等为原料经过发酵得到的酵素产品中,除了含有原料中的营养物质成分外,还增加了有机酸、氨基酸、蛋白酶、胞外糖等次生代谢产物[1-4].因此,酵素具有调理肠胃、促进机体消化吸收、抗氧化、提高免疫力等功效[5].研究证明黄酮类物质具有较强的清除自由基的能力[6-7].目前,常采用色谱法[8-10]和分光光度法[11-13]测定黄酮含量.在分光光度法中,常用的检测体系有Al(NO3)3-NaNO2-NaOH法和AlCl3-NaAc法,存在检测限较高、操作相对复杂、不适合微量黄酮检测等缺点[14-17].本文采用ABTS自由基体系显色法测定食品中的黄酮[18-19],用于检测酵素中存在的黄酮,尝试为食品类样品检测黄酮类物质建立一种快速、准确的检测方法.
1 材料与方法
1.1 材料与试剂
芸香叶苷(卢丁)(含量≥99.0%,分析纯):酷尔化学科技(北京)有限公司; ABTS(2,2-联氨-双(3-乙基苯并噻唑-6-磺酸)二胺盐):美国Sigma公司;超纯水:由DZG-303A艾科浦超纯水机制得;亚硝酸钠、氢氧化钠、硝酸铝、过硫酸钾均为分析纯:天津市福晨化学试剂厂.
番茄、马齿苋酵素系列产品由开封市兰考相关企业生产提供.
1.2 仪器与设备
US/VIS 1800PC紫外可见分光光度仪:上海美谱达公司;ADVENTURERTMPRO 分析天平:美国OHAUS有限公司;HH-1恒温水浴锅:常州市金坛区西城新瑞仪器;DHG-9023A电热鼓风干燥箱:安徽塔兰特仪器科技有限公司;SHB-IIIA循环水式真空泵:北京中兴伟业仪器有限公司;DB-4电热板:常州市金坛区环宇科学仪器厂;KQ-250DA型数控超声波清洗器:昆山市超声仪器有限公司.
1.3 芦丁和ABTS+·相互作用体系光谱图绘制
1.3.1 芦丁和ABTS+·相互作用光谱图
选用3只10 mL容量瓶编号分别为 1、2、3.精密吸取10 g/L芦丁对照品溶液2.0 mL,100 g/L ABTS+·溶液2.0 mL;精密吸取10 g/L芦丁对照品溶液2.0 mL;精密吸取100 g/L ABTS+·溶液2.0 mL;分别加超纯水定容到10.00 mL.三组溶液均以空白超纯水作参比,在波长300~700 nm范围内进行光谱扫描,得到对应光谱图.
1.3.2 ABTS+·体系中,改变芦丁增加量的光谱图
选用5只10 mL容量瓶编号分别为 0、1、2、3、4.准确加入100 g/L ABTS+·溶液2.0 mL后,分别加不同量的芦丁溶液(0、0.50、1.00、1.50与2.00 mL),加水定容到10.00 mL.以不加芦丁的溶液的0号为参比,在波长300~700 nm范围内进行光谱扫描,得到对应光谱图.
1.3.3 ABTS+·体系中,加入番茄酵素、马齿苋酵素后光谱图
选用5只10 mL容量瓶编号分别为 0、1、2、3、4.前3只准确加入100 g/L ABTS+·溶液2.0 mL后,分别加入蒸馏水2.00 mL,番茄稀释液2.00 mL,马齿苋稀释液2.00 mL,摇匀后,加水定容到10.00 mL.3、4号容量瓶分别加入番茄稀释液2.00 mL,马齿苋稀释液2.00 mL,加水定容到10.00 mL.以蒸馏水为参比,在波长300~700 nm范围内进行光谱扫描,得到对应光谱图.
1.4 黄酮测定条件优化
1.4.1 反应温度
准确加入100 g/L ABTS+·溶液2.0 mL后,加入10.0 g/L芦丁标准溶液1.00 mL,摇匀后,加水定容到10.00 mL.在10、15、20、25、30、35与40 ℃水浴中反应15 min.以相同条件下不添加芦丁的ABTS+·溶液为参比,在337 nm 波长下测定吸光度.
1.4.2 反应时间及体系稳定性的确定
准确加入100 g/L ABTS+·溶液2.0 mL后,加入10.0 g/L芦丁标准溶液1.00 mL,摇匀后,加水定容到10.00 mL.在室温条件下,静置2、3、5、10、15、20、30与40 min,以相同条件下不添加芦丁的ABTS+·溶液为参比,在337 nm 波长下测定吸光度.
1.4.3 试剂用量的确定
分别加入100 g/L ABTS+·溶液(0、0.50、1.00、1.50、2.00、2.50与3.00 mL),再准确加入10.0 g/L芦丁标准溶液2.0 mL后,摇匀后,加水定容到10.00 mL.静置15 min,以蒸馏水为参比,在337 nm 波长下测定吸光度.
1.5 芦丁标准曲线的制作
选用9只10 mL容量瓶编号分别为 0~8.准确加入100 g/L ABTS+·溶液2.0 mL后,分别加不同量的10.0 g/L芦丁标准溶液(0、0.25、0.50、0.75、1.00、1.25、1.50、1.75与2.00 mL),摇匀后,加水定容到10.00 mL.静置15 min,以不加芦丁的0号溶液为参比,在337 nm 波长下测定吸光度.以芦丁质量浓度(ρ)为横坐标,吸光度值(A)为纵坐标,绘制芦丁溶液的标准曲线.
1.6 样品及回收率测定
准确吸取番茄、马齿苋发酵液提取液10.00 mL于容量瓶中,加入亚铁氰化钾溶液3 mL和乙酸锌溶液3 mL,至不再产生沉淀为止,定容至100 mL,放置片刻,过滤静置 30 min,用干燥滤纸过滤,弃初滤液,取后续滤液备用.
准确吸取番茄储备液10.00 mL加入超纯水定容到100.00 mL(稀释10倍),马齿苋储备液5.00 mL加入超纯水定容到100.00 mL(稀释20倍).
准确加入100 g/L ABTS+·溶液2.0 mL后,分别加番茄稀释液2.00 mL,马齿苋稀释液1.00 mL,摇匀后,加水定容到10.00 mL.静置10 min,以不加样品的空白溶液为参比,在337 nm 处测定吸光度.
吸取番茄储备液10.00 mL,加入1.00 mL 100 mg/L 芦丁溶液加入超纯水定容到100.00 mL,按照上述操作测定,进行回收率实验.
2 结果与分析
2.1 芦丁和ABTS+·自由基相互作用的紫外可见吸收光谱研究
2.1.1 芦丁和ABTS+·相互作用光谱图
根据1.3.1的操作方法绘制芦丁与ABTS+·、ABTS+·、芦丁吸收光谱图.以蒸馏水为参比,在波长300~700 nm范围内逐一进行光谱扫描,每隔1 nm采集吸光度值,结果如图1.
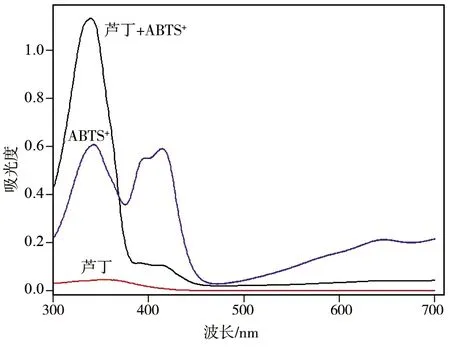
图1 芦丁和ABTS+·光谱扫描图Fig.1 UV visible absorption spectra of rutin and ABTS+· radicals
由图1可知,2.0 mg/L芦丁溶液在300~700 nm波长范围内没有明显吸收.20 mg/L的ABTS+·溶液在300~700 nm范围内有多个吸收峰.在415 nm处有一个ABTS+·稳定的吸收峰,在345 nm处的吸收峰强度略大于415 nm处的吸收峰,吸光度值接近0.6.在加入芦丁溶液后可以看出,在415 nm处的吸收峰明显降低,在345 nm附近吸收峰却明显增强.混合体系的吸收峰稳定在337 nm处.此处吸收峰不是芦丁和ABTS+·溶液吸收峰的简单加和,因此,可以利用此吸收峰来测定芦丁的含量.
2.1.2 ABTS+·体系中,改变芦丁增加量的光谱分析
根据1.3.2的操作方法绘制不同芦丁加入量时,体系的吸收光谱图.实验中以不加入芦丁的空白溶液为参比,在波长300~700 nm范围内进行光谱扫描,每隔1 nm采集吸光度值,结果如图2所示.由图2可知,随芦丁样品浓度的增加,在415 nm处的吸收峰明显降低,337 nm处的吸收峰呈增加趋势,因此在369 nm处形成一个等吸收点.在此波长处,体系吸光度不随着芦丁加入量的改变而改变.随着芦丁浓度的增大,337 nm处的吸光度增加幅度减弱,分析原因ABTS+·用量不足,造成回归方程的相关系数降低.根据415 nm吸光度减少,337 nm处吸光度增加,分别进行数据测定,并进行数据处理.实验结果表明,337 nm处相关系数(R2=0.997 8)>415 nm处相关系数(R2= 0.995 2).因此,实验中选择337 nm作为ABTS自由基体系检测芦丁含量的检测波长.
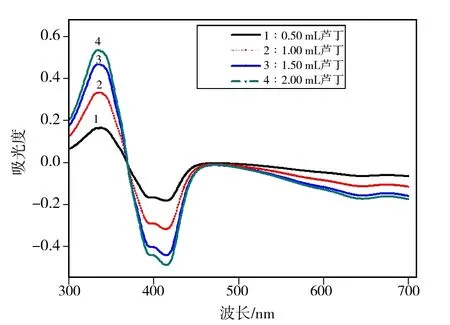
图2 不同浓度的芦丁溶液与ABTS+· 的光谱图Fig.2 Spectrogram of Rutin solution with different concentrations and ABTS+·
2.1.3 ABTS+·体系中,加入番茄酵素、马齿苋酵素后的光谱分析
根据1.3.3的操作方法绘制番茄酵素、马齿苋酵素溶液与ABTS+·作用体系的吸收光谱图.实验结果如图3所示.
由图3可知,检测范围内的番茄酵素溶液和马齿苋酵素溶液本身在300~700 nm波长范围内没有明显吸收,加入ABTS+·后,混合体系在337 nm处的吸收峰增加显著.因此,实验中选择337 nm作为ABTS自由基体系检测番茄酵素溶液和马齿苋酵素溶液中黄酮含量的检测波长.
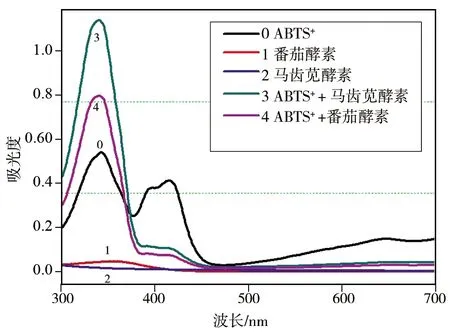
图3 酵素溶液与ABTS+·作用的光谱图Fig.3 Spectrogram of fermentation extract solution and ABTS+·
2.2 检测条件优化结果分析
2.2.1体系温度
体系温度对吸光度的影响如图4所示.由图4可知,反应温度升高,体系吸光度上升不明显.经实验测试发现,温度高时,工作曲线的线性变差,因此实验时选定测试温度为室温20 ℃.
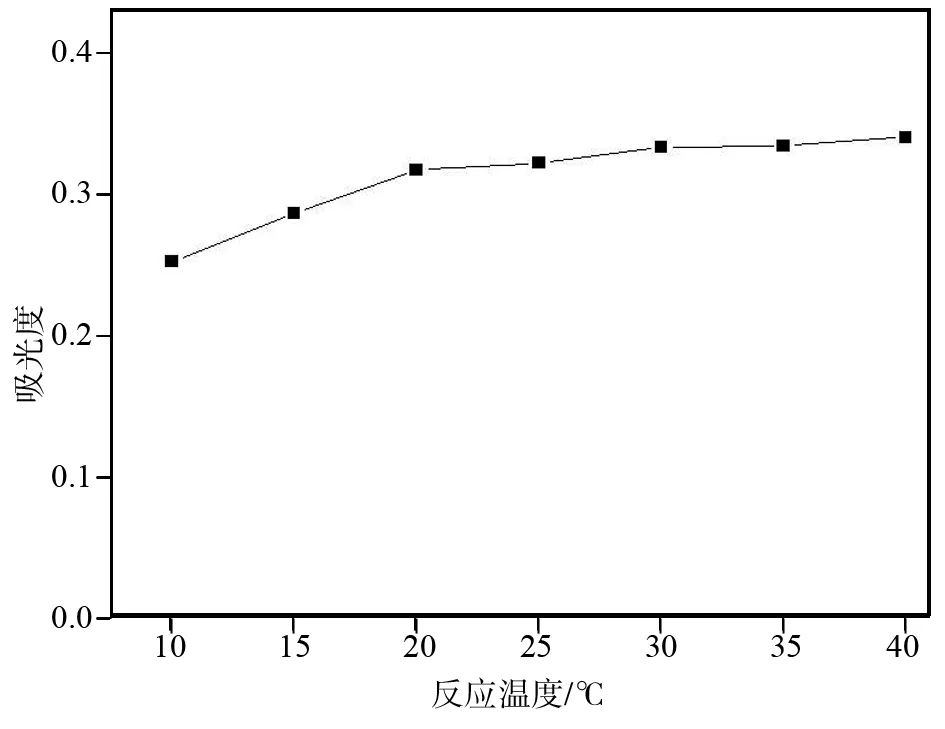
图4 反应温度对吸光度的影响Fig.4 Effects of temperature on absorbance
2.2.2 反应时间与体系稳定性
按照1.4.2操作,研究反应时间和反应体系的吸光度稳定性,以时间为横坐标,吸光度为纵坐标,绘制图谱.试剂加入3 min后,体系的吸光度趋于稳定,在一个小时内吸光度受时间变化影响可以忽略.所以根据实验测试结果,在溶液配制完成后,选择静置15 min,再进行吸光度检测.
2.2.3 体系酸度
通过实验研究发现,在弱酸环境中,体系吸光度不受酸度变化影响.本实验所用试剂为中性或者弱酸性(酵素一般是弱酸性,pH不高于4).经检测,本实验使用反应体系溶液在3.8~4.5之间,因此在实验过程中不再加入缓冲溶液控制溶液的pH.
2.2.4 试剂用量
ABTS+·用量对检测体系有重要影响,结果如图5所示.实验中,保持芦丁的用量不变,不断增加ABTS+·用量,可以看出在337 nm处吸收峰增加,在415 nm处吸收峰逐渐显现.415 nm处是ABTS+·的吸收峰,可以反映出ABTS+·剩余量.使用0.5 mL的ABTS+· 溶液(图中曲线1),1.0 mL ABTS+·溶液(图中曲线2)在415 nm处的吸光度接近0,说明芦丁使ABTS+·完全转化,此时ABTS+·用量是不足的.进一步实验研究表明在低浓度的ABTS+·溶液中,测定低浓度的芦丁回归方程的线性良好,当芦丁浓度增大时回归方程的线性明显降低.进一步证明了ABTS+·用量不足.另一方面,当增加ABTS+·用量时,ABTS+·自身在337 nm处吸收增大,将会影响实验结果的精密度和准确性.因此本实验选用ABTS+·浓度为100 mg/L,用量为2 mL.
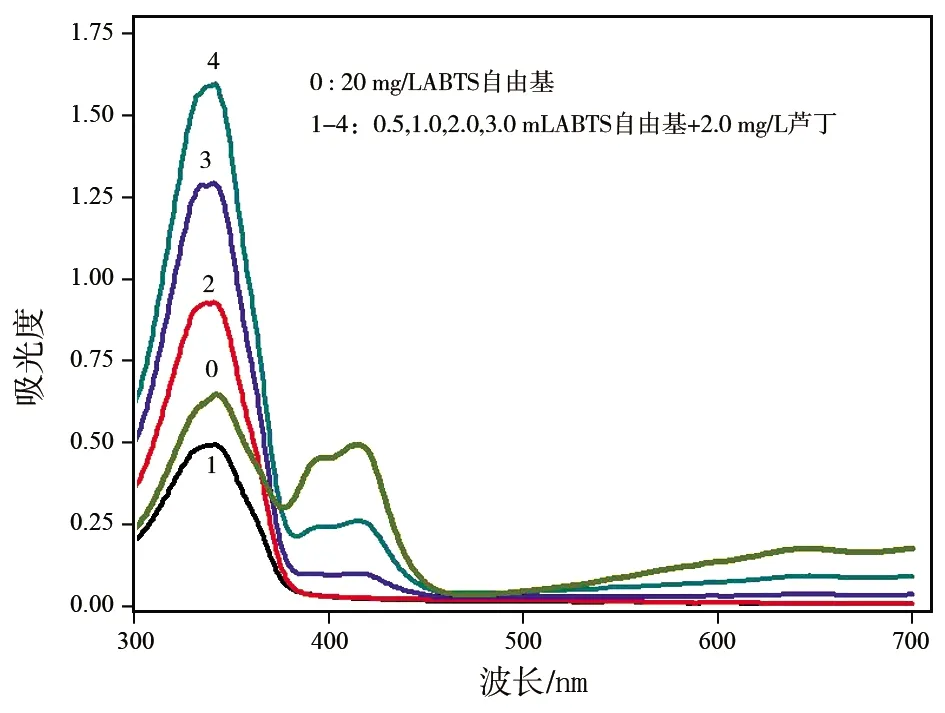
图5 ABTS+·用量对吸光度的影响Fig.5 Effects of ABTS+·on absorbance
2.3 工作曲线及样品测定
按照1.5的操作方法,以芦丁质量浓度(ρ)为横坐标,吸光度值(A)为纵坐标,绘制芦丁溶液的标准曲线,如图6所示.由图6可知,实验测定芦丁标准曲线回归方程为:A= 0.269 3ρ+0.000 3,相关系数R2=0.999 98,研究表明芦丁在0~2.00 mg/L质量浓度范围内与吸光度呈现良好的线性关系,最低检测限为 0.04 mg/L.
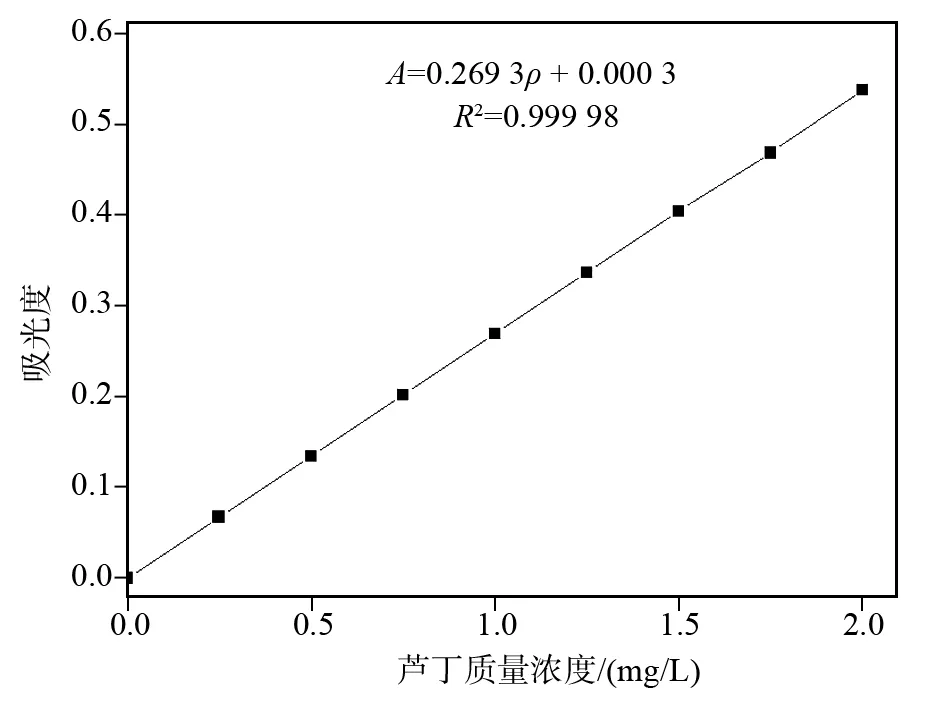
图6 芦丁标准曲线Fig.6 Standard curve of Rutin
按照1.5的操作,计算番茄原液中黄酮含量为630.1 mg/L,马齿苋发酵液中黄酮含量为2 513 mg/L.
2.4 方法学考察
2.4.1 精密度试验
取同批次稀释100倍的番茄发酵稀释液,按上述确定的检测条件在波长337 nm处连续测定6次吸光度值.测定结果分别为0.339 6、0.337 4、0.337 6、0.340 2、0.341 2、0.341 8,RSD为 0.54%,低于2%,说明仪器精密度良好.番茄发酵液、马齿苋发酵试液的黄酮含量测定结果及精密度测试数据见表1.分析数据可知,仪器和方法精密度良好,满足化学分析方法确认和验证的技术要求.
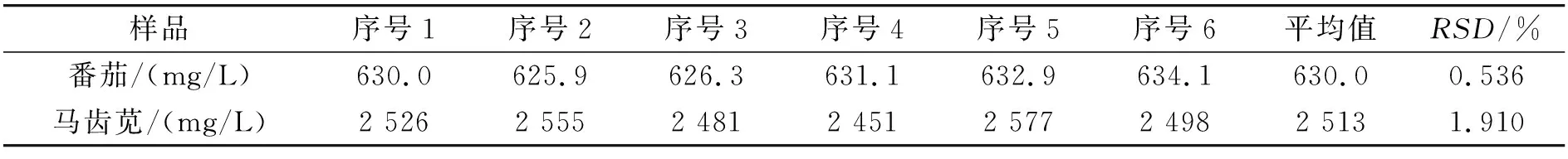
表1 番茄、马齿苋酵素发酵液中黄酮含量
2.4.2 重复性试验
选择不同批次稀释100倍的番茄发酵稀释液,按1.6操作测定6次吸光度值.对测定结果进行统计分析,RSD值为1.37%,低于2%,说明此显色法测定酵素溶液中的黄酮的重复性良好.
2.4.3 回收率试验
番茄酵素中黄酮回收实验结果列于表2 中.由表2可知,在番茄酵素中添加芦丁标液检测平均回收率在98.2%,RSD值小于2%,证明该方法对芦丁的回收性良好,该方法准确度良好.
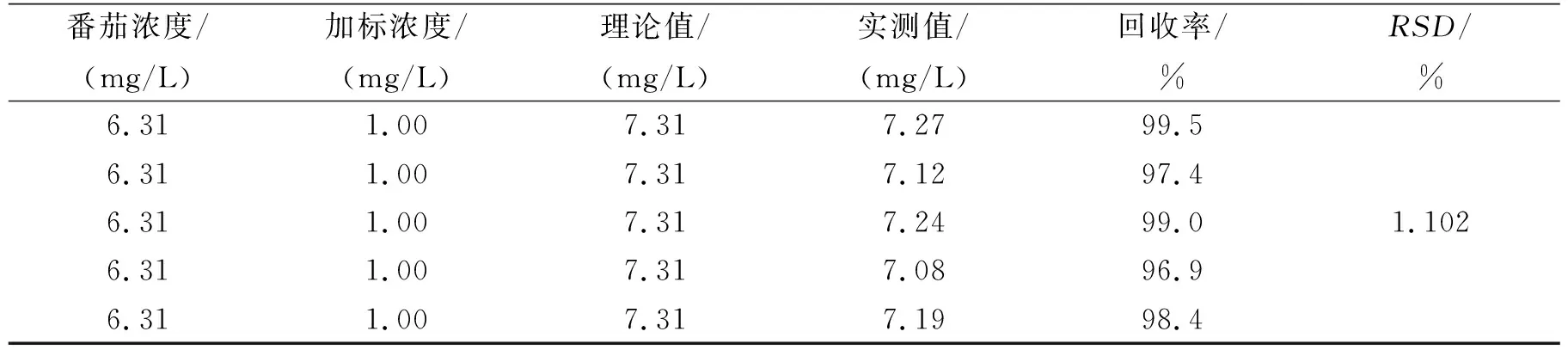
表2 番茄酵素中黄酮回收实验结果
2.4.4 与分析方法测定结果的比较
采用Al(NO3)3-NaNO2-NaOH法检测番茄、马齿苋发酵液中的黄酮含量,重复测定5次,取其平均值.与ABTS+·显色体系测定结果进行对比.研究表明,采用2种方法测定番茄、马齿苋发酵液中的黄酮含量结果基本一致,相对偏差都小于3%,说明2种方法检测结果无显著性差异.说明本方法在测定发酵液中的黄酮时方法可靠.
3 结论
本研究分析ABTS+·溶液加入黄酮类后,在337 nm处的吸光度显著增加,再对测定条件进行考察,在最佳实验条件下测定两种酵素溶液中的黄酮含量.根据测定结果分析可知,番茄、马齿苋两种酵素发酵液中黄酮含量(以芦丁存在形式计量)分别为630.1、2 513 mg/L.由此可知番茄和马齿苋在发酵后溶液中可测定的黄酮上升显著.
通过方法比较、准确度及精密度分析,建立了可同时、批量测定酵素样品中黄酮类物质新的紫外可见分光光度法.研究表明此方法操作简单、反应迅速、检测限低,适合样品中微量黄酮的测定.

