麦芽炒制过程中消化酶活力的研究*
贺 倩,刘 翠,李新欣,周 霞
(西南交通大学 生命科与工程学院,四川 成都 610031)
消化酶是将食物消化分解为利于人体吸收的小分子物质[1],即存在于人体消化道中,又是许多药物的重要组成成分,本质上是一种蛋白质,故具有蛋白质的各种性质,如其生理活性受温度、pH值等环境因素的影响;而存在于药物中的消化酶活性还与加工过程,如炮制时间、炮制方法等密切相关。
麦芽性甘、味平,为禾本科植物大麦HordeumvulgareL.的成熟果实经发芽干燥的炮制加工品[2],临床常用的消食药之一。酶类、糖类为麦芽主要活性成分,具有活血化瘀、行水消肿等药理作用[3],然而目前对于麦芽功效研究绝大部分聚焦于消食方面。因此,本研究选取蛋白酶及淀粉酶为指标,旨在通过测定麦芽炒制过程,不同时间淀粉酶与蛋白酶活力的变化规律,为麦芽炒制消食的机理研究提供实验依据。
1 实验部分
1.1 材料与设备
麦芽饮片(安徽181110北京同仁堂四川有限责任公司);麦芽糖对照品(纯度≥98%贵州迪大生物科技有限公司);酪蛋白(AR成都科龙化工试剂有限公司);福林试液(AR上海荔达生物科技有限公司);酪氨酸对照品(纯度≥99.0%上海慧兴生化试剂有限公司);其余试剂均为分析纯。
PWC-124电子分析天平(艾德姆衡器(武汉)有限公司,max=120g,d=0.0001g);GM900 非接触式红外测温枪(深圳市聚茂源科技有限公司);LX-02利祥多功能粉碎机(上海江信科技有限公司);TGL-16G高速台式离心机(上海安亭科学仪器厂);DK-98-II电热恒温水浴锅(天津泰斯特仪器有限公司);SB-25-12D超声波清洗机(宁波新芝生物科技股份有限公司);DHG-9030A电热恒温恒温干燥箱(上海精宏实验设备有限公司);752N紫外可见分光光度计(上海佑科仪器仪表有限公司)。
1.2 方法
1.2.1 样品制备
炒锅预热,依《中国药典》2015版四部清炒法(通则 0213),于 380~450℃[4]清炒麦芽,从 0 开始,依次间隔2min取样,共7次,编号M0-M6,冷却后粉碎,过60目筛,备用。
1.2.2 淀粉酶活力测定[5]
1.2.2.1 淀粉酶提取液的制备 于各研钵中称取编号M0-M6的麦芽样品1g,加入10mL蒸馏水,研磨均匀后转移至离心管,于25℃下静置20min,间隔数分钟振摇1次,再以5000r·min-1条件离心30min后,收集上清液,转至编号为MT0-MT6的25mL量瓶,加蒸馏水定容,摇匀,即得。
1.2.2.2 DNS试剂的配制 于盛有25mL蒸馏水的烧杯中溶解酒石酸钾钠9.1g,水浴至微热后逐次加入3,5-二硝基水杨酸0.32g、NaOH 1.0g、苯酚0.25g,搅拌至全,转至50mL棕色容量瓶中,冷却后定容,于室温暗处保存。
1.2.2.3 淀粉溶液的配制 称取可溶性淀粉1.0g,加至盛有50mL蒸馏水的烧杯中加热至完全溶解,待冷却后转入容量瓶,用蒸馏水定容至100mL,室温保存。
1.2.2.4 绘制标准曲线 称取0.1g麦芽糖对照品溶于100mL蒸馏水中,配制得1mg·mL-1麦芽糖对照液。取20mL具塞刻度试管7支并编号1~7,于试管中加入麦芽糖对照液 0,0.4,0.6,0.8,1.0,1.2,1.4mL,配置成具有浓度梯度的溶液,混匀。将2mL DNS试剂加入各试管中,并以水浴加热至沸腾5min,冷却后定容至15mL。空白对照为1号试管,在波长540nm处,以比色管测吸光度,将麦芽糖浓度和吸光度进行线性分析,得回归方程A=10.727C-0.0122,r=0.9996,且麦芽糖浓度在 0.025~0.122 mg·mL-1内与吸光度线性相关。
1.2.2.5 样品淀粉酶活力的测定 7支20mL具塞玻璃试管中各加入淀粉酶提取液1mL,并编号MC0-MC6。将各试管和“2.2.3”项下配制的淀粉溶液于40℃水浴10min,并加入1mL淀粉溶液于各试管中于40℃水浴5min,取出后,将2mL DNS试剂加入其中,混匀后煮至沸腾5min,冷却后以蒸馏水定容,即得。另取7支试管作空白对照,编号KF0-KF6,将1mL淀粉溶液换成蒸馏水,其余操作同上,于540nm波长处检测,共3次。取样品3次吸光度平均值,计算出与相应空白对照的吸光度之差,麦芽糖含量可在前述的标准曲线上求得,淀粉酶活性以单位重量麦芽样品每分钟在酶催化下产生的麦芽糖的质量表示,即 mg·(min·g)-1。
1.2.2.6 精密度试验 取0.054mg·mL-1的麦芽糖溶液为标准液,多次测定并记录吸光度,计算其RSD值为0.147%(n=6),说明该仪器精密度较好。
1.2.2.7 稳定性试验 取编号M0麦芽样品1.00g于20mL试管中,按“1.2.2.5”项下依法进行显色处理,在放置 0、1、2、3、4h 后测其吸光度,结果表明,其在4h内稳定,RSD值为1.05%(n=5),样品稳定性高。
1.2.2.8 重复性试验 以“1.2.2.5”的操作方法,对编号M0的1.00g样品进行显色处理,测吸光度并计算。结果得出RDS=0.75%(n=6),表示此实验具有高重复性。
1.2.2.9 加样回收率试验 精密称取6份未经炮制的麦芽样品0.5g,将7.50mg麦芽糖对照品加入其中,其余过程同“1.2.2.5”,测吸光度,并将其代入标准曲线计算含量。计算出平均加样回收率为98.67%,RSD=0.98%,结果证明该实验方案的准确度良好。
1.2.3 蛋白酶活力测定[6,7]
1.2.3.1 蛋白酶提取液制备 分别称取编号M0~M6麦芽1g,加20mL蒸馏水,于40℃水浴加热1h,间断搅拌,滤过,以PBS缓冲液将滤液稀释1倍,即得蛋白酶提取液,编号MX0~MX6用于测定蛋白酶活性。
1.2.3.2 磷酸盐缓冲液(pH值6.8)的配制 将118mL 0.2mol·L-1NaOH,250mL 0.2mol·L-1KH2PO4溶液与烧杯中搅拌均匀,再转移至1000mL容量瓶,以蒸馏水稀释定容,即得。
1.2.3.3 福林酚试液的配制 将等体积4%Na2CO3溶液与0.2mol·L-1NaOH溶液混匀得福林酚试液 A(即甲液);乙液是将等体积0.04mol·L-1CuSO4溶液与2%酒石酸钠溶液混匀,甲液∶乙液为50∶1,用时混合均匀,现配现用。
1.2.3.4 三氯醋酸溶液的配制 取6.5g三氯醋酸于烧杯中用少量蒸馏水溶解,后转移至100mL容量瓶,定容即得。
1.2.3.5 绘制标准曲线 称取干燥的酪氨酸0.1g于1000mL容量瓶中,加入少量盐酸使其完全溶解,以蒸馏水定容,配得0.1g·L-1酪氨酸溶液。于6只10mL容量瓶中各加入 0.0、2.0、4.0、6.0、8.0、10.0mL 酪氨酸溶液,加蒸馏水至刻度。另取具塞玻璃试管6支,编 号 T1~T6, 分 别 加 入 浓 度 0、2.0、4.0、6.0、8.0、10.0μg·mL-1酪氨酸溶液 1mL,再将 0.4mol·L-1Na2CO35mL,福林酚试液1mL,蒸馏水2mL加入其中,振摇均匀,于40℃水浴20min。于680nm波长处测定。以酪氨酸浓度和吸光度进行线性回归,得回归方程:A=0.0685C+0.0103,r=0.9997, 线性范围2.156~10.886μg·mL-1。
1.2.3.6 样品蛋白酶活力的测定 离心管中加“1.2.3.1”项下配制的蛋白酶提取液1mL,将其同酪蛋白一起水浴加热5min后,于离心管加入1mL酪蛋白,保温 10min,以加入 2mL 0.4mol·L-1三氯醋酸来终止反应。于40℃水浴保温持续20min后离心,将剩余蛋白质过滤后得滤液,于试管依次添加1mL滤液,2mL 蒸馏水,1mL 福林试液,5mL 0.4mol·L-1Na2CO3,摇匀,40℃水浴加热20min。另取1只离心管作为空白对照,编号L0,取1mL蒸馏水加至离心管,依次加入三氯醋酸2mL和酪蛋白,其余同前。按“1.2.3.5”项下方法,于680nm波长处测定3次。以样品吸光度平均值与L0号离心管的吸光度做差,计算出的结果代入“1.2.3.5”项下求得的标准曲线,从而计算出酪氨酸质量。蛋白酶活力为40℃时,单位质量麦芽样品在酶的作用下于单位时间内产生的酪氨酸含量,即 μg·(min·g)-1。
1.2.3.7 精密度试验 取6份浓度为5.229μg·mL-1的酪氨酸溶液为对照品,测定其吸光度并记录,求得RSD值为0.285%,可见实验仪器精密度符合要求。
1.2.3.8 稳定性试验 取编号M5的麦芽样品1.00g,显色过程同“2.3.6”,于4h内每隔1h测定5次吸光度,代入前述求得的标准曲线进行计算,得RSD=0.81%,显示样品稳定性达标。
1.2.3.9 重复性试验 取6份炮制8min的麦芽样品(每份1.00g),每份样品皆由“1.2.3.6”项下的操作方法显色,在680nm处测吸光度。以标准曲线计算并求出RDS为1.08%,表明重复性良好。
1.2.3.10 加样回收试验 精密称取6份编号M5的样品(每份0.5g),于试管中加入2.00g酪氨酸对照品,按“2.3.7”项的实验方法进行显色操作,在最佳波长处测吸光度,根据标准曲线算含量。求得其平均回收率为98.12%,(RSD=1.02%),表示本实验方案的准确度符合要求。
2 结果与分析
2.1 淀粉酶活力的变化
采用DNS比色法测定淀粉酶活力,并规定在40℃下每分钟淀粉酶催化分解淀粉生成1mg麦芽糖的酶量为一个活力单位(U),即 U=C×20mL×N/5min=C×100(式中N为稀释倍数,N=25)。以炒制时间和淀粉酶活力为坐标轴作图。见表1,图1。

表1 麦芽淀粉酶活力(n=3)Tab.1 Amylase activity of malt(n=3)
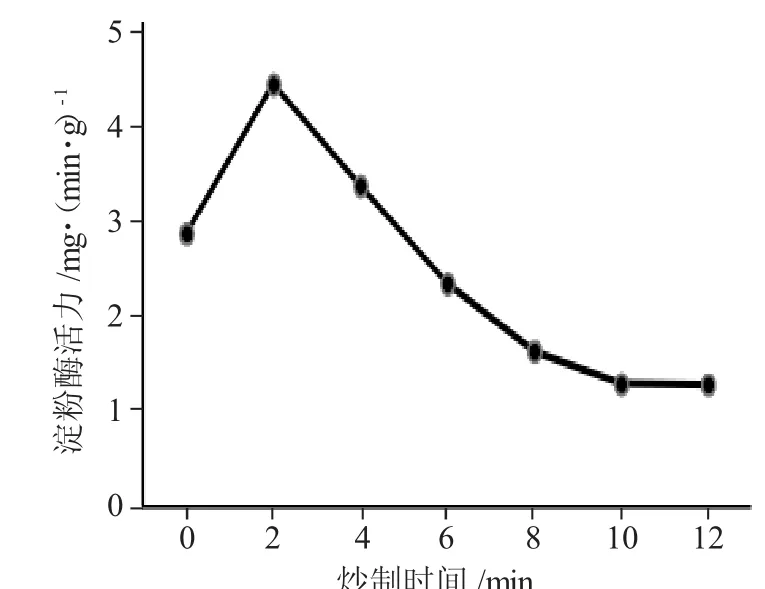
图1 麦芽淀粉酶活力Fig.1 Amylase activity of malt
结果显示,麦芽炒制过程中,淀粉酶活力变化趋势为,先小幅上升后大幅下降。其中,在炒制2min时其增加达到峰值,之后持续下降,6min时的活力降到生麦芽以下,并在8~12min趋于平缓。0~2min出现上升可能是因为加热时间短,麦芽内部温度轻微上升,使淀粉酶活力上升;2min之后大幅度下降是因为随着炒制时间的延长,麦芽内部温度增幅变大,淀粉酶开始失活。
2.2 蛋白酶活力的变化
蛋白酶活力的测定采用福林酚试剂法,根据规定,酶活力单位(U)是40℃下,酪蛋白在蛋白酶催化下每分钟分解为单位酪氨酸的酶量。即U=C×9mL×160/10min=C×144。以炒制时间和蛋白酶活力为坐标轴作图。见表2,图2。

表2 麦芽蛋白酶活力Tab.2 Protease activity of malt
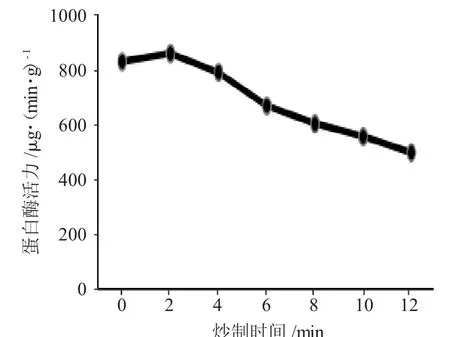
图2 麦芽蛋白酶活力Fig.2 Protease activity of malt
图2 表明,麦芽炒制过程中,同淀粉酶活力一样,蛋白酶活力呈现出与其类似趋势,即先上升后下降,且幅度较之更小。其中,达峰值时间为2min,活力降至生麦芽以下为4min时。0~2min出现上升可能是因为加热时间短,麦芽内部温度轻微上升,使蛋白酶活力上升;2min之后大幅度下降是因为随着炒制时间的延长,麦芽内部温度增幅变大,蛋白酶开始失活。
实验结果显示,随炮制时间延长,淀粉酶与蛋白酶活力均降至生麦芽之下,而临床用作消食主要以焦麦芽,炒麦芽为主。表明麦芽中除了淀粉酶与蛋白酶,可能还有其他有助于消食和胃的成分,其炒制后消食作用机理需待进一步研究。
3 讨论
3.1 评价指标的选择
麦芽主治消化不良,脾虚食少等症[2],朱建龙[8]研究发现不同麦芽炮制品对消化酶,消化液的分泌有不同程度的促进作用。麦芽中与消食相关的成分包括淀粉酶、蛋白酶、转化糖酶及乳酸等,而上述成分中,蛋白酶和淀粉酶能分别水解蛋白质和淀粉,与人体食物消化吸收最为密切。因此,淀粉酶与蛋白酶活力为本实验的评价指标,研究麦芽中该两种消化酶在不同炒制时间下的影响。
3.2 美拉德反应
美拉德反应是一种非酶褐变反应,5-羟基糠醛为其标志中间性产物,在中药炮制过程中,可通过还原糖与氨基化合物缩聚而成[9]。麦芽糖为含有游离醛基的二糖,是典型的还原糖;而麦芽中存在的消化酶、蛋白质、氨基酸等均含有大量游离氨基,可作为氨基供体与麦芽糖反应。研究显示[6,10],麦芽在炒制过程中5-HMF的含量逐渐增加,表明麦芽炮制过程中确实存在美拉德反应,并能产生焦香,健脾消化。故推测麦芽炮制后消食导滞作用增强可能与美拉德反应中产生的一些中间性产物作用有关。
3.3 肠道菌群
肠道菌群为人体肠道内寄居的所有微生物,种类繁多,其能通过分泌肠道酶参与食物中蛋白质、纤维素等物质的代谢,对于体内食物消化吸收发挥重要作用。肠道菌群失调则引起体内食物分解受阻,导致消化不良。肠道菌群的生长需要益生菌作为底物,郑红斌等[11,12]研究发现麦芽中麦芽纤维是益生菌的一种,可以改善溃疡性结肠炎小鼠肠道菌群失调状态。Araki Y[13]等人实验表明麦芽纤维中物质能改善肠道环境,对于胃肠道疾病有良好的治疗作用。因此,推测麦芽纤维可以直接促进肠胃蠕动或者通过调控肠道菌群来起到消化积食之功效。

