基底节区高血压脑出血锁孔内镜和立体定向置管联合尿激酶引流术式疗效的比较
毛锦龙,徐永革,罗永春,张国珍,梁 明,胡野风,沈春森
中国人民解放军总医院第七医学中心神经外科,北京 100700
自发性脑出血发病率为12~15/(10万人·年),在我国,自发性脑出血占所有脑卒中患者的18.8%~47.6%[1- 2]。其病死率至今仍高居不下,1年生存率大约为40%[3],10年生存率仅为24%[4]。即使患者长时间存活,仍会遗留严重的残疾,仅有约20%的患者恢复生活自理[3]。基底节区脑出血是高血压脑出血最常见的部位,约占所有脑出血的半数以上,是造成患者偏瘫、失语、吞咽障碍的重要原因。对脑出血患者进行及时的神经功能评估并判断是否需要外科手术治疗至关重要[5- 6]。对于幕上脑出血手术治疗效果尚无定论,不过对于血肿体积较大、存在严重神经功能障碍或陷入昏迷的患者,手术是一种选择[6]。传统手术方式主要为开颅血肿清除术,但传统开颅手术死亡率较高,脑出血外科治疗研究(surgical trial in intracerebral hemorrhage,STICH)以及STICH Ⅱ研究显示,开颅手术清除血肿并不能改善患者预后[7- 8],目前微创的手术方法越来越多地应用于脑出血中,通常采用较小的切口、较小的颅骨骨瓣(锁孔)或骨孔,手术清除血肿或直接进行血肿引流。目前认为微创手术效果优于传统开颅手术[9- 11]。锁孔开颅神经内镜下血肿清除术(keyhole approach endoscopic surgery,KAES)与立体定向置管联合尿激酶引流(stereotactic aspiration plus urokinase,SAU)均为目前较为常用的微创手术方法,但两种微创手术方式对深部脑出血患者的短期效果和远期预后的影响,目前存在争议,国内多家中心报道内镜手术明显优于钻孔引流[12- 14],而一项Meta分析显示钻孔引流与内镜手术对预后无差别[15]。因此,本研究对本院收治的117例基底节区高血压脑出血患者进行回顾性分析,比较两种术式的手术时间、失血量等,探讨术后近期和远期疗效。
资料和方法
临床资料回顾性纳入本院神经外科2016年1月至2018年12月收治的基底节区高血压脑出血患者,入组标准:存在高血压病史,既往生活自理且初次发病,头CT检查显示基底节区脑出血(外囊、内囊、丘脑),年龄大于18岁,出血量大于30 ml,间隔6 h复查CT血肿无进展性增多,接受微创手术的患者。排除标准:动脉瘤或动静脉畸形出血以及肿瘤卒中者(经CT脑血管成像或磁共振脑血管成像检查排除),长期接受抗血小板或抗凝治疗,出血破入脑室造成脑室铸形与梗阻性脑积水,存在脑疝者。
共纳入患者117例,年龄33~87岁,中位年龄57岁,其中男性82例、女性35例。入院评估格拉斯哥昏迷评分(Glasgow coma scale,GCS)为9[7,12]分,美国国立卫生研究院卒中量表评分(National Institute of Health Stroke Scale,NIHSS)为22[16.5,28.0]分,平均血肿体积(46.99±18.12)ml。血肿体积通过BRAINLAB iPLAN CRANIAL软件(3.0版本,德国Brainlab公司)进行计算,将薄层CT数据导入,每个层面上勾画血肿边界,完成血肿三维重建,软件自动计算出血肿体积。术后各个时期的血肿清除率(hematoma clearance rate,HCR)=(术前血肿体积-术后血肿体积)/术前血肿体积×100%。将回顾纳入的患者根据所接受术式不同,分为KAES组(63例)与SAU组(54例)。比较两组患者的性别、年龄、血肿体积、手术时间、手术失血量、引流管留置时长、血肿清除率、GCS评分、NIHSS评分。
手术技术所有患者进行术前导航(Kolibri神经导航系统,德国Brainlab公司),靶点设定为血肿中心,切口设计于发际内,根据血肿长轴设计手术路径,并确定血肿深度,全麻下完成手术。KAES组手术方式参考本中心前期研究[16],导航引导下锁孔开颅神经内镜辅助下清除血肿并留置引流,SAU组导航引导下钻孔置入10号引流管,尾端头皮下潜行2 cm另戳孔引出,使用5 ml注射器缓慢将未凝固的血抽出,出现轻微阻力时立即停止,术后3 h复查头CT观察引流管位置。无新发出血及引流管位置满意者,给予鞘内注射2万IU尿激酶,夹闭2 h后开放,引流过程中不进行回抽操作,以减少再出血风险,间隔8 h用药,引流瓶挂于平外耳道水平,若引流出现脑脊液,需适当抬高,以防止脑脊液过度引流。两种术式均记录手术时长(切皮至缝合完成)与术中出血量。
术后处理及评估术后采用镇静联合静脉降压药控制血压[收缩压控制在140 mmHg(1 mmHg=0.133 kPa)内],残余血肿体积(residual hematoma volume,RV)小于15 ml或引流管脱离血肿者拔除引流管。记录引流管留置时长。分别于术后超早期(1~3 d)、术后早期(4~7 d)、术后短期(8~14 d)进行神经功能评估,记录GCS及NIHSS评分,记录术后30 d内严重并发症情况,死亡患者分析原因,术后6个月电话随访患者,记录改良Rankin评分(modified Rankin scale,mRS)。
统计学处理采用SPSS 25.0统计软件进行数据分析。计量资料数值进行正态性检验,符合正态分布的数值采用均数±标准差表示,偏态分布数值采用中位数[四分位数](M[P25,P75])表示,计数资料以例数及率(%)表示。对于正态分布的样本,组间比较采用独立样本t检验;非正态分布样本,组间比较采用Mann-WhitneyU秩和检验。计数资料的组间比较采用χ2检验。双侧P<0.05为差异有统计学意义。
结 果
基本情况患者年龄、性别、术前血肿体积、GCS评分、NIHSS评分两组比较差异均无统计学意义(P均>0.05)(表1)。
手术安全性30 d死亡及严重并发症情况两组之间差异无统计学意义(P均>0.05)(表2)。KAES组1例患者发生再次出血并于术后3 d死亡(男,59岁,右基底节区出血67 ml),再出血率及病死率为1.6%;SAU组无再出血病例,1例患者术后5 d死亡(男,79岁,右基底节区出血60 ml,死因为心肺功能衰竭),病死率为1.9%,1例患者术后出现葡萄球菌颅内感染,在使用盐酸万古霉素抗感染治疗后好转。死亡患者未计入后期功能评分。

表1 KAES组与 SAU组的基线数据,术后超早期、早期、短期的评估指标比较。

表2 KAES组与SAU组30 d内死亡与严重并发症情况
手术情况KAES组较SAU组手术耗时更长(t=12.182,P<0.001)、手术失血量更多(t=7.294,P<0.001),但引流管留置时间更短(t=-9.852,P<0.001)(表1)。
手术有效性两组患者术后GCS评分和NIHSS评分均有明显改善。术后超早期KAES组与SAU组患者GCS评分和NIHSS评分差异均无统计学意义(P均>0.05),而KAES组相对SAU组残留血量更少(t=-4.134,P<0.001),血肿清除率更高(Z=-5.150,P<0.001),术后即刻效果更好,此后SAU组RV及HCR水平逐渐追赶上KAES组。术后早期两组患者GCS评分、NIHSS评分、RV以及HCR差异均无统计学意义(P均>0.05)。术后短期KAES组NIHSS评分为14.00[11.00,17.00]分,而SAU组为11.50[7.75,15.25]分,优于前者(Z=-2.125,P=0.034),其他指标包括GCS评分、RV以及HCR差异均无统计学意义(P均>0.05)(表1),KAES术后血肿体积和占位效应立即得到改善,而SAU术后血肿缩小需要数天时间(图1、2)。术后6个月KAES组预后良好(mRS≤3分)50例(79.4%),SAU组46例(85.2%),两组比较差异无统计学意义(χ2=0.669,P=0.413)(表3)。
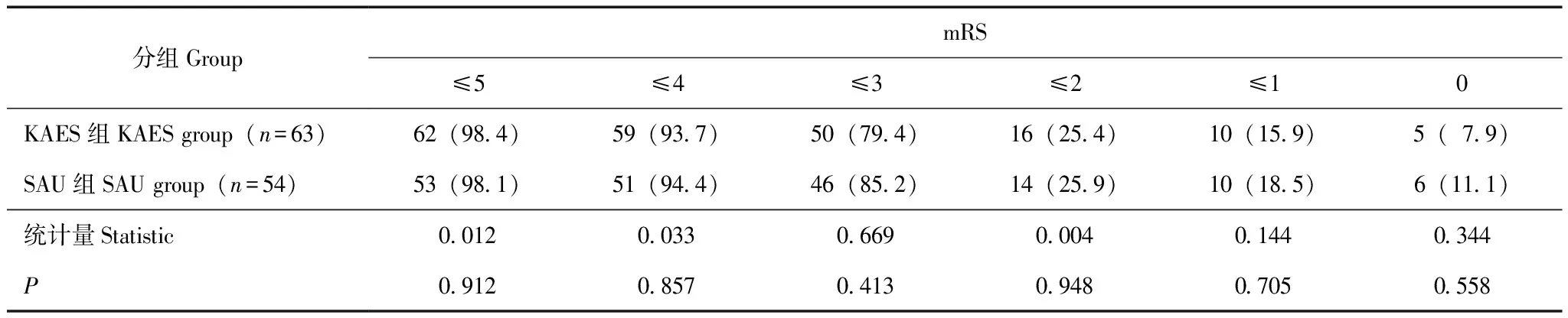
表3 患者施行KAES术和SAU术后6个月mRS评分[n(%)]Table 3 Distribution of 6 months mRS score after KAES and SAU surgery[n(%)]
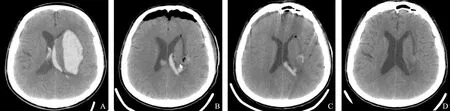
图1 65岁男性患者,采用KAES术式,术前(A)-术后超早期(B)-术后早期(C)-术后短期(D)的头CT表现
讨 论
本研究针对基底节区高血压脑出血的患者,比较KAES术式和SAU术式的手术创伤及术后的近期和远期预后。基底节区高血压脑出血患者占幕上脑出血患者的一半以上,相对于皮层下出血,其患者偏瘫、失语、吞咽困难等严重影响生活自理能力的症状更为严重,脑室铸形的患者因常合并急性梗阻性脑积水形成,术前状态与术后恢复情况与脑实质内出血的患者差异较大,因而不在本研究的考虑之列。在两组患者基线情况一致的前提下,研究显示SAU组的手术时间和失血量均显著低于KAES组,提示SAU术式的操作相对简单且创伤较小。SAU采用逐渐引流的方式,血肿的清除相对缓慢,术后超早期HCR低于KAES组。这一现象与国内外文献报道[13- 14,17]一致。而从术后早期开始,两种术式的HCR便已不再存在差异。
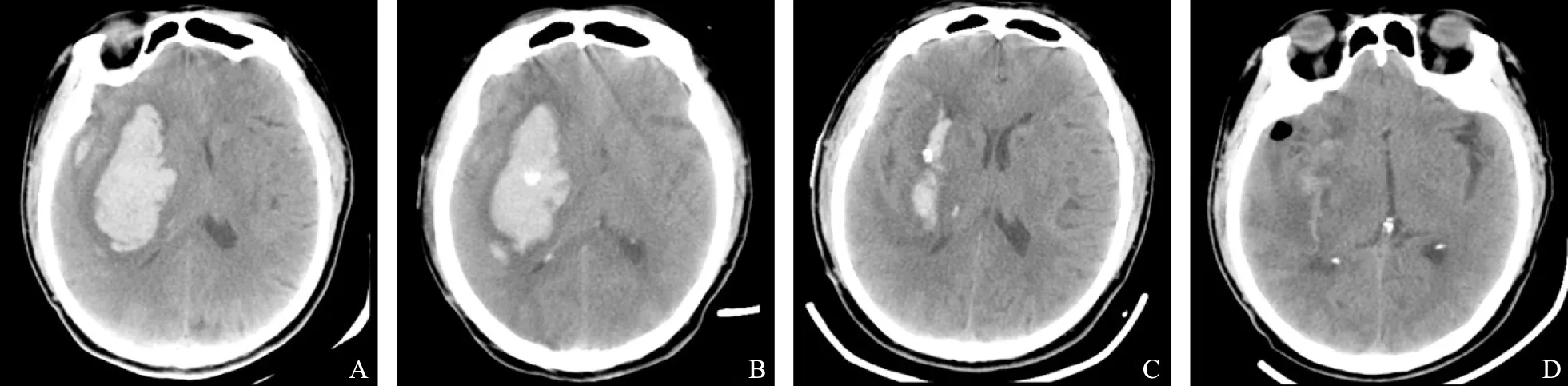
图2 68岁男性患者,采用SAU术式,术前(A)-术后超早期(B)-术后早期(C)-术后短期(D)的头CT表现
术后超早期SAU术式的血肿清除率较低,理论上可能对患者存在不良影响,残留血肿压迫和刺激可能导致周围脑组织水肿、缺血和坏死等一系列病理生理变化,产生继发损害。KAES术式在术后超早期能够达到满意的血肿清除效果[12- 14],这是该术式的重要优势。然而本研究通过神经功能评分对两种术式的效果进行评估,发现两种术式在术后各个时期的GCS评分差异均无统计学意义,而术后短期SAU组的NIHSS评分甚至略优于KAES组,表明在本研究的条件下,SAU的临床效果不亚于KAES。
本研究比较KAES术式和SAU术式的手术创伤及术后的近期和远期预后,在术后近期评估时间上,选取了术后3、7、14 d,此分段是考虑对应脑出血后自然分期:急性期(1~3 d)、亚急性早期(4~7 d)、亚急性晚期(7~14 d),在各个时期内随着红细胞的分解,血肿成分不同,对脑组织的刺激以及脑水肿情况存在差异,脑出血后水肿效应导致患者神经功能恶化,通常发生在病后2 d并持续约2周,血肿体积与水肿的严重程度密切相关[18- 19],残留血肿体积可能与患者预后相关[20],微创手术有助于减轻这种情况[21],因此,比较两组患者在该时间段内血肿残留体积以及对应的神经功能可能有一定的意义。
对于可能影响两种术式的近期和远期预后的因素分析如下:KAES是一种相对高端精细的术式,该术式存在学习曲线,需要有高通量的神经外科中心,有丰富手术经验的术者,方可达到更好的术后疗效。本研究63例KAES手术患者仅有1例出现术后再出血并死亡,再出血率和死亡率相较于我中心前期119例KAES手术的报道[22]相比,均有明显下降。分析本研究与我中心前期研究的差异包括:(1)患者的选择更为慎重,排除脑疝患者,手术时机把握更成熟,研究发现脑出血过早手术的患者颅内再出血率增高[23],其原因是活动性出血并未自行停止,因此本研究患者均在间隔6 h重复CT确定无活动性出血后进行手术;(2)手术及止血技术更成熟,以往活动性出血常采用单极电凝触碰吸引器头止血[16,22],效果不理想,因为硬质通道无法同时容纳观察镜、吸引器及电凝,本研究使用硅胶管连接吸引器置于术腔代替吸引,改善操作空间,在内镜下使用长双极电凝止血,可达到更为确定的止血效果;(3)术后所有患者均使用镇静药物联合静脉降压药物控制血压。
与KAES相比,SAU术式的操作难度和硬件设备要求较低[24],在广大基层医院的神经外科均可开展。术后3 h复查头颅CT明确无新发出血后再开始鞘内用药,国内外研究往往在用药后采用回抽的方式排出溶解的血肿[14,20- 21,25],但是回抽的力量和速度难以把握,笔者考虑患者在出血后颅内压力增高,血块溶解后利用正压引流的方式更为安全,避免回抽过程中因操作不当,引发二次出血,另外回抽时有可能将脑组织吸入引流管中造成引流管堵塞,因此,在SAU组引流过程中不再采用回抽方式,本研究54例患者均无术后再出血现象,该方式在术后超早期血肿清除率为68.6%,与文献报道置管碎吸的方式清除率相当[13],表明正压引流可以达到充分引流的效果。国内外的研究对穿刺置管与内镜血肿清除这两种术式的优劣存在争议[12- 13,15,26],主要体现在穿刺置管术组再出血率、感染率较高,也许回抽或碎吸的方式是影响其预后的原因之一,本研究在引流方式上做了改变,减少了穿刺组患者的并发症,这可能是SAU组预后改善的原因。
国外许多研究鞘内用药选择阿替普酶[20,25]。而本研究所应用的尿激酶经证实在脑出血患者中是一种安全、可靠的纤溶酶,没有神经毒性[27],其与阿替普酶疗效相当,费用更低,适合我国国情[28]。本研究SAU组患者出现1例颅内感染,感染细菌为表皮葡萄球菌,是常见的皮肤定植细菌,考虑为反复鞘内打药的过程中消毒不彻底,操作不当所致,SAU组引流管留置时间明显高于KAES组,而且该手术方式需要多次鞘内用药的操作,感染风险较高,笔者认为手术中引流管预留更长的皮下潜行距离、对操作人员进行培训、术后鞘内打药的过程中严格消毒,并采用无菌纱布包裹给药通道的三通接头,可能对降低感染率有所帮助。
脑出血患者的血肿形态并不规则,特别是经过引流后,血肿形态多变,使用传统的多田公式难以准确测量,不利于纵向观察、横向比较,有文献采用3D-slicer软件对头颅CT的数据资料进行三维重建[9],本研究采用德国BrainLab导航系统配备的iPLAN CRANIAL3.0软件,可以更方便地调用DICOM数据,并达到准确测量脑内血肿体积的目的。本研究显示术后早期GCS评分无差别的情况下,NIHSS评分体现出组间差异,这可能是因为GCS评分无法评测眼球运动、视觉、颜面部麻痹等功能,而对于语言及构音障碍的评估,NIHSS评分更为精细。
本研究为单中心回顾性研究,纳入的病例数较少,在术后30 d、6个月没有进行全部的神经功能(GCS、NIHSS、mRS)和影像学评估,此为研究的不足,也是下一步努力的方向。
综上,本研究显示,对于基底节区高血压脑出血患者,两种微创术式均安全有效,KAES组术后超早期HCR及RV明显占优,随后SAU组HCR和RV水平快速追赶并与KAES组相当,各时期SAU组临床疗效均不亚于KAES。SAU手术方案操作简单、手术耗时短、创伤小,具有较广泛的临床应用价值。

