早期有丝分裂抑制因子1对DNA损伤后人乳头瘤病毒16亚型E7基因介导的DNA重复复制的调控作用
刘亚飞,沈彦军,杨 阳,晁 岚,杨 芳
山东大学齐鲁医院妇产科 不孕不育诊疗中心,济南 250012
人乳头瘤病毒(human papillomavirus,HPV)是一种小型环状DNA病毒,可感染人的皮肤和黏膜并引发一系列病变,如尖锐湿疣、口咽癌、宫颈上皮内瘤变及宫颈癌等[1- 2]。根据其临床致病风险又将HPV分为高危型和低危型两大类,其中HPV 16亚型(HPV- 16)为最常见的高危型HPV之一[3]。E7为宿主细胞被高危型HPV转化至癌变过程中重要的致癌基因之一,尽管其主要生物学功能被认为是通过降解pRb释放E2F转录因子而使细胞周期紊乱引发肿瘤的形成[4- 5],但在其他应激条件下,如DNA损伤后,E7还可以诱导DNA重复复制进而使细胞产生多倍体引发基因组不稳定[6- 7],然而其分子机制尚不明了。本研究试图在稳定表达HPV- 16 E7的细胞中探索早期有丝分裂抑制因子1(early mitotic inhibitor 1,Emi1)与DNA重复复制之间的相互关系,以期进一步了解DNA损伤后HPV- 16 E7引发宿主基因组不稳定性的分子机制。
材料和方法
细胞系构建与培养人视网膜色素上皮细胞系(human retinal pigment epithelium cell line,RPE)1培养于含10% 胎牛血清的1∶1 DMEM-Ham’s F12培养基中。RPE1 E7及RPE1 Vector细胞构建同文献[6],将稳定表达HPV- 16 E7的RPE1 E7细胞作为实验细胞,稳定表达空载体的RPE1 Vector细胞作为对照细胞。
DNA损伤条件的建立及分组使用终浓度为2.5 μg/ml的博来霉素(APExBIO)作用于目的细胞30 min,之后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次并添加新的培养基。分组:实验组:RPE1 E7及RPE1 Vector细胞经博来霉素处理;阴性对照(negative control,NC)组:RPE1 E7及RPE1 Vector细胞不经博来霉素处理,而是用等量的磷酸盐缓冲液代替。
流式细胞术收集细胞后重悬于70 %乙醇中固定过夜,之后用PBS洗涤2次并重悬,使用碘化丙啶(Sigma,PBS中50 μg/ml)进行细胞染色30 min,并在其中添加70 μg/ml核糖核酸酶A(Sigma),最后通过流式细胞仪进行上机分析。有关细胞周期分析的相关实验均独立重复3次及以上。使用FlowJo软件(Tree Star,Ashland,OR)进行数据分析[6]。
免疫印迹在放射免疫沉淀裂解缓冲液(Santa Cruz)中制备总细胞裂解物。通过双辛可宁酸蛋白测定试剂(Invitrogen)测量蛋白浓度。在SDS聚丙烯酰胺凝胶中分离细胞裂解液中的蛋白质,并将其转移到聚偏二氟乙烯膜上。膜与抗Emi1抗体(abcam,ab187144)共同孵育后,再与二抗共同孵育,然后在成像仪上进行成像。辣根过氧化物酶共价相连的山羊抗兔抗体被用作二抗,GAPDH(Santa Cruz)用于指示总蛋白的上样量。关于目的条带的位置,尽管Emi1蛋白的相对分子质量为50 000左右,而经过显色成像后实际观察到的目的条带则位于56 000,且与抗体说明书上显示的条带相一致,因此认为56 000处的条带即为Emi1的目的条带。有关免疫印迹的相关实验均独立重复至少3次。ImageJ(美国国立卫生研究院)用于量化凝胶图像[6],相对灰度值=Emi1条带灰度值/GAPDH内参灰度值。
小干扰RNA实验为进一步明确DNA损伤后Emi1在HPV- 16 E7引起的DNA重复复制中所发挥的作用,设计合成2条独立的Emi1-小干扰RNA(small interfering RNA,siRNA)用来沉默Emi1的表达,以观察相应细胞多倍体产生的改变情况。在转染前1天,将细胞接种到60 mm的培养皿中,使用脂质体2000(Invitrogen)转染试剂,按照其说明书进行操作,siRNA转染细胞终浓度为20 nmol/L。72 h后收集细胞并将其分为两份,一份用来分析细胞周期,方法同“流式细胞术”中所述;另一份用来做免疫印迹分析,方法同“免疫印迹”中所述。实验中用到的2条独立siRNA寡核苷酸序列如下:Emi1-siRNA- 01:5’-GATTGTGATCTCTTATTAA- 3’;Emi1-siRNA- 02:5’-AAGCACUAGAGACCAGUAGAC- 3’;阴性对照siRNA:5’-UUCUCCGAACGUGUCACGUdTdT-3’。有关siRNA干扰的相关实验均独立重复至少3次。

结 果
DNA损伤后HPV- 16 E7引起的细胞周期比例变化在RPE1 E7细胞中,实验组出现显著的DNA重复复制,细胞多倍体比例达(15.57 ± 2.22)%,与对照组相比差异有统计学意义(t=6.397,P=0.0031);而在RPE1 Vector细胞中,实验组与对照组的细胞多倍体比例差异无统计学意义(t=0.646,P=0.5534)(图1A、1B)。在RPE1 E7细胞中,实验组出现显著的G2阻滞,G2期所占比例达(45.07 ± 6.93)%,与对照组相比差异有统计学意义(t=3.864,P=0.0181);而在RPE1 Vector细胞中,实验组与对照组的G2期所占比例差异无统计学意义(t=0.422,P=0.6950)(图1 A、1C)。
DNA损伤后HPV- 16 E7对Emi1蛋白表达的影响实验组RPE1 E7细胞中Emi1的蛋白表达水平显著高于RPE1 Vector,差异有统计学意义(t=8.241,P=0.0012);而在阴性对照组,RPE1 E7及RPE1 Vector细胞中Emi1的蛋白表达水平差异无统计学意义(t=1.448,P=0.2212)。RPE1 Vector细胞经博来霉素处理后,Emi1的蛋白表达水平显著降低,差异有统计学意义(t=5.549,P=0.0052);而RPE1 E7细胞经博来霉素处理后,Emi1的蛋白表达水平无变化(图2)。
Emi1表达沉默对DNA损伤后HPV- 16 E7介导的DNA重复复制的影响在经博来霉素处理的RPE1 E7细胞中应用两条独立的小干扰RNA(Emi1-siRNA- 01和Emi1-siRNA- 02)沉默Emi1的蛋白表达后,可见DNA重复复制的比例显著降低,si-Emi1- 01和si-Emi1- 02细胞多倍体所占比例分别为(3.94±0.66)%和(2.94±0.49)%,与转染阴性小干扰RNA对照组(siCon)相比,差异有统计学意义(t=2.916,P=0.0434;t=3.452,P=0.0260)(图3)。
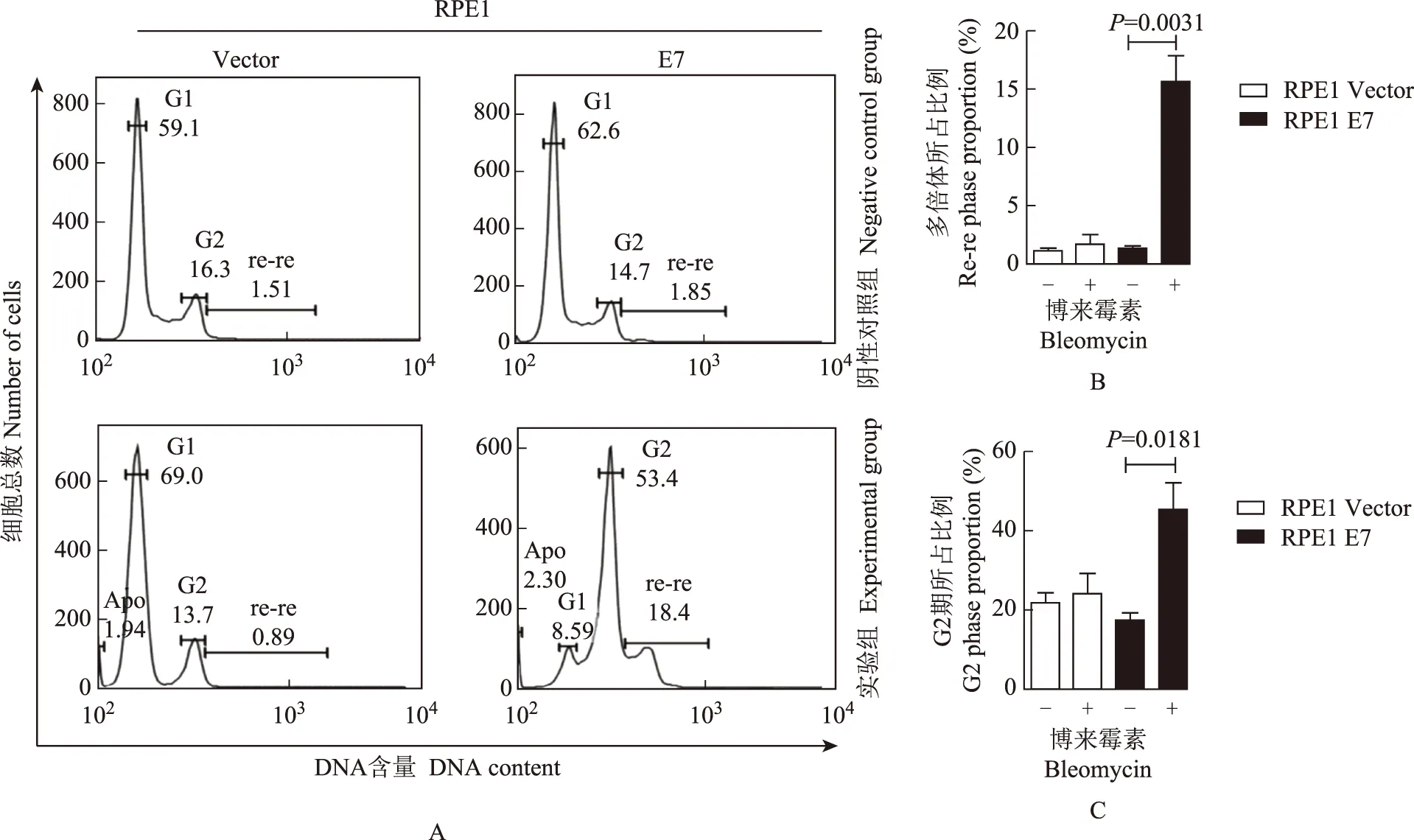
RPE1:人视网膜色素上皮细胞系;G1、G2:细胞周期的两个阶段;re-re:DNA重复复制,是DNA重复复制后产生的多倍体检测区域;Apo:凋亡,坐标最左侧为细胞凋亡的检测区域

Emi1:早期有丝分裂抑制因子1;Mr:相对分子质量
讨 论
宫颈癌是目前国内外常见的妇女恶性肿瘤,严重威胁女性健康[8- 9],持续感染高危型HPV是引发女性宫颈癌的主要致病因素[10]。细胞癌变过程中的一个重要特征是基因组的不稳定性[11- 12],感染HPV后病毒基因随宿主基因复制发生扩增和重排,导致宿主细胞出现多种染色体数目及结构变异,如染色体多倍体、缺失、倒位和染色体易位等[13- 14],其中染色体多倍体是基因组不稳定性的一个重要方面[15]。多倍体的产生是由于细胞周期调控紊乱导致在一次细胞周期中进行了两次及以上的DNA复制[16]。
2013年,有研究显示细胞DNA损伤后HPV- 16 E7可引起DNA重复复制,当时认为HPV- 16 E7是通过影响Cdt1发挥作用[6],之后又发现与Cdc6蛋白也相关[17],但Cdt1与Cdc6均为进入S期后直接参与触发DNA复制起始许可的蛋白分子[18],忽略了其上游Emi1及后期促进复合物(anaphase promoting complex/cyclosome,APC/CCDH1)的信号积累,即Cdt1与Cdc6可能只是这一过程的中间执行者,而非“始作俑者”。
正常情况下,细胞在S期复制DNA之前必须先激活细胞周期依赖蛋白激酶,诱导E2F转录程序,并灭活APC/C[19]。Emi1是早期有丝分裂抑制物,哺乳动物细胞周期的起始是由Emi1和CDK2的增高单向介导APC/CCDH1快速失活,使G1/S转变得以单向进行[20- 21]。并且在G1期,Emi1处于低水平,而APC/CCDH1处于高水平;而S期和G2期Emi1处于高水平,APC/CCDH1处于低水平[22- 23]。因此,如果Emi1表达持续增高,则APC/CCDH1活性就被抑制,使细胞在S期重复触发DNA复制起始,引发DNA重复复制。
本研究显示经博来霉素处理诱导DNA损伤后,HPV- 16 E7可介导DNA重复复制,显著促进细胞多倍体比例的形成。另外,在DNA损伤后,Emi1的蛋白表达水平在HPV- 16 E7的作用下表现出了与对照细胞截然不同的状态,即不仅不被降解且与DNA未损伤组表达几乎无差异,提示Emi1在其中可能发挥着一定作用。为了进一步探索Emi1在其中发挥的作用,利用小干扰RNA沉默Emi1的表达后发现,HPV- 16 E7导致的细胞多倍体比例显著降低,表明Emi1确实参与了DNA损伤后HPV- 16 E7导致的DNA重复复制这一过程,且在其中发挥积极作用。
另一方面,DNA损伤后启动DNA修复、细胞周期检查点信号传递和细胞周期进程间的精确调控,从而保证仅在DNA修复完成后才可再次进入细胞周期。研究表明Emi1在G2期DNA损伤检查点起着至关重要的作用,可维持G2检查点的可逆性,从而通过留出充足的时间进行DNA修复和随后的检查点恢复降低细胞对DNA损伤的敏感性[24]。HPV- 16 E7在DNA损伤后通过促进Emi1的高表达使细胞出现G2阻滞,其目的可能是为了进一步修复DNA。然而这种修复也可能是Emi1导致的后复制修复,即需要在S期的复制过程中才能进行的修复[25]。因此,DNA损伤后HPV- 16 E7导致的DNA重复复制也可能是Emi1介导的新一轮DNA修复过程,当然这部分仍然需要进一步的深入研究。另外,DNA损伤后,RPE1 E7及RPE1 Vector细胞均未发生显著凋亡且两组之间的差异无统计学意义,表明DNA修复起到了一定的作用。

siRNA:小干扰RNA;NC:未转染siRNA的阴性对照组;siCon:转染阴性siRNA的对照组;si-Emi1- 01:转染Emi1-siRNA- 01的实验组;si-Emi1- 02:转染Emi1-siRNA- 02的实验组
综上,本研究在再次验证DNA损伤后HPV- 16 E7能够引发DNA重复复制的基础上,进一步探索了Emi1在其中发挥的作用,发现Emi1的高表达可显著促进这一进程,这也为深入了解HPV引发宿主基因组不稳定性的分子机制奠定了一定的基础。

