超微血管三维立体成像对乳腺癌的诊断价值
贾 莉,朱文龙,王 聪
(1.武警辽宁总队医院 软伤科,辽宁 沈阳 110000; 2. 武警辽宁总队医院 内二科,辽宁 沈阳110000;3.大连医科大学附属第一医院 超声科,辽宁 大连116011)
乳腺癌是常见的恶性疾病,据预测每年超过100万妇女被诊断为乳腺癌,有40多万人死于乳腺癌[1]。早期发现乳腺癌并及时治疗,5年相对生存率仍保持在80%以上[2]。肿瘤内血管生成是恶性肿瘤生长增殖的前提,恶性肿瘤微血管无论在形态学方面,还是血流动力学方面,都与正常血管乃至良性肿瘤的血管有所不同,在临床可见的病灶出现前,肿瘤的新生血管已经发生[3]。因此,肿瘤新生血管的形态和分布对于鉴别其性质有重要意义[4]。有研究表明二维超微血管成像(superb microvascular imaging,SMI)技术对乳腺癌的诊断具有一定价值[5-6]。超微血管三维立体成像(smart three-dimensional superb microvascular imaging,Smart 3D SMI)是对二维的超微血管成像进行重建,立体观察肿瘤血管的形态。本研究拟利用Smart 3D SMI技术探查乳腺肿物内血管形态,评价其对乳腺癌的诊断价值。
1 资料与方法
1.1 研究对象
回顾性分析2019年2月至2020年4月于大连医科大学附属第一医院就诊的乳腺肿物患者106例(共114个肿物)。患者均为女性,年龄15~76岁,平均(48±9.2)岁,肿物最大径均值(22.41±7.86) mm。所有患者均行Smart 3D SMI检查,检查前均未行放化疗,肿物均经病理确诊。
114个乳腺肿物中良性肿物60个,其中纤维腺瘤43个,导管内乳头状瘤10个,腺病5个,慢性炎症2个;乳腺癌肿54个,其中浸润性导管癌31个,浸润性乳头状癌9个,导管原位癌6个,小叶原位癌5个,黏液样癌3个。
1.2 仪器与方法
采用Canon Aplioi900 超声诊断仪,探头频率 10~18 MHz,配备Smart 3D SMI。患者仰卧位,暴露胸部,先用常规超声观察病灶,采用 SMI 显像技术观察血流时,轻轻将探头置于体表,避免按压,取样框的大小应尽量包含肿块及其周边1 cm范围内的乳腺组织,适当调整彩色增益调及标尺,观察肿块内部及周边血流信号,启动Smart 3D SMI,获得并储存三维重建图像。
1.3 图像分析标准
乳腺肿物血管形态分为5种类型[7]:无血管型,病灶中没有见到明显的血流信号;线型,病灶中可见1~2根细线状血流信号;树枝型,病灶中可观察到血管类似树枝样分支,管径较为均匀;残根型,病灶中血管走行紊乱,周围能够看到2条以下的血管,增粗扭曲排列;蟹足型,病灶周围可观察到2根以上的较粗血管,呈放射状,或者微小毛刺状血管。
1.4 统计学方法
采用SPSS 20.0统计软件分析数据,计数资料采用卡方检验,计算Smart 3D SMI诊断乳腺肿物的敏感度、特异度、阳性及阴性预测值,P<0.05为差异有统计学意义。
2 结 果
60个乳腺良性肿物Smart 3D SMI显示血管形态以线型、树枝型(图1)和无血管型为主,分别占40.0%、26.6%和23.3%。54个乳腺癌肿血管形态以残根型(图2)和蟹足型(图3)为主,分别占35.2%、29.6%。乳腺良、恶性肿物的血管形态分布差异有统计学意义(χ2=38.78,P<0.01)。见表1。

图1 患者,23岁,右侧乳腺纤维腺瘤,血流形态呈树枝型
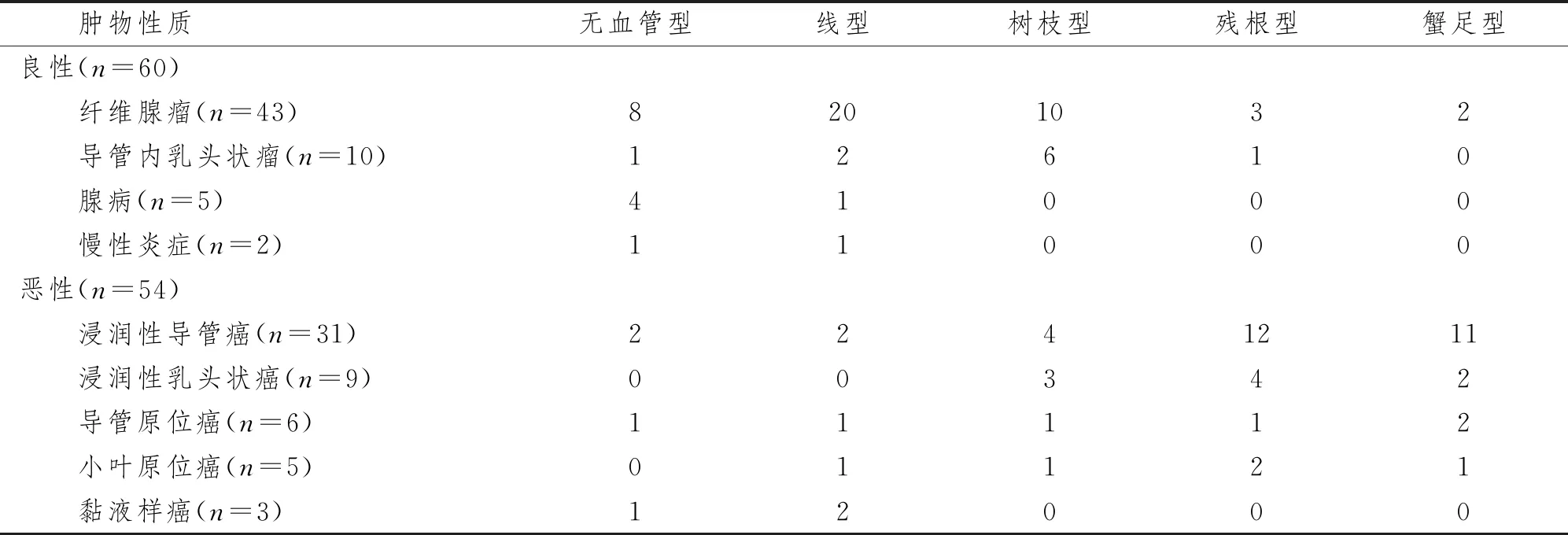
表1 Smart 3D SMI评价乳腺肿物血管形态结果

图2 患者,54岁,右侧乳腺浸润性导管癌,血流形态呈残根型Fig 2 A 54-year-old patient, invasive ductal carcinoma of the right breast, residual root blood flow pattern
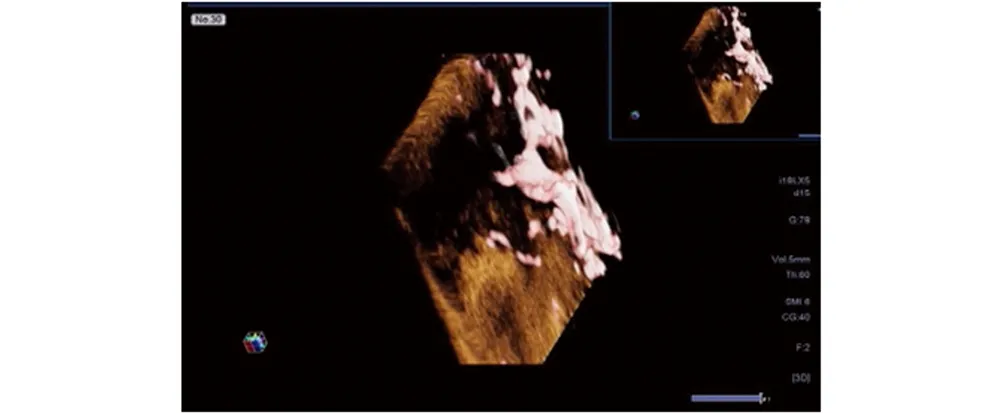
图3 患者,49岁,左侧乳腺浸润性导管癌,血流形态呈蟹足型Fig 3 A 49-years-old patient, infiltrative ductal carcinoma of the left breast, crab foot blood flow pattern
以无血管型、线型和树枝型判断为良性,残根型和蟹足型判断为恶性作为诊断标准,Smart 3D SMI诊断乳腺癌的敏感度、特异度、阳性预测值、阴性预测值分别为64.8%、90.0%、85.4%、74.0%。见表2。

表2 Smart 3D SMI诊断乳腺癌与病理结果对比
3 讨 论
随着高质量超声诊断仪的不断使用,乳腺肿物的发现率逐渐增加[8]。肿瘤血供决定肿瘤的生长,随着肿瘤生长,血管会延伸较多分支,形成大量微血管,向周边浸润摄取大量养分以供肿物生存,同时发生扩散并远处转移[9]。肿瘤的血管形态和分布特征与肿瘤的性质密切相关,是鉴别肿瘤性质的重要依据[4]。普通彩色多普勒超声通常用于检测肿瘤血流,但是对于低速血流显示欠佳[10]。超声造影检查(contrast-enhanced ultrasound, CEUS)可以检测肿瘤微血管,并有助于描述乳腺肿瘤微血管构筑,但是费用较高,是一种有创检查,部分患者会出现造影剂过敏症状[11]。SMI作为一种超声新技术,能够快速、便捷、无创地检测肿物内血管,观察血流灌注情况[8]。二维图像多采用Adler法从某个平面观察、评估肿瘤血供,Smart 3D SMI从二维升级到三维空间,更直观、真实地展现了微血流的空间构象。
瘤体的生长具有血管依赖性,随着肿瘤细胞数目的增多以及瘤体的增大,必须依赖肿瘤新生血管的形成[12]。实体肿瘤生长历经血管前期和血管期。在血管前期,肿瘤细胞主要由原有血管获取营养,生长较为缓慢,直径一般不超过2 mm。进入血管期,肿瘤体积增大,大量新生微血管产生,营养供应方式将从扩散转变成灌注,血管生成因子等因素的刺激也相应增多,生长迅速,继而发生扩散以及转移。肿瘤新生微血管管壁菲薄,缺乏弹性,分支较多,分布紊乱,致使肿瘤内部的血流量明显增大,肿瘤内部血管越丰富,其恶性程度越高,转移能力及侵袭性越强[13]。本研究运用Smart 3D SMI技术对114个乳腺肿物血管形态进行检测,并与病理结果对照。研究表明Smart 3D SMI能够很好地显示出乳腺肿物的三维形态学特征,良性肿物血管形态以线型、树枝型和无血管型为主,乳腺癌血管形态以残根型和蟹足型为主;以无血管型、线型和树枝型判断为良性,残根型和蟹足型判断为恶性作为诊断标准,Smart 3D SMI诊断乳腺癌的敏感度及特异度分别为63.4%及90.0%。本研究良性组血管形态中出现残根型和蟹足型,多为乳腺纤维腺瘤,可能其微血管生长方式有类似乳腺癌血供的特征;恶性组中出现线型、树枝型和无血管型,多为浸润性导管癌和黏液样癌,可能由于肿瘤体积较小,新生血管尚未形成,或是肿物本身为乏血供并伴液化。
虽然Smart 3D SMI技术对于乳腺癌具有较高的诊断作用,但是每种影像学检查都有其优缺点,单独一种检查方法不足以对疾病做出准确诊断。SMI容易受到病灶钙化、液化影响,且容易出现噪音干扰。临床诊断中仅仅依靠血流信息很难对肿物定性,因此SMI技术还不能取代常规超声检查,只能作为一种补充手段。本研究再检查过程中发现,稳定、轻压探头对微血管的显示很重要,钙化、液化也会对血流图像形成干扰,应多角度扫查以获得最佳图像。同时本研究样本量相对较小,仍需继续研究以完善目前结果。

