UiO-66-NH2/氧化石墨烯吸附水中镍离子性能研究
刘康乐 彭思伟 史 超 王子杰 罗 程 汤 昱 林子增 王 郑
(南京林业大学 土木工程学院,南京 210037)
近年来,我国工业发展迅速,产生了大量含有重金属离子的工业废水,给地球环境带来了很大压力[1]。镍离子便是工业废水中一种非常常见的重金属离子,最近科学实验证明, 虽然镍盐或金属镍的经口毒性较小, 但一些镍的化合物, 如镍尘等都被认为是致癌物质,镍被列为39类致癌物质之一[2]。电镀废水中镍离子浓度可达几十到几百mg/L,远远超出了GB21900-2008《电镀污染物排放标准》中规定的0.5 mg/L。
水中镍离子的去除方法主要有化学沉淀、蒸发浓缩、电化学处理、吸附等方法,而吸附法因为成本低、去除效率高、可回收利用等优势被应用在各个水处理领域[3-4]。最近在多孔吸附材料领域兴起了一种名为金属有机框架的材料。金属有机框架(MOFs)材料,也称多孔配位聚合物(PCPs),是一类新兴的非常有前景的结晶微孔材料[5-6]。对比其他常规吸附剂,MOFs具有孔隙率高且孔道大小可调、比表面积大、有特殊的金属中心以及结构多样等优点[7]。
UiO-66是一种典型的含锆MOFs材料,用氨基取代H2BDC合成的UiO-66-NH2与UiO-66具有相同晶体类型和拓扑结构且在特定方面有着更优秀的性能。然而尽管UiO-66-NH2中的孔隙度非常高,但其大量的孔隙空间仍未得到完全利用。为了提高孔隙的利用率,通常将MOFs材料与碳纳米管、氧化石墨烯、活性炭[8]、金属等掺杂形成复合材料,该方法一方面有效调节了孔结构和孔径,另一方面层状材料的含氧基团与金属中心配位,使其吸附于MOFs的微晶边缘,在晶体结构中形成孔壁,进一步提高吸附容量[9]。
在上述复合材料中,氧化石墨烯(GO)由于特殊的分层结构受到了广泛关注,它表面连接有丰富的羟基、羧基、环氧基和羰基等活性基团,具有良好的稳定性[8]。UiO-66-NH2材料复合氧化石墨烯材料在各个领域均有良好的应用前景,但是尚没有用这种复合材料对水中镍离子进行去除的研究。本文用热溶剂法合成UiO-66-NH2/氧化石墨烯(以下均以UiO-66-NH2/GO表示)材料,用FT-IR、SEM及XRD法对其进行表征,探究时间、投加量、温度、初始溶液浓度以及pH对镍离子吸附效果的影响。
1 材料与方法
1.1 材料及仪器
1.1.1 实验材料
四氯化锆(ZrCl4),N,N-二甲基甲酰胺(DMF),H2BDC-NH2,氧化石墨烯,甲醇(CH3OH),柠檬酸铵,镍粉,硝酸溶液,碘化钾,碘,Na2-EDTA,丁二酮肟。
1.1.2 实验仪器
752N紫外可见光分光光度计;0.01级pH计;FA2004B型电子天平;ZD-85恒温振荡器;KS-600D型超声波清洗机;RM-220型超纯水机;GZX-9140MBE电热鼓风干燥箱;数显电子恒温水浴锅;Quanta200环境扫描电子显微镜;JW-1032低速离心机;Thermo Nicolet iS5傅立叶变换红外光谱仪。
1.1.3 UiO-66-NH2/GO材料的制备
(1)取ZrCl4(0.772 g)+H2BDC-NH2(0.556 g)总重量1%的GO,倒入内衬中,加入80 mL DMF ,使用超声清洗机振动2~5 h使其充分混合。
(2)将0.772 g(3.34 mmol)的ZrCl4、0.556 g(3.34 mmol)的H2BDC-NH2加入混合,将混合物在120 ℃下在聚四氯乙烯内衬里的高压釜中加热24 h。
(3)冷却至室温后,用DMF和无水甲醇各洗涤3次,将其置于低速离心机中调节速度为3 000 r/min,时间为3 min,离心后得到灰白色粉末。将灰白色粉末用甲醇冲洗重新倒入高压釜的内衬中并在100℃下加热12 h。
(4)冷却至室温后,用无水甲醇再次洗涤3次,重复以上操作,将粉末重新用甲醇冲洗倒入内衬中放在干燥箱中在80 ℃下干燥,当内衬中的甲醇完全蒸干时,真空干燥12 h,此时得到的粉末即为UiO-66-NH2/GO。
1.2 实验方法
1.2.1 水样的配制
称取镍0.100 0 g,溶解于10 ml(1+1)硝酸溶液中,加热蒸发近干,加1%稀硝酸溶解并在容量瓶中定容至1 000 ml,此时镍离子的浓度为100 mg/L[10]。以此溶液作为模拟废水进行研究。
1.2.2 分析方法
采用丁二酮肟光度法对镍离子浓度进行测定[10],其最低及最高检测限分别为0.1 mg/L和4 mg/L。绘制出的吸光度浓度关系如图1所示,拟合方程为A=0.09225C-0.0063。其吸附量通过公式(1)进行计算。
(1)
式中:V0为溶液的体积,L;ω为吸附剂的质量,g;C0为溶液初始浓度,mg/L;C为吸附剂吸附饱和后溶液的浓度,mg/L;q为吸附剂的吸附量,mg/g。
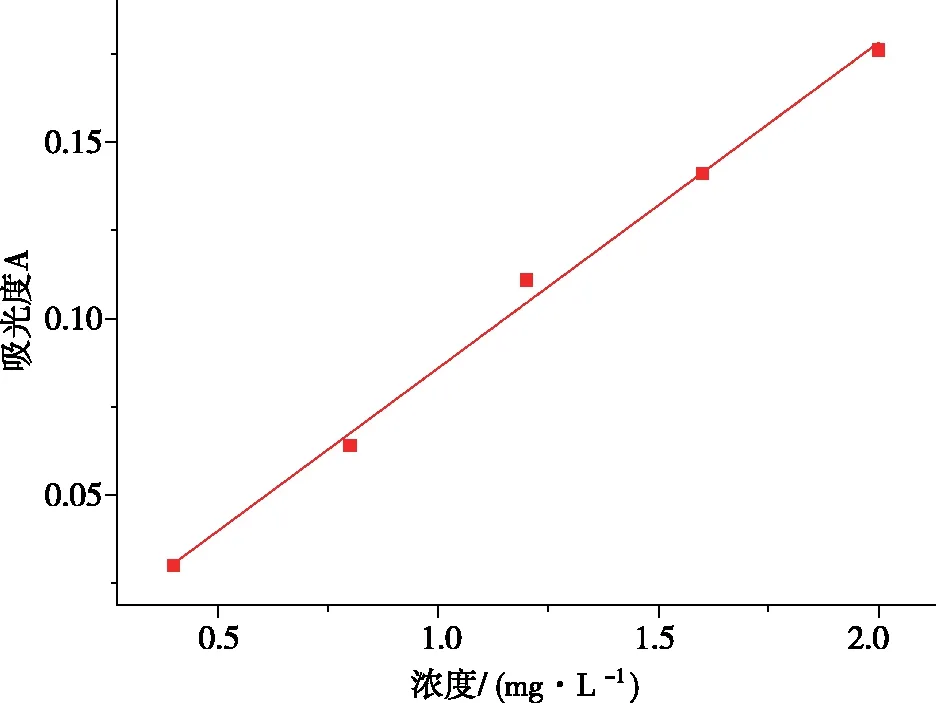
图1 镍标准曲线
1.2.3 时间对吸附效果的影响实验
取0.04 g UiO-66-NH2/GO于100 mL锥形瓶中,向其中加入40 mL模拟废水,调节溶液至中性附近,将其置于恒温振荡器中,调节温度至30℃,速度为100 r/min,分别在振荡0.5、1、1.5、2、3、4 h后取样测出剩余浓度并计算吸附量。
1.2.4 UiO-66-NH2/GO投加量对吸附效果的影响实验
分别取0.02、0.04、0.06、0.08 g的UiO-66-NH2/GO于100 mL锥形瓶中,向锥形瓶中加入20 mL模拟废水,重复1.2.3操作并计算吸附量。
1.2.5 初始pH对吸附效果的影响实验
分别取0.02 g UiO-66-NH2/GO于100 mL锥形瓶中,共取4组,分别向其中加入20 mL模拟废水,用氢氧化钠溶液和稀硝酸调节pH,分别调至8、7、6、5这4个pH范围附近,重复以上操作,得到该pH下对应的吸附量。
1.2.6 温度对吸附效果的影响实验
取3份0.02 g UiO-66-NH2/GO于3个100 mL锥形瓶中,向其中加入20 mL模拟废水,调节溶液pH至中性附近,将3 个锥形瓶分别放入三个恒温振荡器中,以10℃为温度梯度,设置30、40、50℃三个温度,振荡器速度均为100 r/min,振荡3 h后取样测出剩余浓度并计算吸附量。
1.2.7 镍溶液初始浓度对吸附效果影响实验(吸附等温线)
分别配制6组不同浓度的镍溶液20 mL于100 mL锥形瓶中,调节pH至中性附近,向其中加入0.02 g UiO-66-NH2/GO,将锥形瓶放入恒温振荡器中,调节温度至40℃,速度为100 r/min,振荡3 h后取样测出剩余浓度并计算吸附量。
2 结果与讨论
2.1 UiO-66-NH2/GO的表征
2.1.1 FT-IR法表征分析
UiO-66-NH2/GO的红外谱图如图2所示。
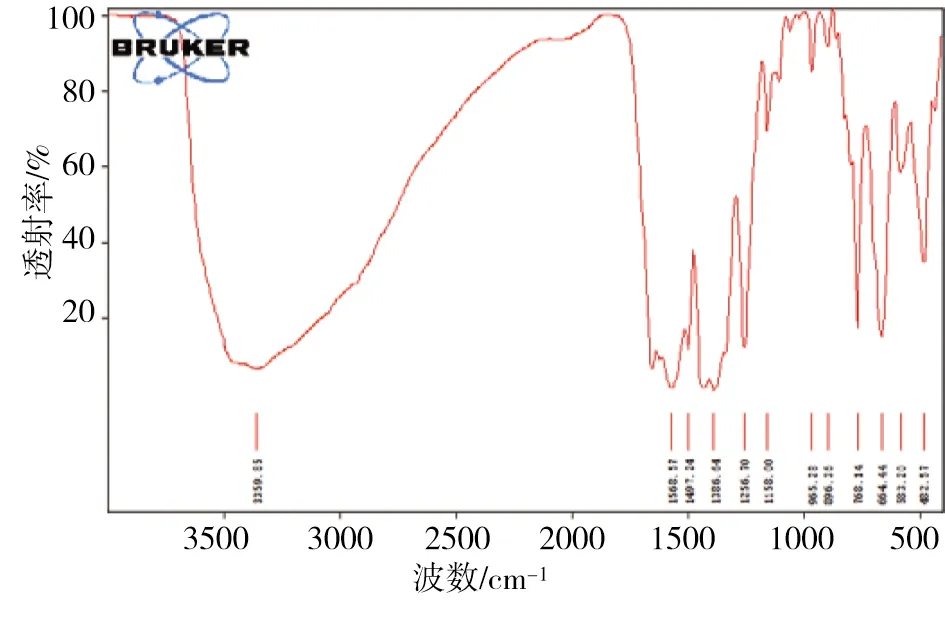
图2 UiO-66-NH2/GO的红外谱图
在3359.85 cm-1处出现吸收峰说明材料中存在-NH2,这意味着在材料的制备中-NH2与材料发生了配位反应。在1665 cm-1处没有出现峰值说明经过甲醇洗涤,DMF已经被洗净。在1568.57 cm-1和1386.64 cm-1处的峰值是来自H2BDC-NH2配体羧基中COO-的吸收峰。在1497.24 cm-1处的小峰则是来自苯环中的碳碳双键。最后在768.14 cm-1处的峰值与Zr-(μ3)-O键一致,这也说明了材料中Zr离子的存在[8,11-13]。
2.1.2 SEM法表征分析
UiO-66-NH2/GO的扫描电镜图如图3所示。其晶体粒径在100 nm左右,晶体形态不规则,立方形状不明显,这可能是由于氧化石墨烯层中的氧基团与UiO-66-NH2中Zr离子中心进行配位,阻止了UiO-66-NH2微晶的聚集[8]。这也说明了氧化石墨烯负载成功。

图3 UiO-66-NH2/GO的扫描电镜图
2.1.3 XRD法表征分析
UiO-66-NH2/GO的XRD图如图4所示,其衍射峰位置分别位于7.34°、8.48°、25.34°,与文献报道位置一致[14-15],其包含了UiO-66-NH2和GO两种材料的特征,这表明在不改变MOFs结构的情况下,氧化石墨烯成功负载在UiO-66-NH2上[16]。
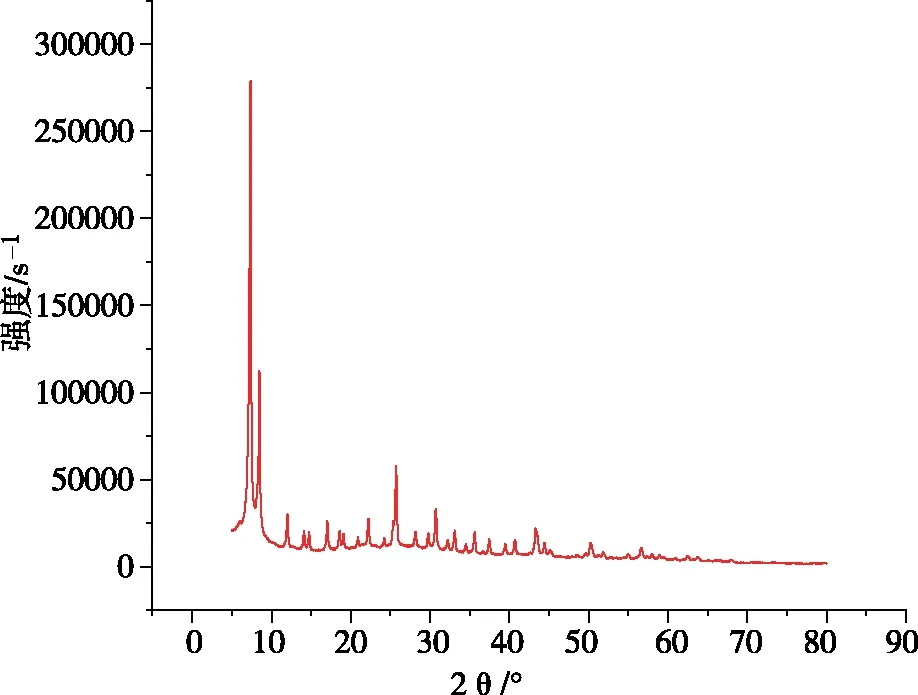
图4 UiO-66-NH2/GO的X射线衍射图
2.2 实验结果分析与讨论
2.2.1 吸附时间对吸附效果的影响
图5为吸附量随时间的变化图,从图中易知,在50 min前,在UiO-66-NH2/GO表面存在着大量的吸附点位,吸附速率较快;在吸附了120 min后吸附速率下降,此时,固体吸附剂与液体废水中浓度差减小,吸附驱动力减小;180 min后吸附量趋于饱和,此时吸附剂的吸附速率与解吸速率大致相同,几乎达到了动态平衡,吸附缓慢进行[17]。
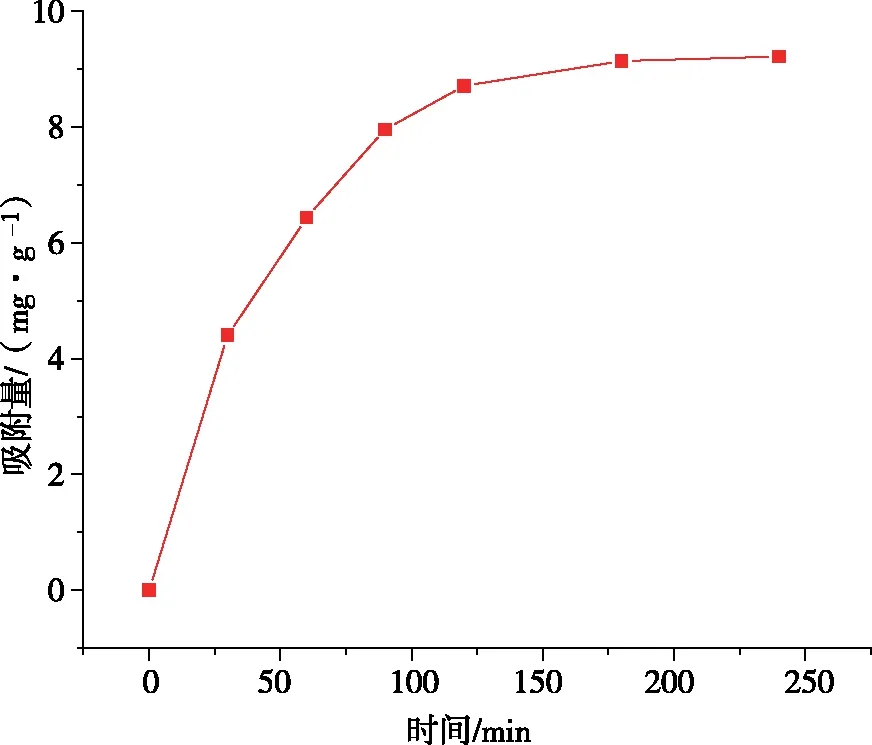
图5 吸附量随时间变化图
动力学方程是衡量一个吸附过程的重要指标,分别用准一级动力学(公式(2))和准二级动力学(公式(3))对实验数据进行拟合,结果见图6、7及表1。
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中:qe为饱和时UiO-66-NH2/GO的吸附量,mg·g-1;qt为t时刻UiO-66-NH2/GO的吸附量,mg/g;k1和k2为准一级和准二级动力学模型速率常数,单位分别为min-1、g/(mg·min);t为吸附时间,min[18]。
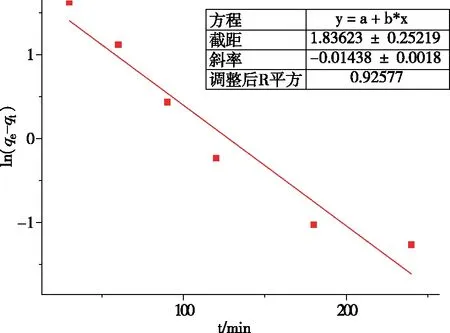
图6 准一级动力学拟合
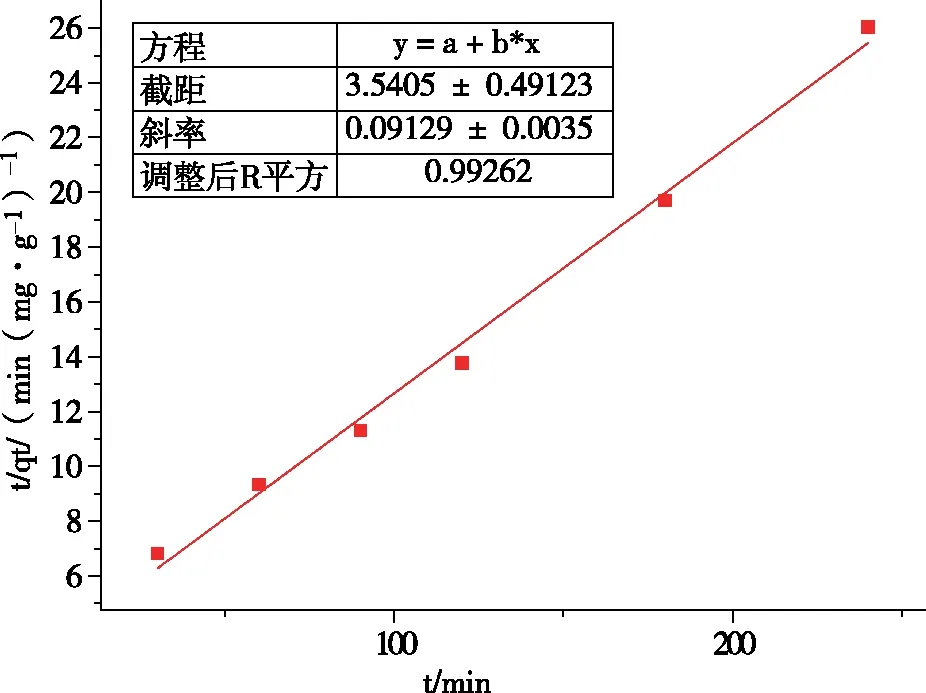
图7 准二级动力学拟合

表1 吸附动力学拟合参数对比
通过图6、图7和表1可知,UiO-66-NH2/GO吸附二价镍离子的过程更符合准二级动力学模型,其R2为0.992 62,高于准一级动力学的0.925 77,这说明此过程受化学吸附机理的控制,吸附速率由UiO-66-NH2/GO表面未被占有的吸附点位数目的平方值决定[17]。同时,准二级动力学模型所预测的10.954 mg/g的吸附量更接近实验所得数据,这更加证明了上述结论。
2.2.2 UiO-66-NH2/GO投加量对吸附效果的影响
图8为UiO-66-NH2/GO投加量与去除浓度和单位吸附量的折线图,随着UiO-66-NH2/GO投加量的增加,镍离子浓度不断被去除,但是单位质量吸附剂的吸附量反而在降低。这是因为随着UiO-66-NH2/GO投加量的增加,吸附点位增加,二价镍离子持续被吸附,去除率升高,但是当投加量达到一定值时,MOFs颗粒在溶液中发生团聚,减少了吸附剂的总表面积,增加了二价镍离子在吸附剂中的扩散路径,故而单位质量UiO-66-NH2/GO的吸附量不升反降[13]。

图8 吸附剂投加量与去除浓度和吸附量折线图
2.2.3 初始pH对吸附效果的影响
图9为pH与吸附量折线图。随着pH从5增大到8,吸附剂的吸附量也在不断增加,从3.399 mg/g增加至28.926 mg/g。这是因为:低pH不利于MOFs结构的稳定[19],而且pH低时氢离子浓度大,氢离子与镍离子在吸附剂吸附点位上产生竞争,这也不利于吸附剂对水体中二价镍离子的吸附[20];当pH增加时,溶液中的氢氧根逐渐增加,依附于吸附剂表面增加了吸附剂对镍离子的吸附作用,导致吸附容量的增加。
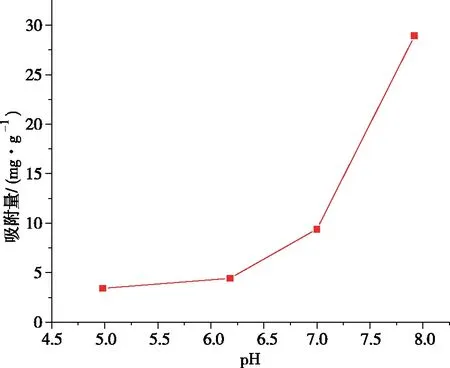
图9 溶液初始pH与吸附量折线图
2.2.4 温度对吸附效果的影响
由图10可知,温度升高,UiO-66-NH2/GO的吸附量增加,在50 ℃时最大,为14.292 mg/g。在吸附过程中,化学吸附一般是吸热反应,而物理吸附一般是放热反应,在此实验中,随着温度升高,UiO-66-NH2/GO的吸附量不断增加,这说明此反应为吸热反应,UiO-66-NH2/GO吸附镍离子的过程为化学吸附。
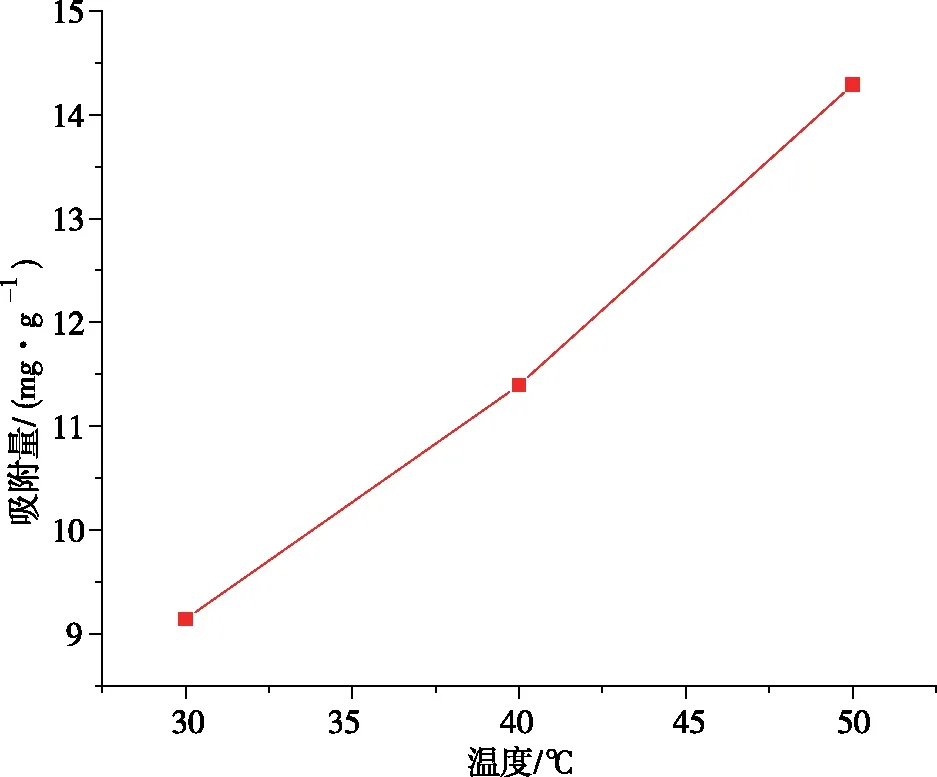
图10 温度与吸附量折线图
采用热力学模型[21]拟合实验数据,热力学方程见式4-6。
(4)
△G=RTlnKc
(5)
(6)
式中:Kc为固液分配系数,mg/L;C0为溶液中初始镍离子浓度,mg/L;Ce为吸附饱和时溶液中镍离子浓度,mg/L;V为溶液体积,mL;m为吸附剂质量,g;T为吸附温度,K;R为通用气体常数(R=8.314 J/(mol·K));△S和△H可以从拟合曲线的截距和斜率中计算得到数值。
以1/T为横坐标、lnKc为纵坐标对实验数据进行拟合得到图11,通过计算得到表2。△G<0说明该吸附过程为自发过程,随着温度的升高,△G<0仍成立且其绝对值越大,越有利于吸附的进行,这与随着温度升高,UiO-66-NH2/GO吸附量逐渐增大的实验数据相吻合。△H>0说明此吸附为吸热反应,△S>0说明在吸附时,固液接触面处无序度增大[8],这些均与实验结果相吻合。

表2 UiO-66-NH2/GO吸附过程热力学参数
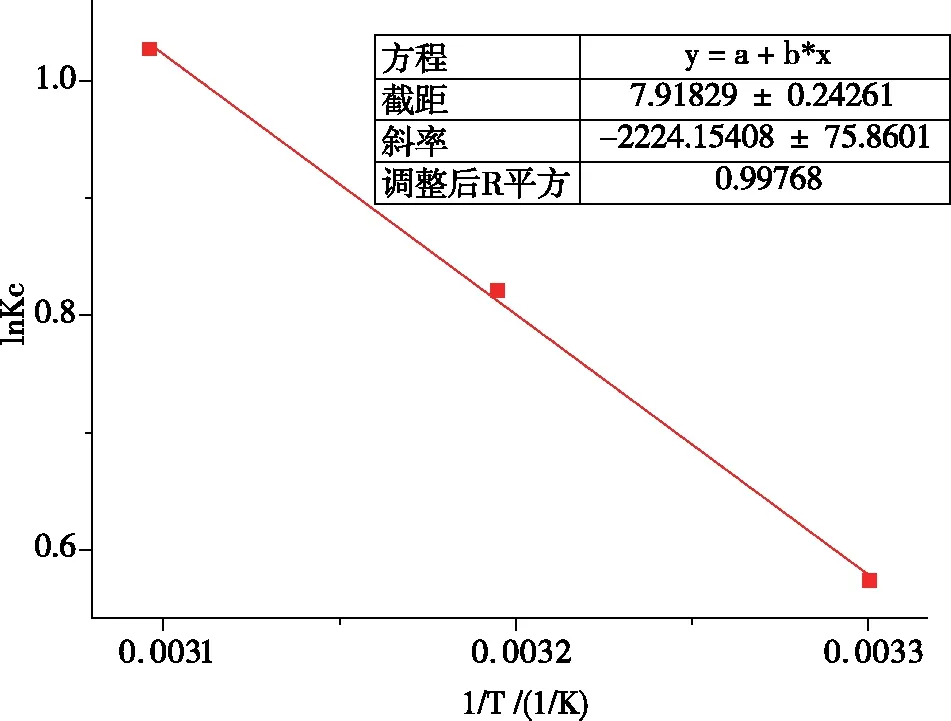
图11 热力学方程拟合
2.2.5 吸附等温线
等温吸附模型为吸附过程中最重要的模型之一[22],常用的有Langmuir(公式(7))和 Freundlich(公式(8))模型。
(7)
(8)
式中:qm为最大吸附量,mg/g;KL为Langmuir常数,L/m;ρe为吸附平衡时溶液中剩余镍离子的浓度,mg/L;qe为吸附剂的平衡吸附量,mg/L;KF为Freundlich常数,无量纲;n为常数,无量纲,1/n<1时吸附容易发生。
图12和图13分别为Langmuir和Freundlich对实验数据的拟合。两种模型都能很好地拟合UiO-66-NH2/GO吸附镍离子的吸附等温线,但是由图中数据易知,Langmuir等温模型比Freundlich等温模型更符合UiO-66-NH2/GO吸附镍离子的吸附过程,其R2为0.9835,这说明UiO-66-NH2/GO吸附镍离子属于单分子层吸附行为[23]。另外,Freundlich等温方程式中的1/n=0.4939<1,这说明此吸附容易发生。
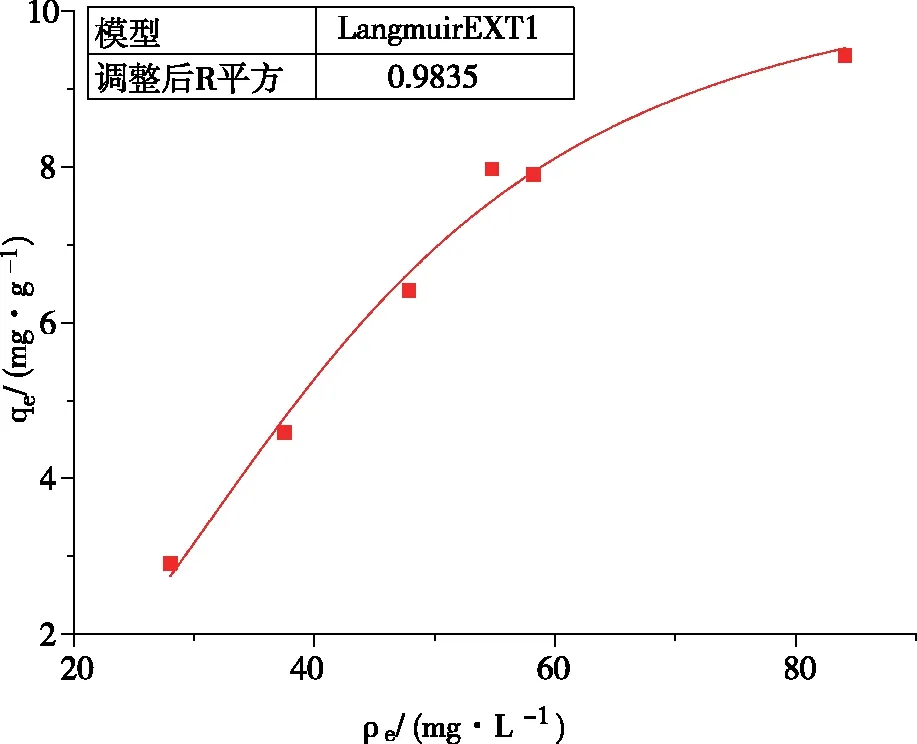
图12 Langmuir模型拟合
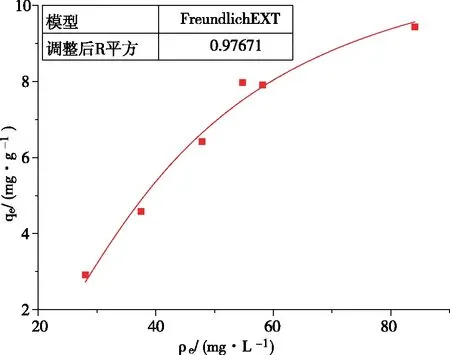
图13 Freundlich模型拟合
3 总结
(1)镍离子去除率随着吸附剂投加量的增加而增加,但增加幅度缓慢,在投加量为1 g/L时吸附量最大。
(2)UiO-66-NH2/GO的吸附量随着时间的增加而增加,3 h时基本达到吸附平衡。对实验数据进行动力学拟合,结果显示准二级动力学方程拟合更好。
(3)随着pH的增加,UiO-66-NH2/GO吸附镍离子的吸附量逐渐增加,当溶液pH为8时,UiO-66-NH2/GO吸附镍离子效果最佳。
(4)随着温度升高,吸附量逐渐增加,这表明该吸附过程为化学吸附,是吸热反应,随着温度升高,吸附过程不断正向进行,吸附量增加。
(5)不同的初始溶液浓度对UiO-66-NH2/GO的吸附效果也有影响,用Langmuir和Freundlich模型对实验数据进行拟合,结果显示其更符合Langmuir等温模型。

