香兰素通过NF-κB 信号通路抑制巨噬细胞活化的作用研究
谷利伟,赵立琴,范博文,刘勇
(黑龙江八一农垦大学,大庆 163319)
香兰素是从香荚兰豆中提取的一种重要的合成香精,在食品加工,烟草制造等领域应用广泛。近年来,大量文献表明香兰素的作用不仅仅局限于食品添加剂领域,其抗炎、抗氧化、抗衰老等作用也正逐一被揭示[1]。在集约化畜牧养殖业持续发展的关键时刻,使用价格低廉、安全、环保的天然产物提取物作为添加剂已成为养殖户及消费者均认可的方式[2]。
人们对炎症反应并不陌生,机体遭受到外来微生物侵袭或自身内环境稳态发生改变时,炎症反应会迅速导致大量炎症因子的释放、以及趋化因子等介质的产生,以提高抗病能力并对受损的组织或器官进行修复,是机体内环境稳态自我调节的一种适应性反应。而过度的炎症反应却会对机体造成一系列消极影响,过度的炎症反应在清除外来病原侵袭或恢复稳态的同时也会增加机体内组织或器官内细胞的变性和坏死,影响机体正常的生理功能[3]。巨噬细胞作为天然免疫系统重要的组成部分在机体内环境稳态的调节过程中扮演着关键的角色。有大量研究表明,巨噬细胞的活化直接介导了内源性的炎症反应,并且由于其活化后释放的大量炎症因子以及一系列炎症介质进一步放大了炎症所带来的负面影响,直接导致周围功能细胞的氧化、凋亡和坏死[4-5]。如何通过限制巨噬细胞的过度活化,合理的控制炎症反应所带来的不良影响成为天然免疫领域研究的热点问题。
巨噬细胞活化及表型转换一直是天然免疫学研究领域的热点问题。正常的生理状态下巨噬细胞以静息状态存在于全身的结缔组织,对机体的内环境稳态进行监管。一旦机体内环境稳态的改变超出了机体可调节的阈值或机体遭遇到外来微生物的侵袭时,巨噬细胞会第一时间发生活化,一方面增强其自身的吞噬能力;另一方面释放大量的炎症因子及炎性介质来清除入侵的病原微生物并帮助机体进行稳态重塑[6-7]。在巨噬细胞活化过程中,其功能也会随着表型的变化而发生明显的改变。CD11B 作为判断巨噬细胞活化的重要标志物在巨噬细胞的研究中被广泛提及。在活化初期或疾病的急性期,巨噬细胞以M1 表型存在,高表达CD68 并发挥促炎效应[8];而在活化后期或疾病的转归期,巨噬细胞以M2 表型存在并发挥抑炎作用,同时伴随着CD206 的高表达[9]。尽管关于巨噬细胞表型变换的相关机制还没有被完全揭示,但是有大量研究表明NF-κB 信号通路在巨噬细胞活化过程中发挥了重要作用[10-11]。
基于大量关于香兰素抑炎、抗炎的研究,提出疑问,香兰素是否也在巨噬细胞活化过程中发挥了重要作用呢?其发挥抑炎、抗炎的机制又是怎样的呢?基于这样的疑问设计了如下试验。首先使用LPS 处理巨噬细胞以构建巨噬细胞活化模型,进而参考其他研究使用香兰素对活化的巨噬细胞进行处理以评价香兰素对巨噬细胞活化的抑制作用,并对其相关机制进行探讨。
1 材料与方法
小鼠巨噬细胞系RAW164.7 细胞,购自上海中乔新舟生物科技有限公司。
1.2 主要试剂
香兰素(Sigma-Aldrich,美国);DMEM 培养基(Gibio,美国);胎牛血清(Gibco,美国);p65、P-p65、β-actin 一抗(Cell Signaling Technology,美国);HRP标记山羊抗兔IgG、HRP 标记山羊抗鼠IgG(Proteintech,美国);CD11B、CD68 流式一抗(Abcame,美国);TRIzol (Life Technologies,美国);反转录试剂盒(Roche,美国);荧光染料(TAKARA,日本);ECL 发光液(Millipore,美国)DAPI、LPS、BCA 蛋白浓度测定试剂盒增强型、SDS-PAGE 凝胶配制试剂盒均购自碧云天生物技术公司。
1.3 RAW164.7 细胞的培养
RAW164.7 巨噬细胞于10%胎牛血清、1%双抗的DMEM 高糖培养基37 ℃、5% CO2条件下培养,每两天传代一次。
1.4 香兰素及LPS 处理巨噬细胞
将RAW164.7 细胞接种于10 cm 细胞培养皿中,待细胞密度长至80%左右时,使用10 μM LPS 处理6 h 构建巨噬细胞活化模型[12],对照组加入等量培养基;香兰素处理组在巨噬细胞活化模型构建成功后使用200 nM 香兰素处理细胞4 h 后收集样品[13]。
1.5 各组巨噬细胞内IL-1β mRNA 表达量
各组细胞处理完成后使用Trizol 法提取细胞内总RNA,测定浓度后将总RNA 反转录合成cDNA 后按25 μL 体系依次加入cDNA、IL-1β 与β-actin 上下游引物(见表1)、荧光染料及灭菌水,每组设置3 组重复,预混后放入PCR 仪中进行扩增。
1.6 流式细胞仪检测巨噬细胞活化及表型
细胞吸去培养基后,使用预冷的PBS 洗涤细胞3 次,弃上清。使用0.25%胰酶将细胞消化离心,1 mL PBS 重悬细胞,将细胞密度调整为1×106个·mL-1,三组细胞分别加入CD11B 和CD68 抗体混匀,37 ℃下孵育30 min,预冷的PBS 洗涤细胞3 次后装入流式管内,上机检测。
1.1 试验细胞系

表1 IL-1β 与β-actin 引物序列Table 1 Primer sequences for PCR amplification of IL-1β and β-actin
1.7 Western Blot 检测p65 蛋白活化水平
各组细胞处理后弃去培养基,使用预冷的PBS洗涤细胞3 次,弃上清,加入含有1% PMSF 的RIPA裂解液并刮取细胞,4 ℃裂解20 min。裂解完全的细胞于4 ℃离心机内12 000 ×g 离心5 min,吸取上清,使用BCA 法测定蛋白浓度,调整蛋白体积并加入蛋白上样缓冲液煮沸使蛋白质变性。将30 μg 蛋白样品加入到10%的预制胶中,每组设置3 个重复样品进行SDS-PAGE 凝胶电泳。按照三明治样将PAGE胶上的蛋白样品转移到PVDF 膜,使用5%的脱脂乳室温封闭1 h,加入p65(使用TBST 按1∶100 比例稀释),P-p65(使用TBST 按1∶100 比例稀释),β-actin(使用TBST 按1∶1 000 比例稀释)一抗,4 ℃孵育过夜。TBST 清洗5 次,二抗室温下孵育1 h,TBST 清洗5 次,ECL 显影液下进行显影,统计蛋白表达量。
1.8 免疫荧光检测p65 入核情况
细胞均匀接种在含有细胞爬片的24 孔板中,待细胞完全贴壁,各组进行不同处理后,4%多聚甲醛室温下固定细胞2 h。PBST 清洗5 次,每次5 min,使用p65 一抗孵育过夜。使用PBST 清洗5 次,相应的二抗室温下孵育1 h,再次使用PBST 清洗5 次后滴加含有DAPI 的抗淬灭剂,树蜡封片后激光共聚焦显微镜下观察p65 位置。
1.9 数据统计分析
数据分析统计使用Graphpad Prism 7.0 软件,各组数据采用单因素方差分析(One -way ANOVA)法进行统计并采用平均值±标准差(Mean±SD)表示,P<0.05 认为有统计学意义。
2 试验结果
2.1 香兰素处理后各组IL-1β mRNA 表达量
各组细胞经过不同处理后使用荧光定量PCR 方法对各组细胞内IL-1β mRNA 表达量进行统计以评价香兰素对巨噬细胞活化的抑制作用。结果如图1所示,经过香兰素处理后,被LPS 活化的巨噬细胞内IL-1β mRNA 表达量显著下降。
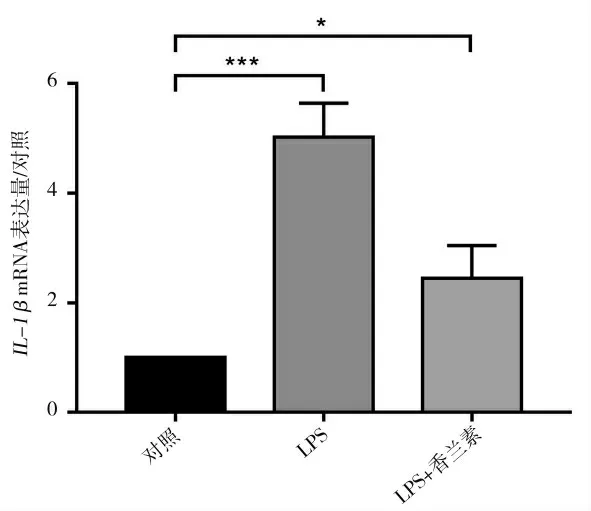
图1 不同处理组细胞内IL-1β mRNA 表达量Fig.1 IL-1β mRNA expression in each group.*P<0.05,***P<0.001
2.2 香兰素处理后各组巨噬细胞活化水平及表型检测
各组细胞经处理后对巨噬细胞活化标志物CD11B 以及M1 表型的标志物CD68 进行荧光染色,使用流式细胞仪对各组内标志物表达水平进行检测。结果如图2 所示,(A)为流式细胞仪检测图,图中左下角为双阴性细胞,右下角为CD11B 阳性细胞,左上角为CD68 阳性细胞,右上角为CD11B、CD68 双阳性细胞。(B)图为各组内CD11B 阳性细胞率(右下角细胞量及右上角细胞量总和),(C)图为CD11B 及CD68 阳性细胞量(右上角)。与对照组相比,LPS 组CD11B 阳性细胞显著增加,LPS+香兰素组无差异;同样,与对照组相比,CD11B 及CD68 双阳性细胞在LPS 组显著增加而LPS+香兰素组差异不显著。
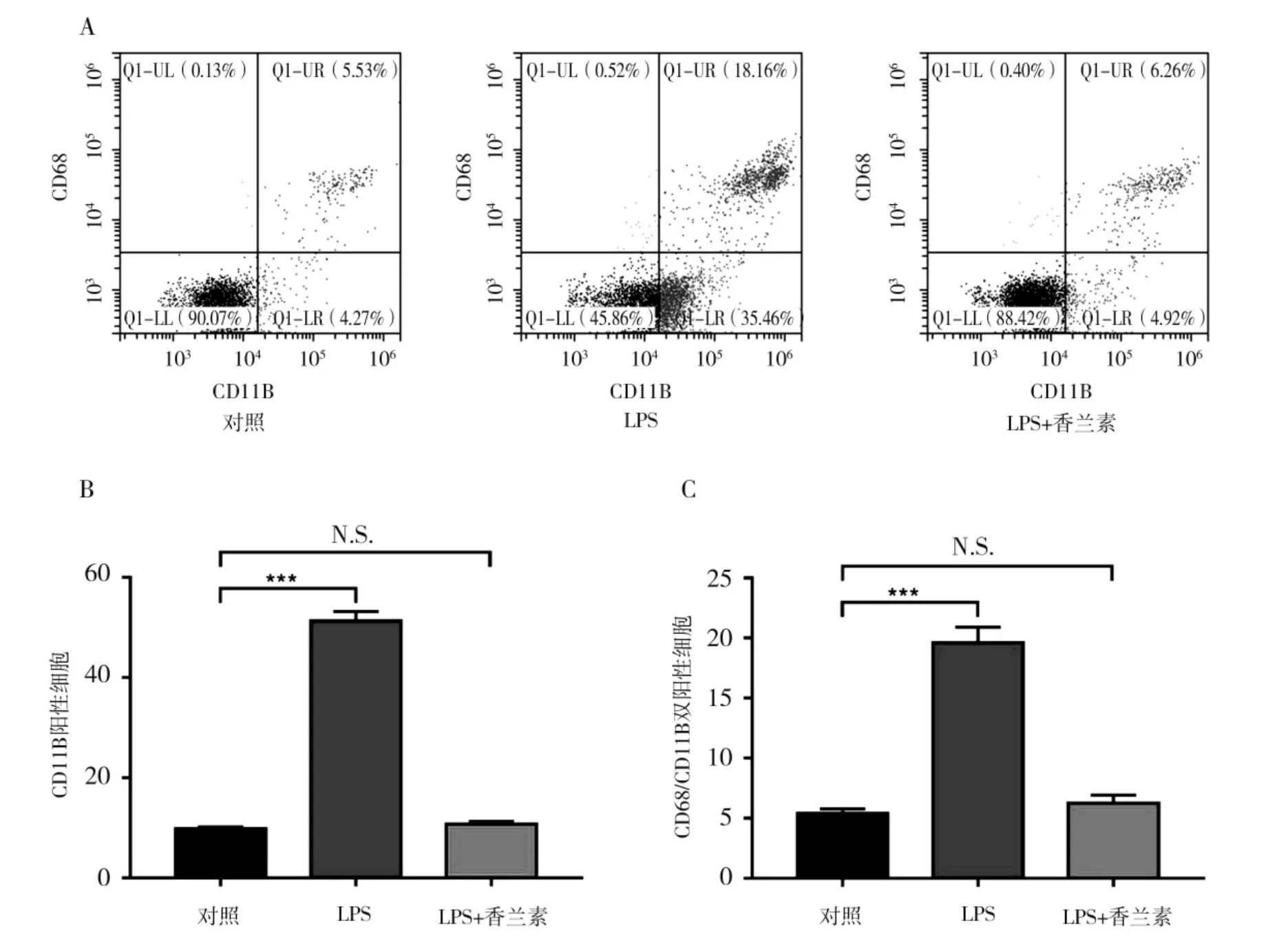
图2 不同处理组细胞内CD11B 及CD68 荧光染色后流式细胞仪检测结果Fig.2 CD68 and CD11B level measured by flow cytometry in each group
2.3 香兰素处理后各组细胞内NF-κB 中p65 亚基活化水平检测
各组细胞经过不同处理后使用Western bolt 方法对各组细胞内p65 亚基的磷酸化蛋白的表达量进行统计以评价香兰素对巨噬细胞活化的抑制作用。结果如图3 所示,(A)图为各组p65 蛋白磷酸化水平,(B)图为各组蛋白表达量统计图。结果显示,与对照组相比,LPS 组p65 亚基磷酸化水平显著增加,经过香兰素处理后,被LPS 活化的巨噬细胞内磷酸化的p65 蛋白表达量与对照组相比无显著差异。
2.4 香兰素处理后各组细胞内NF-κB 中p65 入核现象检测
各组细胞经过不同处理后使用免疫荧光方法对各组细胞内p65 亚基的入核情况进行观察以评价香兰素对巨噬细胞活化的抑制作用。结果如图4 所示,与对照组相比,LPS 处理细胞后,p65 亚基均定位在核内,而使用香兰素处理后,p65 亚基大量定位于细胞质。

图3 不同处理组细胞内磷酸化p65 表达量Fig.3 p65 activated expression measured by western bolt in each group

图4 不同处理组细胞内p65 入核现象Fig.4 The level of p65 in nucleus measured by immunofluorescence in each group
3 讨论
试验通过使用LPS 处理巨噬细胞构建巨噬细胞活化模型,添加香兰素以评价其抑炎、抗炎作用,并对其机制进行了初步的探讨。结果显示,添加香兰素对LPS 诱导活化的巨噬细胞有明显的抑制作用,其作用机制中可能是通过抑制NF-κB 信号通路内p65亚基的活性,阻碍其入核从而达到抑制巨噬细胞活化的作用。
众所周知,巨噬细胞活化后会产生大量的炎症因子以达到清除外来入侵物质,协助机体进行稳态重构的目的,在这其中,IL-1β 是巨噬细胞活化后释放的首要细胞因子。大量研究表明,巨噬细胞活化后会释放IL-1β 从而诱发内源性炎症反应导致细胞凋亡和坏死[14]。试验中,我们发现使用LPS 处理巨噬细胞后,IL-1β 的mRNA 表达水平显著增加,而使用香兰素处理后活化的巨噬细胞内IL-1β 的mRNA 表达水平被显著抑制,与对照组相比无显著性差异,试验结果初步表明香兰素可以显著抑制巨噬细胞的活化,减少IL-1β 的合成。我们又对各组巨噬细胞活化标记物CD11B 及M1 表型标记物CD68 进行荧光染色,使用流式细胞仪进行检测并对活化的巨噬细胞及M1 表型数量加以统计分析。结果显示,在使用LPS 处理后CD11B 阳性细胞数显著增加,而添加香兰素后CD11B 的阳性细胞数量显著减少,与对照组相比无显著性差异。不仅如此,CD68/CD11B 双染结果显示,与对照组相比,LPS 组双阳性细胞数极显著增加,而LPS+香兰素组双阳性细胞无显著性差异。CD11B 是免疫相关性细胞活化的主要标记物,通过参与补体系统的活化过程发挥免疫细胞的粘附、迁移和吞噬功能并且放大了免疫细胞的炎症反应,造成细胞毒性,诱导细胞凋亡[15]。CD68 作为B 类清道夫样受体家族的一员是包括巨噬细胞、单核细胞、肥大细胞在内的免疫相关性细胞的特异性标记物[16]。尽管释放炎性因子是巨噬细胞活化的重要标志,但巨噬细胞通过增加其表面相关受体的活化从而发挥其吞噬和粘附作用是巨噬细胞活化后的第一响应信号,优先于其炎性因子的释放。因此,根据巨噬细胞表面吞噬和粘附相关受体的活化水平来判定巨噬细胞状态更为直观[17]。不仅如此,关于巨噬细胞M1 和M2 表型转换的研究一直热度不减,尽管并没有完全阐明巨噬细胞表型转换的相关机制,但是M1 型巨噬细胞的促炎功能和M2 型巨噬细胞的抑炎功能已被揭示[18]。在巨噬细胞活化后,大量的模式识别受体会迅速活化并对机体内的一系列变化做出响应,此时的巨噬细胞表现出的作用为“清除”和“识别”,为M1型;而在疾病的转归期,巨噬细胞的功能和角色又发生改变,表现为“修复”和“保护”,为M2 型。CD68 作为清道夫样受体家族的一员在M1 表型的巨噬细胞中参与了大量的吞噬和识别过程,是M1 型巨噬细胞的重要标志之一[19]。试验发现,在巨噬细胞活化模型内加入香兰素后,其M1 表型标记物CD68 及活化标记物CD11B 数量均显著下调,说明巨噬细胞活化后其吞噬能力被显著抑制,并且结合其IL-1β mRNA表达量显著下调这一试验结果,确定香兰素可以通过抑制巨噬细胞吞噬能力,下调其促炎因子的释放的方式,阻碍由LPS 诱导巨噬细胞的活化及分化过程。
在明确了香兰素对于LPS 诱导的巨噬细胞活化及分化的抑制作用后,我们又对其在巨噬细胞内发挥抑炎、抗炎作用的相关机制进行了初步探讨。使用Western blot 方法对NF-κB 通路内p65 亚基的磷酸化水平进行检测。结果显示,与对照组相比,使用LPS处理后的巨噬细胞中p65 蛋白的磷酸化水平显著增加;而在添加了香兰素后这种升高趋势被显著抑制。不仅如此,免疫荧光结果显示在LPS 刺激组,核内p65 的荧光强度显著增强而在使用了香兰素后,定位于核内的p65 荧光强度下降,表明LPS 可以增加p65的入核,而使用香兰素后会显著抑制其入核过程。NF-κB 信号通路作为天然免疫系统内最为重要的转录因子可被各种因素激活从而促进包括各项炎症因子及炎症介质在内的靶基因转录。NF-κB 是由p65和p50 两个同源二聚体亚单位构成,在正常生理条件下与其抑制因子IκB 组成无活性的三聚体定位于细胞浆参与细胞的增值与分化过程,而当接收到模式识别受体传入至胞内的信号后,包括IκBα 再内的IκB 迅速从三聚体上解离被泛素化酶体系统降解,丧失对p65 和p50 亚基的限制作用,而p65 和p50 亚基从三聚体单位上解离后,迅速暴露其丝氨酸及苏氨酸残基并通过磷酸化修饰增加其活性并迅速移位入核,促进下游靶基因的转录过程[20]。多项研究表明p65 的活化入核过程直接介导了包括巨噬细胞在内的免疫相关性细胞的活化[21],而在使用香兰素后Western blot 及免疫荧光结果均显示p65 亚基的活化均被抑制,这可能直接参与了香兰素的抑炎和抗炎过程,抑制巨噬细胞的过度活化及活化过程。
综合以上试验结果分析得出结论,香兰素通过限制NF-κB 信号通路中的p65 活性,抑制巨噬细胞的活化及分化以达到其抗炎抑炎的效果。而在日后的畜禽集约化养殖过程中可以通过适当的添加香兰素以达到提升畜禽抗病能力、降低养殖成本的目的。
4 结论
试验中,通过LPS 处理巨噬细胞以构建巨噬细胞活化模型并使用香兰素处理后发现,香兰素可通过作用于NF-κB 内p65 亚基,通过抑制其磷酸化、阻碍其活入核最终达到其抗炎、抑炎的功能。

