Hepa1-6原位肝癌小鼠模型的构建及其IDO1活性和表达的研究
郭磊磊 杨青
【摘 要】目的:建立Hepa1-6原位肝癌小鼠模型,并研究该模型中吲哚胺2,3-双加氧酶1 (indoleamine 2,3-dioxygenase 1, IDO1)的活性和表达,为研究IDO1在肝癌中的作用及IDO1抑制剂的药效奠定基础。方法:培养收集Hepa1-6小鼠肝癌细胞并调整浓度至2×106/50 μL,将其注射于小鼠肝左叶中,术后14天处死小鼠,收集血清,解剖并观察小鼠肝脏肿瘤的形成情况,对肿瘤组织进行HE染色,qPCR法和Western blot法分别检测肿瘤中IDO1 mRNA和蛋白的表达水平,HPLC法检测血清中色氨酸和犬尿氨酸的含量。结果:小鼠肝上形成肿瘤且呈弥漫性生长并发生肝叶间的转移;肝癌小鼠血清中IDO1活性、肿瘤中IDO1 mRNA和蛋白水平的表达比野生型小鼠的均高。结论:成功建立Hepa1-6原位肝癌小鼠模型,该模型可用于IDO1功能及IDO1抑制剂药效学研究。
【关键词】原位肝癌;吲哚胺2,3-双加氧酶1(IDO1);IDO1抑制剂
【中图分类号】R730.3【文献标识码】A【文章编号】1672-3783(2020)06-18--01
肝癌是世界范围内的恶性肿瘤,预后差,现有的治疗效果不尽人意。免疫疗法是肝癌治疗的新希望,免疫检查点阻断疗法在肝癌中已有应用[1]。吲哚胺2,3双加氧酶1(indoleamine-2,3-dioxygenase 1,IDO1)是犬尿氨酸代谢通路中的关键限速酶,催化人体必需氨基酸色氨酸(tryptophan,Trp)分解代谢生成L-犬尿氨酸(kynurenine,Kyn)。它在多种肿瘤里高表达,使肿瘤组织中CD8+ T细胞功能和增殖減弱,Foxp3+ Treg细胞增殖,促进肿瘤细胞生存及肿瘤免疫逃逸等[2]。IDO1被认为是潜在的免疫检查点,IDO1抑制剂是肿瘤免疫治疗的新型候选药物[3]。目前尚无IDO1抑制剂药物上市,但多个IDO1抑制剂如Indoximod、Epacadostat、BMS986205等已经进入临床试验,其中包括BMS986205与PD-1抗体联合治疗肝癌的一项I期/II期临床实验(NCT03695250)[4]。
本研究在建立Hepa1-6原位肝癌小鼠模型的基础上,研究了该模型血清中IDO1活性和肝肿瘤中IDO1 mRNA与蛋白水平的表达,为研究IDO1在肝癌中的作用及IDO1抑制剂的药效学奠定基础。
1 实验材料与方法
1.1 主要实验材料
C57BL/6小鼠(上海杰思捷实验动物有限公司)、Hepa1-6小鼠肝癌细胞()、HE染色试剂盒(华安生物)、逆转录及qPCR试剂盒(诺唯赞)、IDO1抗体(华安生物)等。
1.2 试验方法
培养收集Hepa1-6细胞并用PBS调整浓度至2×106/50 μL。脱毛膏褪去小鼠胸腔和腹部的毛并腹腔注射160 μL 5%水合氯醛使小鼠麻醉;沿小鼠剑突剪开1cm的开口,使肝左叶暴露并注入50 μL细胞悬液(含2×106个细胞),棉球按压止血30 s,器官归位并缝合创口。术后1-3 h小鼠苏醒,正常饲养。术后14天,小鼠引颈处死,收集血清,解剖并观察肝肿瘤发生和发展情况,收集小鼠肝肿瘤组织。HPLC检测血清中Kyn和Trp含量,肿瘤组织进行HE染色,提取肿瘤组织总RNA和蛋白,用qPCR法和Western blot法检测IDO1 mRNA和蛋白表达。具体实验步骤参照文献[18]。
1.3 统计学分析
采用Grapsd Prism 5.0进行数据处理和图像绘制,所有实验数据均以平均数±标准误(±se)表示,两组数据间比较采用独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 造模情况
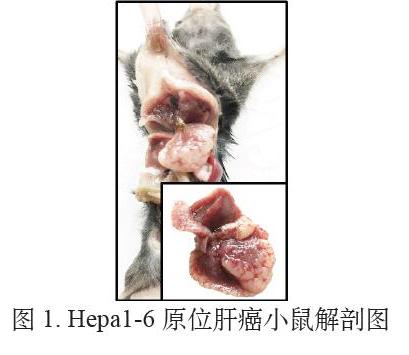
术后14天小鼠腹部伤口全部愈合,手术缝合线全部自动脱落。人道主义处死小鼠,解剖并取出肝脏组织,进行观察,如图1所示,棕色部分为肝组织,白色部分为肿瘤组织,肿瘤在肝上大面积弥散性生长,并且已经发生肝叶间的肿瘤转移,小鼠接瘤14天后存活率和成瘤率均为100%。
2.2 组织病理检查
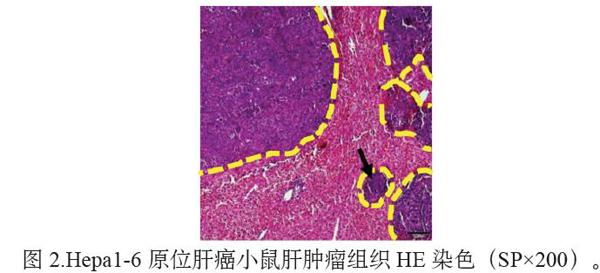
肝肿瘤组织HE染色结果如图2所示,深紫色部分为肿瘤区(黄色圈区域),其细胞排列无规则,细胞核大,染色较深;浅紫色偏红区域为正常肝区,细胞排列整齐,细胞核染色较浅。此外有小片独立的肿瘤区出现(黑色箭头指处),表明肝癌细胞已在肝内发生转移,印证了上述解剖观察结果。
2.3 肝肿瘤组织中IDO1 mRNA和蛋白表达水平的检测
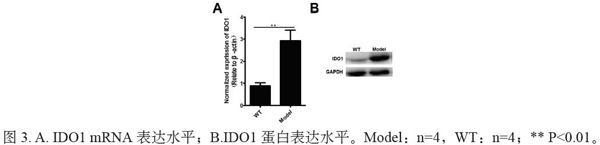
qPCR法检测肝肿瘤组织中IDO1 mRNA的表达,Western blot法检测IDO1蛋白的表达,以野生型(WT)小鼠正常肝组织为对照,结果如图3所示Hepa1-6原位肝癌小鼠肝肿瘤组织中表达的IDO1 mRNA和蛋白均比WT小鼠的高。
2.4 小鼠血清中IDO1活性的检测
HPLC法检测野生型小鼠(WT)和Hepa1-6原位肝癌小鼠血清中Trp和Kyn的浓度,以(Trp/Kyn)*100的比值来定量表示小鼠血清中的IDO1活性。结果如图4所示,Hepa1-6原位肝癌小鼠血清中Kyn浓度水平较WT小鼠的高,Trp浓度水平与WT的基本一致,(Kyn/Trp)*100的值变化与Kyn浓度水平变化一致,即Hepa1-6原位肝癌小鼠血清中的IDO1活性高于WT小鼠血清中的。
3 讨论
Hepa1-6原位肝癌小鼠血清中IDO1活性是野生型小鼠的2.5倍,本底IDO1活性较高,能较好的反映在给予IDO1抑制剂后小鼠血清中IDO1活性的变化情况。同时,Hepa1-6原位肝癌小鼠血清中IDO1活性和肿瘤中IDO1的表达均高,是研究IDO1与肝癌关系的良好工具。
总之,本研究在建立Hepa1-6原位肝癌小鼠模型的同时,研究了该模型血清中IDO1活性和肝肿瘤中IDO1 mRNA和蛋白水平IDO1的表达,发现肝癌小鼠血清中IDO1活性、肝肿瘤中IDO1 mRNA和蛋白水平的表达均较野生型小鼠中的高,为研究IDO1在肝癌中的作用及IDO1抑制剂的药效学奠定基础。
参考文献】
周晨,刘家成,石钦,等. 肝癌分子靶向药物及免疫抑制剂治疗的研究现状及进展[J]. 中华介入放射学电子杂志,2019,7(3):243-250.
毛耀南,于萍,任敬慧,等. IDO小分子抑制剂的研究进展[J].实用药物与临床,2020,23(2):186-192.
https://clinicaltrials.gov/
李天祺,赛音贺西格和杨青. 可用于IDO1抑制剂药效学研究的KPIC原位胰腺癌小鼠模型的构建[J]. 复旦大学学报(医学版),2019,46(5):576-583.

