结直肠癌的免疫微环境研究
张之亮 苏琳
结直肠癌( colorectal cancer,CRC)是临床上最常见的消化系统恶性肿瘤,在我国的恶性肿瘤中发病率中居 3-5位[1-2],世界范围内CRC 预计新增 136万新发病例和69万死亡病例,超过一半的CRC患者容易发生复发或远处转移。目前,结直肠癌的临床检测主要是微卫星不稳定性(microsatellite instability, MSI)、RAS基因、BRAF基因等。微卫星不稳定性是结直肠癌发生发展一个重要途径,其可以导致肿瘤细胞内基因突变的大量产生,进而形成大量新的抗原,增加机体的免疫识别和免疫应答,产生抑制肿瘤的状态[3-5]。FDA 已批准免疫抑制剂用于患有微卫星高不稳定型(MSI-H)或错配修复缺陷型(dMMR)转移性结直肠癌患者[6]。RAS基因是表皮生长因子受体(epidermal growth factor receptor,EGFR)的下游基因,RAS基因突变可以激活RAS/MAPK信号通路,导致结直肠癌对抗EGFR靶向药物产生耐药[7-9],免疫耐受及逃避机制在癌症进展中发挥着重要作用[10]。肿瘤免疫微环境(tumor microenvironment,TME)[11]对于抗肿瘤起着重要作用,肿瘤微环境由非肿瘤细胞(如肿瘤相关成纤维细胞)、构成肿瘤新生血管的内皮细胞和周细胞、免疫和炎性细胞、骨髓来源细胞和胞外基质组成,它们产生生长因子、化学因子和基质降解酶,促进肿瘤的增殖和迁移[12-13]。目前的结直肠癌免疫治疗方法仅对部分亚型表现出良好的免疫应答率,大部分患者免疫应答率仍然较低在本文中,我们将阐述结直肠癌的免疫微环境的特征以及对于临床的免疫治疗提供指导价值。
1 一般资料与方法
1.1 结直肠癌表达谱数据检索与整理
TCGA数据库下载美国Illumina公司RNA-seq的level3数据,为了保证数据的准确性,我们对数据进行了预处理。最终,我们共获得了437例结直肠癌 RNA数据及相关的临床信息(性别、年龄、生存状态和生存期等)。美国国立生物技术中心的GEO数据库中下载项目集分别是GSE42284(n=188)和GSE24551(n=160)且这两个数据集都带有临床数据。
1.2 分层聚类分析
采用单个样本聚类的分析方法(ssGSEA)把表达谱数据解析出29种免疫的细胞、免疫因子和免疫通络的丰度,我们利用ESTIMATEA软件评估免疫细胞分值、基质细胞的分值以及免疫纯度分值。利用层次聚类的方法,把结直肠癌的样本进行免疫分型。
1.3 基因集变异功能富集和22种免疫细胞肿瘤浸润丰度分析
基因集变异分析(GSVA),是一种非参数的无监督分析方法,主要用来评估转录组的基因集功能富集结果。CIBERSORT是基于线性支持向量回归的原理对免疫细胞亚型的表达矩阵进行去卷积的一个工具,可用RNA-Seq的数据来估计免疫细胞浸润丰度。
1.4 生存曲线分析
针对我们筛选出来的结直肠中免疫微环境中的高中低免疫组,采用 Kaplan-Meier 法绘制生存曲线来预测总生存率,并使用时序检验(log-rank test)来检验高、低风险组生存曲线是否存在差异。
2 结果
2.1 结直肠癌免疫微环境分高中低免疫组
TCGA下载的结直肠癌的RNA-seq数据,基于ssGSEA解析出来29种免疫的细胞、免疫因子和免疫通络的丰度,通过层次聚类可以把结直肠癌中的免疫微环境分为高中低免疫组(图1a),并且这种方法在GSE42284数据集中进行同样分析,结果显示GSE42284数据集的样本也能分为高中低免疫组(图1b)。
2.2 结直肠癌免疫微环境分高中低免疫组通路和22种免疫细胞的差异
基于GSVA分析,筛选出每个样本的基因富集的丰度的通路矩阵,高免疫组vs.低免疫组进行差异通路分析,基于这些差异通路进行有监督聚类分析(图2a),通过热图可以看到intestinal immune network for IGA production、natural killer cell mediated cytotoxicity ,toll like receptor signal pathway 、hematopolietic cell lineage等通路在高免疫组的活性高于低免疫组。基于CIBERSORT[14]软件评估的22种免疫细胞的丰度在高中低组免疫的差异(图2b)。T cells CD8、T cells follicular helper、Macrophages M1和 Dendritic cells resting等免疫细胞的丰度在高免疫组高于低免疫组。然而Macrophages M0 、Macrophages M2 、T cells CD4 memory resting 等在高免疫组低于免疫组。
2.3 结直肠癌免疫微环境分高中低免疫组CD274和CTLA4的表达以及生存曲线分析

图1 基于ssGSEA解析的结果,在TCGA数据库和GSE42284数据集中,结直肠癌分为高中低免疫组,其中低免疫组(最左侧)和高免疫组(最右侧)用框标出,中间没有框标出的是低免疫组。
CD274和CTLA4在TCGA数据库中随着免疫活性的增高,表达水平显著性是增加(图3a,b)。结合随访数据,分别在TCGA和数据集GSE2455中分别进行高中低免疫组生存曲线分析(图3c,d),通过图中分析结果,可以看出在总生存期和DFS中高免疫组高于低免疫组。
3 讨论
癌症的发展是由于肿瘤细胞不断地在逃避抗肿瘤免疫,而作为肿瘤细胞免疫监视和免疫逃逸的发生部位[15],肿瘤免疫微环境与CRC的发生、发展及预后等密切相关[16-17]。然而对于结直肠癌免疫微环境的特征分析研究很少。
本研究利用公共数据库数据表达谱数据,对结直肠癌的免疫微环境进行了高中低免疫组的亚型分析,且能够在独立数据集中验证。研究显示Macrophages M0 和Macrophages M2 在高免疫组低于免疫组,然而Macrophages M1在高免疫组低于免疫组。肿瘤组织中的巨噬细胞是肿瘤微环境中最多的免疫细胞,可以分泌多种细胞因子,在肿瘤发生的初期,能够识别并清除肿瘤细胞,但随着肿瘤的发生发展,又对肿瘤的生长、侵袭、转移起着“双刃剑”的作用。其中Macrophages M0 和Macrophages M2促进肿瘤的生长。T cells CD8和T cells follicular helper等免疫细胞的丰度在高免疫组高于低免疫组。浸润肿瘤的T淋巴细胞,特别是CD8+T 细胞及与T细胞受体结合后产生IFN-γ、肿瘤坏死因子靶向肿瘤细胞,导致肿瘤细胞清除[18]。 滤泡辅助T细胞是一种新的CD4+辅助性T细胞亚群,能持续分泌趋化因子受体而发生免疫作用。从而又激活对intestinal immune network for IGA production、natural killer cell mediated cytotoxicity ,toll like receptor signal pathway 、hematopolietic cell lineagede等免疫通路起到激活作用。尽管本研究未继续深入探讨免疫微环境影响结直肠癌不同免疫组的具体分子机制 ,但是我们的研究利用不同角度证明了高免疫组患者处于免疫激活状态。且高免疫组与低免疫组比CD274的表达显著性的增加。FDA已批准PD-L1免疫抑制剂应用于晚期实体瘤种[19-21],如黑色素瘤、肺癌。因此,根据我们的方法筛选出来的高免疫组患者,可尝试PD-L1免疫抑制剂治疗的探索研究。
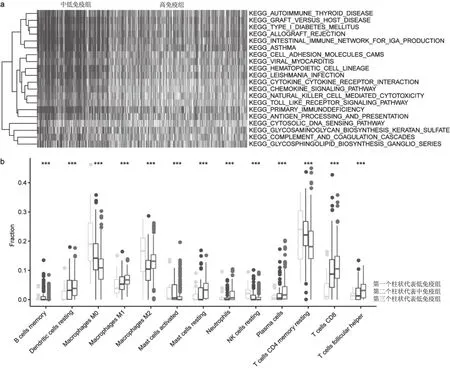
图2 富集的通路(2a)和22种免疫细胞(2b)在结直肠癌高中低免疫组差异

图3 TCGA数据库中CD274和CTLA4在高中低免疫组的表达(3a,b)以及 TCGA数据库和数据集GSE24551中的结直肠癌高中低免疫组的生存曲线分析(3c,d)
综上所述,免疫微环境逐渐成为肿瘤治疗的热点,现有的结直肠癌免疫治疗方法仅对部分亚型表现出良好的免疫应答率,大部分患者免疫应答率仍然较低,仍需多中心、大样本量研究,以满足其在多数结直肠癌患者中的有效性与安全性,从而使更多患者获益。结直肠癌免疫治疗是一个有前景性的治疗选择,值得进一步研究探索。

