生鸡屠宰场屠宰环节单核细胞增生李斯特菌的分子分型研究
孙晓文,陈思思,王小丁,姚 浩,田禹齐,焦新安,殷月兰
(扬州大学 江苏省人兽共患病重点实验室/江苏省动物重要疫病和人兽共患病防控协同创新中心,江苏 扬州 225009)
单核细胞增生李斯特菌(Listeria monocytogenes,Lm)是一种重要的人兽共患食源性病原菌,通过肉制品、乳制品等动物源性食品传播,感染该致病菌后能引起发热性胃肠炎、败血症、脑膜炎、孕妇流产等症状,致死率高达20%~30%[1]。美国、加拿大、法国等国家多次报道了李斯特菌病的暴发流行,它已严重威胁全球公众健康,引起了各国政府管理部门的高度关注[2]。2000 年,WHO 将Lm 列为4大食源性病原菌之一,2000 年,我国建立了包括Lm在内的全国食源性致病菌监测网,加大了对该致病菌的监测力度。2014 年我国颁布的《食品中致病菌限量》中提出对即食肉制品中Lm 的零容忍政策。
鸡肉是我国人民日常生活中重要的动物产品,鸡肉的生产加工和销售过程中时常存在Lm 污染,给人类的健康造成了潜在的威胁。有关研究报道指出市售鸡肉产品中Lm 的污染情况较为严重,据世界卫生组织(WHO)的统计,15%以上的禽产品受到Lm 污染[3]。因此了解生鸡屠宰过程中Lm 的污染状况,有利于加强对屠宰环节的卫生监督和管理,以预防Lm 引起的食源性疾病的发生。为探究生鸡屠宰过程中Lm 的污染状况,本研究对江苏淮安某生鸡屠宰场的4 个屠宰环节(烫煺、净膛、预冷清洗、分割传送)进行样品的采集,对Lm 分离株进行血清学、多位点序列分型(MLST)分析,明确Lm 在生鸡屠宰链的传播特征,为企业制定相关措施控制Lm 污染提供数据支撑。
1 材料与方法
1.1 样品来源2018 年8 月~2018 年11 月,选择江苏淮安某生鸡屠宰场定点采集样品,从整个屠宰流水线选择烫煺、净膛、预冷清洗、分割传送4 个环节采集肉鸡胴体擦拭样品,共采集肉鸡胴体擦拭样160 份,另外采集屠宰过程中使用的工具以及地面等环境擦拭样品40 份。
1.2 培养基与试剂UVM 改良李斯特菌增菌培养基、Fraser 基础培养基、脑心浸出液(BHI)培养基、缓冲蛋白胨水购自BD 公司;李斯特菌显色培养基购自法国科马嘉公司;MiniBEST Bacterial Genomic DNA Extraction kit、DL2000 DNA Marker购自宝生物工程(大连)有限公司;Lm诊断血清购自日本生研公司。
1.3 Lm 的分离培养根据美国食品药品监督管理局李斯特菌的检验方法分离Lm[4]。在棉球擦拭样品中倒入适量的UVM 增菌液,30 ℃培养20 h~26 h。取100 μL 菌液加入10 mL Fraser 增菌液中,37 ℃培养26±2 h。取50 μL 菌液于李斯特菌显色培养基上划线,37 ℃培养18 h~24 h。挑取蓝绿色且带白色晕环的单菌落在BHI 固体平板上纯化培养,用于后期进一步的鉴定。
1.4 分离菌株的PCR 鉴定以煮沸法提取的分离菌DNA 为模板,利用文献[5]中Ino2、MonoA、Siwi2和LisB 4 种引物对分离菌进行PCR 鉴定。
1.5 Lm 的血清型鉴定挑取BHI 固体平板上的单菌落接种于5 mL BHI 液体培养基中过夜培养,利用基因组提取试剂盒提取分离菌株的基因组,以其为模板,利用文献[6]中Lmo0737、ORF2110、ORF2819、Lmo1118 和prs 5 种基因的引物进行PCR 鉴定,初步确定分离菌株的血清型,进一步利用Lm 诊断血清采用玻片凝集法鉴定分离菌株的血清型,方法和结果判定标准参考产品说明书。
1.6 分离菌株的MLST 型按照法国巴斯德Lm 多位点序列分型数据库(http://bigsdb.pasteur.fr/listeria/listeria. html)提 供 的7 对 管 家 基 因(abcZ、bglA、cat、dapE、dat、ldh、lhkA)进行MLST 分型的PCR扩增,PCR 产物采用双向测序,利用BioEdit 软件将测序得到的基因序列拼接后,提交至Lm 的MLST 数据库(https://cge.cbs.dtu.dk/services/MLST/),从而获得相应的ST 型,最后利用BioNumerics 软件绘制不同血清型和屠宰环节的最小生成树(Minim Spainning Tree)。
2 结果与讨论
2.1 Lm 的分离鉴定结果从江苏淮安某生鸡屠宰场屠宰环节采集的200 份样品的检测结果显示,有40 份样品分离出Lm,总分离率为20.0%,其中环境擦拭样品(工具以及地面等擦拭样品)Lm 分离率为37.5%(15/40),肉 鸡 胴 体 擦 拭 样 品Lm 分 离 率 为15.6%(25/160)。1995 年~1996 年,在瑞典肉鸡屠宰场采集肉鸡擦拭样品,结果显示有50%样本检测出Lm[7]。1998 年11 月~1999 年4 月,王 振 国 等 人 在 长春某肉鸡屠宰加工厂采集152 份冻鸡肉样品,其中Lm 的检出率为10.5%[8]。以上Lm 的流行病学调查主要针对屠宰场的鸡肉,但对于Lm 在屠宰各个环节的污染以及传播规律少有报道。因此,本研究对Lm在整个屠宰链中的传播规律进行了调查研究。
本研究中烫煺环节、净膛环节未分离出Lm;分割传送环节分离出10 株Lm,分离率为25.0%;预冷清洗环节分离出15 株Lm,分离率为37.5%;地面、刀具等环境擦拭样品中分离出15 株Lm,分离率为37.5%(图1)。调查结果表明,Lm 污染主要存在于屠宰加工线后期。屠宰流程前期的烫煺、净膛环节不存在Lm 污染,而在预冷清洗环节Lm 污染率最高,之后的分割传送环节的污染率较预冷清洗环节略有下降。本研究中Lm 的污染规律与国外的报道基本一致:1995 年~1996 年瑞典对一家肉鸡屠宰场的调查显示,Lm 污染主要存在于屠宰加工线后期[7]。另外,本研究屠宰场的环境也存在Lm 的污染(37.5%),在屠宰场工人使用的刀具和地面等环境中均分离到Lm,提示该屠宰场屠宰操作技术及屠宰工艺有待改善。
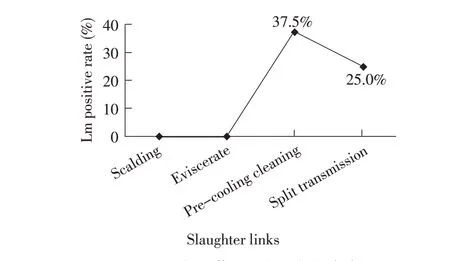
图1 屠宰场各环节Lm 的分离率统计结果Fig.1 Positive rate of Lm from different links in slaughterhouse
2.2 Lm 的血清型分型结果采用多重PCR 和O 抗原玻片凝集结合的方法检测分离菌株的血清型。结果显示,40 株Lm 分为3 种血清型,包括19 株血清型为1/2c(47.5%)、12 株血清型为1/2a(30.0%)、9株血清型为1/2b(22.5%)。结果表明,血清型1/2c 为分离Lm 的优势血清型。
2.3 Lm 的MLST 分型结果MLST 分型结果显示,40 株Lm 共分为8 种ST 型,其中优势ST 型为ST9 型(16/40,40.0%),其余依次为ST87(8/40,20.0%)、ST8(4/40,10.0%)、ST101(3/40)、ST378(3/40)、ST307(2/40)、ST330(1/40)。此外,还发现了一种新的ST 型(图2),它与ST9 仅有一个等位基因的差异,在7 个管家基因中,拥有6 个及以上相同等位基因的菌株属于同一个克隆复合群(Clonal complexes,CC),结果表明新的ST 型与ST9 同属于CC9,而CC9 在国内食品中普遍存在,其具有引起人类李斯特菌病散发的潜在风险。以颜色标记菌株的血清型,ST9、ST101 对应1/2a 和1/2c 两种血清型,其它每一种ST 型均仅对应一种血清型(图2),结果表明,菌株的血清型与ST 型具有高度对应性。
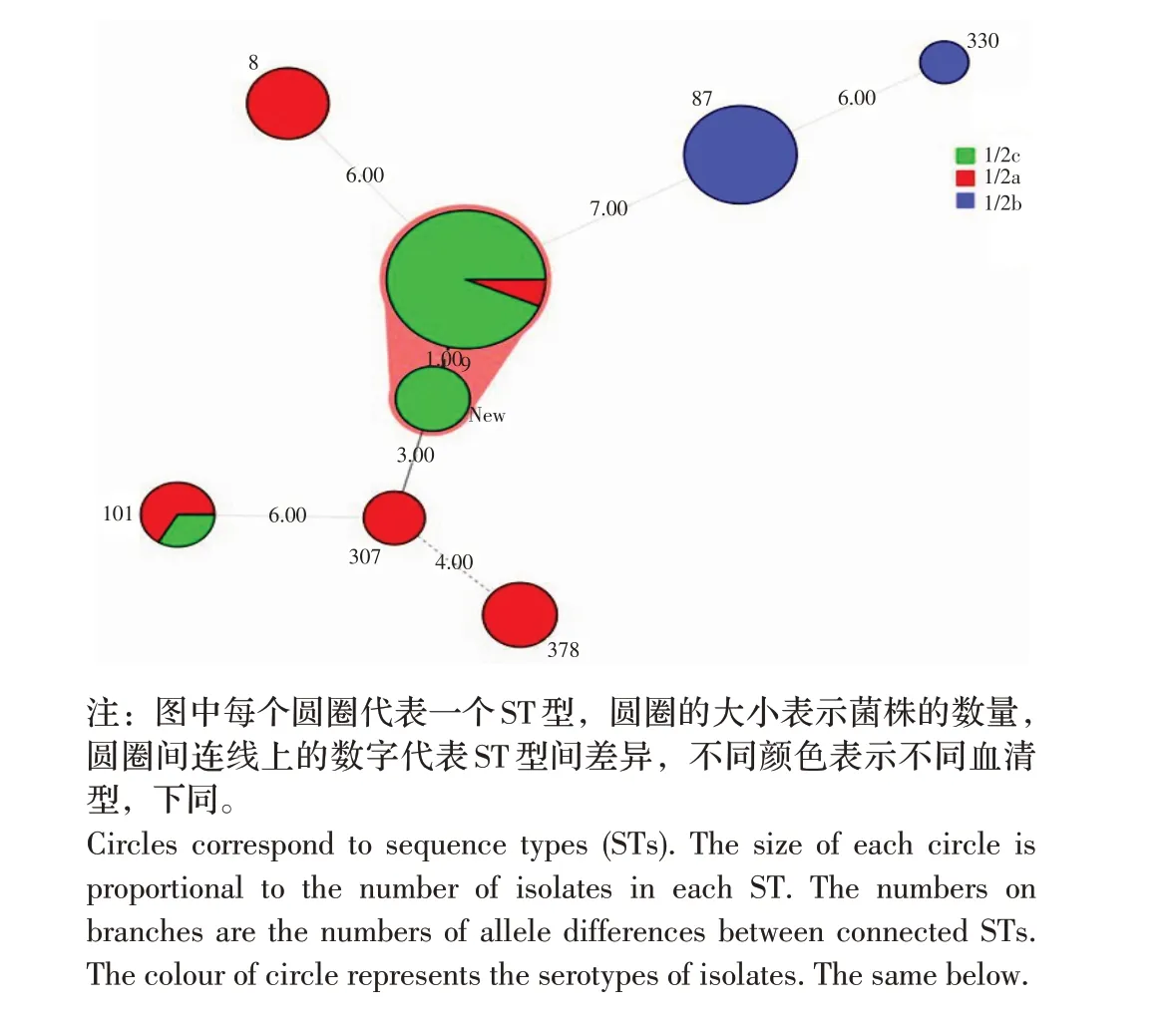
图2 不同血清型Lm 的ST 型最小生成树Fig.2 Minimum spanning tree of Lm isolated from different serotypes
对屠宰过程中不同屠宰环节的分离菌株进行MLST 分型比较结果显示,不同屠宰环节的分离菌株具有相同的ST 型,ST87、ST9 型菌株均能在预冷清洗、分割传送环节分离到(图3)。这些结果提示,Lm 在屠宰场中可能是沿着屠宰链传播。从进化树的分析来看,肉鸡胴体擦拭样和环境样品中分离到的Lm 分离株之间存在相同的ST 型(ST9、ST87、ST8、ST101、ST307、ST378),具有比较近的遗传进化关系,表明屠宰环境和肉鸡胴体之间可能存在交叉污染。
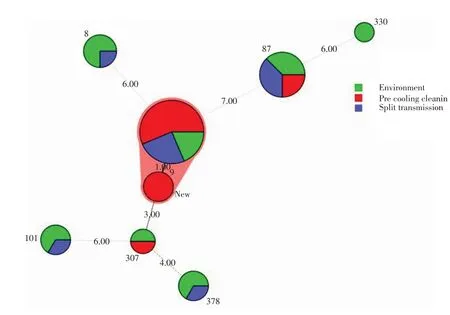
图3 不同屠宰环节中Lm 的ST 型最小生成树Fig.3 Minimum spanning tree of Lm isolated from different slaughtering links
本研究对Lm 的MLST 分型结果显示,其优势ST 型为ST9,其次为ST87 和ST8。Chen 等对2012年~2016 年中国43 个城市1 212 份样品中分离到的362 株食源性Lm 的MLST 分析结果显示,ST9 为最常见的ST 型,其次为ST8、ST87[9]。这与本研究结果一致,表明市售鸡肉产品中的Lm 污染可能来源于上游屠宰环节。值得注意的是,ST87 是引起我国人李斯特菌病的优势ST 型,2007 年~2012 年在中国4 个省市引起的28 例临床李斯特菌病的Lm 中,最常见的ST 型为ST87(9/28)[10]。其次,ST8 是常见的引起人类李斯特菌病Lm 的ST 型,2004 年~2012年,丹麦大多数李斯特菌病散发病例与ST8 相关[11]。基于ST87、ST8 是该屠宰场的优势ST 型,食用该屠宰场生产的鸡肉产品可能引起人类李斯特菌病,因此需要加强对该屠宰场的监测和卫生管理,以降低Lm 在屠宰环节的污染,为鸡肉进入餐桌环节严把质量关,以预防和减少食源性李斯特菌病的发生。

