LPS 诱导下鹅TLR15 及相关免疫因子的表达分析
邢波建,景一明,王权锜,刘玉芬
(哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150025)
Toll 样受体(Toll-like receptors,TLRs)属于I 型跨膜糖蛋白,是动物体内一类重要的模式识别受体(Pattern recognition receptors,PRPs),通过识别保守的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)启动天然免疫应答,从而清除病原微生物及其代谢产物,发挥重要的免疫防御作用[1]。近年来相关研究显示,当病原体感染机体时,TLRs分子被激活,信号可以通过相关分子介导,进而激发一系列的免疫应答反应,产生干扰素(Interferon,IFN)、白细胞介素(Interleukin,IL)和肿瘤坏死因子(Tumor necrosis factor,TNF)等效应分子,有效抵御各种病原体的入侵[2-5]。目前,已经确认禽类有10 种TLRs,其中TLR15 为禽类特有,有研究显示,清远麻鸡和白耳鸡在受到鸡白痢沙门菌感染后,血液中TLR15 的表达量会明显升高[6]。对健康马岗鹅不同组织TLR15 转录水平检测显示,TLR15 在18 种组织中均有表达,但表达量存在差异[7]。推测TLR15 在家禽感染中具有重要的作用。
细菌脂多糖(Lipopolysaccharide,LPS)作为革兰阴性菌胞壁的主要成分,可以通过丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)或核因子κB(Nuclear factor kappa-B,NF-κB)信号转导通路介导多种炎性因子的表达,产生氧化应激和炎症反应,所以常用于炎症模型的诱导[8-9]。本研究拟对LPS 诱导下,东北白鹅TLR15 及相关免疫因子的水平进行分析,为TLR15 的免疫功能研究奠定基础,也为鹅抗病育种研究提供相关材料。
1 材料与方法
1.1 主要实验材料2 日龄健康东北白鹅购自哈尔滨呼兰区某养殖孵化场,移至实验室在相同条件下进行饲养。RNA Extraction Reagent、HiScript II Q RT Super Mix for qPCR(+gDNA wiper)和ChamQ SYBR qPCR Master Mix 购自诺唯赞生物科技有限公司;LPS购自Sigma 公司;羊抗兔IgG-HRP 和山羊血清封闭液购自索莱宝(Solarbio)科技有限公司;兔抗鹅TLR15 多抗由普健(武汉)公司制备合成。其他试剂均为分析纯。
1.2 主要实验方法将雏鹅随机分为对照组和LPS诱导组,采用颈背部注射方式,LPS诱导组按1 mg/kg剂量注射LPS 溶液(Sigma-L2880,血清型,055∶B5;用生理盐水稀释成1 mg/mL),对照组注射等量的生理盐水,观察实验动物状态。参照文献[10]方法,24 h 后采集心脏、肝脏、脾脏、肺脏、肾脏、法氏囊、胸腺和骨髓组织,一部分样品用于免疫组织化学检测,另一部分于-80 ℃冷冻保存。
1.3 引物设计根据GenBank 上鹅TLR15 基因序列(JQ014619.1),IL 基因(IL-1β:AY426338.1;IL-6:JF437643.1)和IFN 基 因(IFN-α:JX464224.1;IFN-γ:KP325480.1、AY524421.1),应 用Primer Premier 5.0软件设计特异性引物,选取鹅GAPDH 基因[11]作为内参基因(XM013199522.1、AY436595.1)(表1)。引物均由上海生工生物工程技术服务有限公司合成。
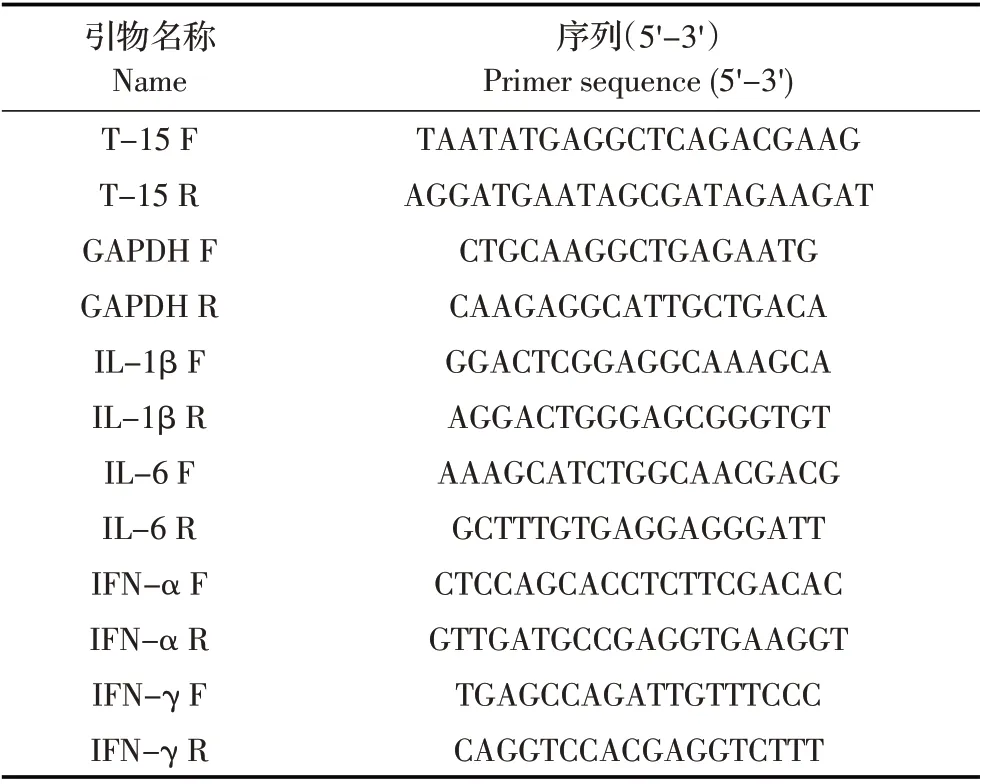
表1 引物序列Table 1 Lists of primers
1.4 东北白鹅不同组织TLR15 的检测依照RNA Extraction Reagent 操作程序,对东北白鹅心脏、肝脏、脾脏、肺脏、肾脏、法氏囊、胸腺和骨髓组织充分研磨,提取各组织中的总RNA,利用HiScript II QRT Super Mix for qPCR(+gDNA wiper)进行总RNA的纯化和反转录后,以此为模板,采用引物T-15 F/T-15 R,按照ChamQ SYBR qPCR Master Mix 说明分别检测各组织TLR15 基因转录情况。设定反应体系为20 μL,反应条件:95 ℃30 s;95 ℃10 s、60 ℃30 s,40 个循环;融解反应为60 ℃~95 ℃。输出每个孔的CT 值,以2-ΔΔCT法计算其转录水平,采用IBM SPSS 19.0 单因素方差分析显著性。
1.5 东北白鹅不同组织TLR15 的免疫组织化学检测参照文献[12]的方法,对无菌采集的东北白鹅心脏、肝脏、脾脏、肺脏、肾脏、法氏囊组织进行免疫组织化学检测,使用Image J软件对免疫组织化学染色部分进行灰度分析,计算相对染色面积。
1.6 东北白鹅不同组织相关免疫因子的检测参照1.4 中方法,采用相应引物,利用qPCR 分别检测LPS 诱导下各组织中IL-1β,IL-6,IFN-α,IFN-γ基因转录情况。
2 结 果
2.1 东北白鹅不同组织TLR15 基因转录水平检测对东北白鹅不同组织进行荧光定量PCR 检测,结果显示,LPS 诱导组TLR15 基因转录水平均高于对照组,其中法氏囊、脾脏、胸腺、肝脏和骨髓组织与对照组相比,转录水平差异极显著(p<0.01),心脏组织与对照组相比转录水平差异显著(p<0.05),但在肺脏和肾脏组织中与对照组相比转录水平差异不显著(p>0.05)(图1)。表明东北白鹅在感染后,可以显著上调部分组织中TLR15 的转录水平。
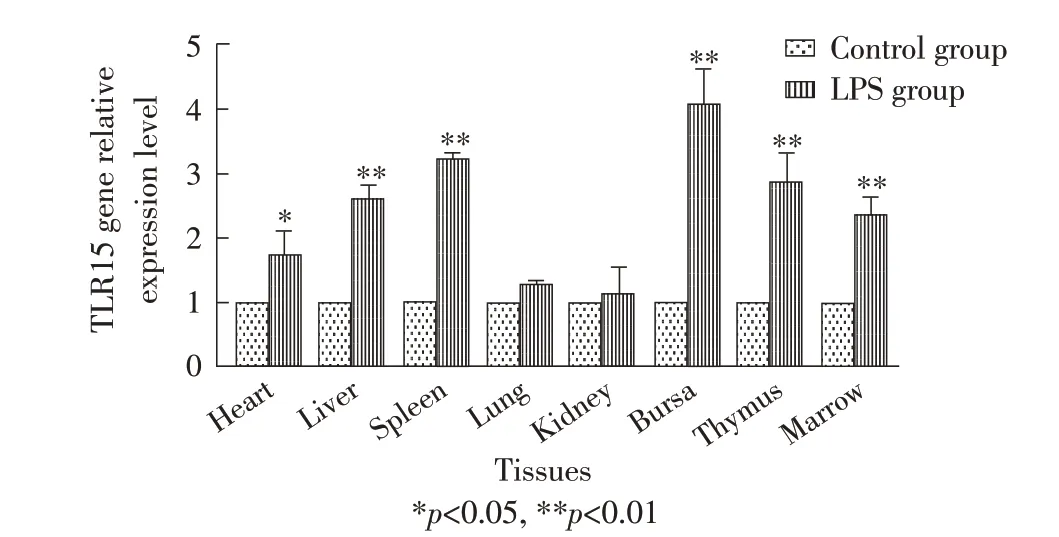
图1 TLR15 在东北白鹅不同组织中的转录水平Fig.1 Transcription level of TLR15 in different tissues of northeast white geese
2.2 东北白鹅不同组织TLR15 免疫组织化学检测采用免疫组织化学方法对东北白鹅心脏、肝脏、脾脏、肺脏、肾脏以及法氏囊等6 个组织进行TLR15的蛋白表达水平检测。结果显示,在LPS 诱导组中阳性染色细胞呈深黄色,少数阳性染色细胞呈浅黄色,染色主要呈现在细胞质和细胞膜上,细胞核内和细胞外无特异性染色的出现,而对照组阳性染色极少;法氏囊组织染色最深,脾脏和肝脏次之,心脏、肺脏和肾脏染色较浅(图2)。对所得图片使用Image J 软件,进行表达量灰度分析,结果显示法氏囊、脾脏和肝脏中TLR15 在LPS 诱导组与对照组间存在极显著差异(p<0.01),在肺组织和肾组织中差异显著(p<0.05)(图3)。表明法氏囊、脾脏和肝脏是LPS 诱导下产生TLR15 的主要组织。

图2 东北白鹅TLR15 的免疫组织化学分析(200×)Fig.2 Immunohistochemical analysis of TLR15 in expression northeast white geese(200×)
2.3 东北白鹅不同组织相关免疫因子的检测采用荧 光 定 量PCR 技 术 检 测IFN-α、IFN-γ、IL-6 和IL-1β的转录水平,结果显示(图4),LPS 诱导组IFN-α在法氏囊和胸腺中转录水平与对照组相比差异极显著(p<0.01),在肝脏、脾脏和肺中转录水平与对照组间差异显著(p<0.01),而心脏、肾脏和骨髓组织中转录水平差异不显著(p>0.05);IFN-γ在法氏囊、骨髓、肝脏和心脏组织中转录水平与对照组相比极显著(p<0.01),而其它组织则差异不显著(p>0.05);IL-6 在胸腺、心脏、脾脏和肝脏中的转录水平与对照组相比差异极显著(p<0.01),其它组织与对照之间差异不显著(p>0.05);IL-1β在心脏、肝脏、脾脏、肾脏、法氏囊和骨髓中转录水平与对照组之间存在差异显著(p<0.05),在肺脏和胸腺中转录水平与对照组间无显著差异(p>0.05)(图4)。表明在炎症反应中东北白鹅组织内TLR15 基因转录增强的同时,信号通路也陆续活化,下游的IFN-α、IFN-γ、IL-1β和IL-6 的转录水平也上调。IFN-α和IFN-γ在法氏囊中有最高的转录水平,IL-6 在胸腺中有最高的转录水平,IL-1β在各个组织间转录水平差异不显著,在免疫器官中转录水平高于其它器官[7]。
3 讨 论
Toll 样受体(TLRs)作为一种模式识别分子,在天然免疫中发挥重要作用,目前哺乳动物的TLRs 研究得比较透彻,而TLR15 在禽类中研究资料相对较少。以往研究显示,鸡的TLR15 可以识别细菌细胞壁肽聚糖成分,并且在法氏囊中高表达[13];在受到未甲基化的CpG-DNA 刺激后,鸡TLR15 在法氏囊组织中表达量也会明显上调[14];Jie 等在马立克病毒(Marek’s disease virus,MDV)感染的第4 d 和第7 d,鸡体内的TLR15 表达量也上调[15]。本研究使用LPS建立东北白鹅雏鹅炎症模型,检测体内不同组织TLR15 的转录水平,发现TLR15 在免疫相关组织中均上调,与上述结果基本一致。邢波建等通过免疫组织化学分析发现TLR15 在鸡脾脏中有很高的表达,在肺中较少[16]。本研究结果显示鹅的法氏囊、脾脏和肝脏组织中也有TLR15 高表达,表明炎症因子刺激下,TLR15 的表达快速上调,推测TLR15 在抗炎反应中发挥重要作用,因此可以应用该基因作为抗病基因进行品种筛选。
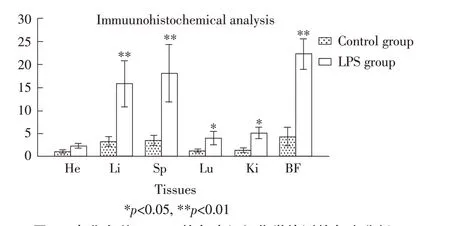
图3 东北白鹅TLR15 的免疫组织化学检测的灰度分析Fig.3 Gray analysis of immunohistochemistry sections for TLR15 expression in northeast white geese

图4 TLR15 相关免疫因子在东北白鹅不同组织中的转录水平Fig.4 Expression analysis of immune factors excluding TLR15 in different tissues of northeast white geese
有研究证实,在柔嫩艾美耳球虫刺激雏鸡时,鸡体内的TLR15 转录水平会上升,同时MyD88、NF-κB 和IL-1β的转录水平也呈现爆发式上调,特别是在盲肠(免疫器官)中有很大的提升[17];Heidari 等人对鸡进行MDV感染后,发现脾脏中TLR15的表达量上升,同时也伴有IL-1β、IL-6、IFN-α和IFN-γ等10个相关免疫因子的表达量上调[18];也有报道利用布拉氏酵母菌(Sb)和枯草芽孢杆菌B10(Bs)刺激三黄雏鸡会导致肠道中TLR2、TLR4 和TLR15 的转录水平显著升高,同时免疫器官中MyD88、IL-6、IL-1β和NF-κB 的转录水平明显升高[19]。上述研究结果与本研究的结果基本一致,表明在LPS 诱导下TLR15 和其它免疫相关因子(IFN-α、IFN-γ、IL-1β和IL-6)大量表达,特别是在免疫器官中转录水平显著提高,这使机体能够快速应对炎症反应。
综上所述,东北白鹅在LPS 诱导下不同组织中TLR15 基因转录水平会出现上调,相关免疫因子IFN-α、IFN-γ、IL-1β和IL-6 的转录水平也不同程度升高;免疫组织化学分析也表明在法氏囊、脾脏和肝脏中检测到高水平的TLR15表达。本研究为炎症反应条件下,东北白鹅TLR15免疫功能分析提拱了基础材料,也为鹅的抗病育种研究提供了数据支撑。

