紫叶李叶黄酮提取工艺的响应面优化及最佳采收月份的确定
甄可妙,苏 琪,闫子涵,国洪宾,高 剑,李梦冉,周程艳*
1河北大学药学院,河北省药物质量分析控制重点实验室,保定 071002;2沧州师范学院生命科学学院,沧州 061000
紫叶李(PrunuscerasiferaEhrh. cv.atropurpureaJacg.),又名红叶李,蔷薇科(Rosaceae)李属落叶乔木,具有保肝护肝、补中益气、养阴生津、润肠通便等功效[1,2]。前期试验结果表明其叶中含有大量的黄酮类化合物,为其主要活性成分,主要包含花青素、芦丁、槲皮素、山奈酚等,其中以花青素含量最多。
黄酮类化合物,又称生物类黄酮,是一类存在于自然界的、以2-苯基色原酮为母核的化合物,它在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要的作用。同时其具有多种显著的生物活性,可用于治疗多种疾病,且具有抗癌防癌作用,在临床上广泛应用,具有良好的研究价值。芦丁(rutin)具有多种生理功能,对人体各个器官均有保护作用,如清除自由基、促进成骨细胞的生长、降低血糖、抑制结肠癌和前列腺癌等[3]。槲皮素(quercetin)是一种多羟基黄酮类化合物,广泛存在于植物的花、叶、果实中,具有抗氧化、抗病毒、抗炎等作用,在细胞和动物实验中可以用来治疗肝、心、脾、肺、肾、骨科疾病、神经系统疾病等[4];花青素(anthocyanin),又称花色素,由1个2-苯基苯并吡喃环和环上不同的取代基组成,是自然界一类广泛存在于植物中的水溶性天然色素,通常以糖苷的形式形成花色苷[5],如花青素矢车菊素-3-O-葡萄糖苷、花青素3-半乳糖苷、花青素3-芸香糖苷、花青素丙二酰-鼠李糖苷、花青素戊糖苷、天竺葵色素鼠李糖苷等[6],紫叶李叶中主要为花青素矢车菊素-3-O-葡萄糖苷[1]。花青素具有抗氧化、保护肝功能、改善血液循环、抗癌、抑制炎症、抗过敏及视力保护等作用,在医药、食品和化妆品等行业有广阔的应用前景[7]。山奈酚(kaempferol)又称山奈黄素、山奈素、莰非醇、4′,5,7-三羟黄酮醇、四羟基黄酮,广泛存在于植物根、叶和果实中,具有防癌、抗癌、抗炎、抗氧化、抗菌、抗病毒等多种功效[8,9]。目前对紫叶李叶中黄酮类成分研究较少,尚未有通过测定紫叶李叶中花青素、芦丁、槲皮素、山奈酚此4种物质得率并采用建立权重公式来计算紫叶李叶黄酮类物质得率的报道,采收期亦不明确。
此外,近年来响应面法在优化黄酮、多糖、多酚等天然有效成分的提取工艺中得到了广泛应用。与传统的正交设计试验相比,响应面法对数据分析更为详细,不仅可以直观看出各因素对得率影响的显著情况,还可以进一步分析两因素间存在的交互作用,借助软件可以三维模拟出更直观更精准的最佳提取工艺,预测值准确性较高[10]。基于此,在单因素试验的基础上,采用Box-Behnken设计,运用响应面法对紫叶李叶中黄酮类物质的提取工艺进行优化,并使用最佳工艺处理不同月份紫叶李叶,对紫叶李叶中4种黄酮类物质进行了分离与测定,计算黄酮类物质的权重得率,最终确定紫叶李叶的最佳采收月份,以期为紫叶李叶的开发应用提供基础。
1 材料
1.1 材料和试剂
试验中紫叶李叶于2017年全年按月份在河北大学本部校园采集,经河北大学周程艳副教授鉴定为蔷薇科李属植物紫叶李(PrunuscerasiferaEhrh. cv.atropurpureaJacg.)树叶,于日光下晒干备用。标本(A2201712001)存放于河北大学药学院生药学与天然药物化学研究平台。甲醇(色谱纯 天津市科密欧化学试剂有限公司);乙酸(分析纯 天津市泰兴试剂厂);无水乙醇(分析纯 天津市科密欧化学试剂有限公司);矢车菊素-3-O-葡萄糖苷花青素标准品(成都曼思特生物科技有限公司);芦丁标准品(上海源叶生物科技有限公司);槲皮素标准品(上海源叶生物科技有限公司);山奈酚标准品(成都曼思特生物科技有限公司)。
1.2 仪器和设备
YL-060S超声波清洗器(深圳语路有限公司);LC-UV100 LC-100液相色谱仪(上海伍丰科学仪器有限公司);LBR-1型液相色谱柱温箱(石家庄莱博瑞分析仪器有限公司);Venusil C18Plus色谱柱(大连依利特分析仪器有限公司);TP502型电子天平(上海菁海仪器有限公司);FA2104N电子分析天平(上海菁海仪器有限公司);101-2AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司)。
2 方法
2.1 色谱条件
色谱柱:Venusil C18Plus(4.6×250 mm,5 μm);流动相A:1%乙酸,流动相B:100%甲醇,梯度洗脱(0~15 min,75%A;15~16 min,75%A→50%A;16~35 min,50%A;35~36 min,50%A→40%A;36~49 min,40%A;49~50 min,40%A→75%A;50~60 min,75%A),流速:0.6 mL/min,检测波长:360 nm,进样量:20 μL,柱温:30 ℃[11-13]。
2.2 溶液的制备
2.2.1 对照品溶液的制备
准确称取芦丁标准品0.005 0 g置于烧杯中,加入少量甲醇,超声溶解,转移至50 mL容量瓶中,用甲醇定容至刻度,摇匀,制成100 μg/mL的对照品溶液。槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素的对照品溶液均按照此方法配制。将配制好的溶液放入4 ℃冰箱冷藏贮存,待用时用甲醇稀释至所需浓度梯度,见表1。
表1 对照品溶液的制备
2.2.2 供试品溶液的制备
精密称取同一时间采集的干燥至恒重的紫叶李叶1.00 g,研磨成细粉,置于锥形瓶中,加入体积分数为70%的乙醇溶液使料液比达到1∶15,保鲜膜封口,毛细管扎细孔,超声波清洗器预热为50 ℃的条件下将锥形瓶放入并保持此温度,提取60 min,提取完成后,溶液用滤膜过滤后用甲醇稀释5倍。
2.3 标准曲线的绘制与方法学考察
2.3.1 标准曲线的绘制
按“2.1”项下色谱条件使用高效液相色谱仪测定“2.2.1”中不同浓度梯度的矢车菊素-3-O-葡萄糖苷花青素、芦丁、槲皮素、山奈酚4种物质对照品溶液的峰面积,以峰面积为纵坐标(y),对照品溶液的质量浓度(μg/mL)为横坐标(x),绘制4种标准品的标准曲线,得到回归方程。
2.3.2 方法学考察
系统适应性试验,取“2.2”项下供试品溶液和对照品溶液,按“2.1”项下色谱条件进样测定,记录色谱图。精密度试验,取中浓度的混合对照品溶液适量,按“2.1”项下色谱条件连续进样6次,计算芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素峰面积RSD。重复性试验,按“2.2.2”项中方法平行制备供试品溶液6份,按“2.1”项下色谱条件进样测定,计算芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素峰面积RSD。稳定性试验,按“2.2.2”项中方法制备供试品溶液,室温放置,分别于0、3、6、9、12、16、19、21、24 h时按“2.1”项下色谱条件进样测定,计算芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素峰面积RSD。加样回收率试验,按“2.2.2”项中方法制备供试品溶液,分别加入折算质量为本底量的80%、100%、120%的三种水平的混合对照品溶液,每个浓度平行做三份,进行加样回收试验,计算4种黄酮类物质在不同添加浓度下的平均回收率与RSD。
2.4 提取液中黄酮类物质得率的计算
2.4.1 四种黄酮类物质含量测定及得率计算
按“2.2.2”项中方法配制紫叶李叶提取液,根据标准曲线的制备方法测定提取液中芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素4种物质的峰面积,通过“2.3.1”项中的回归方程分别求出提取液中4种物质的质量浓度,按下式计算各物质得率。
W=C×N×V/(M×106)×100%
C:各物质质量浓度,μg/mL;N:提取液稀释倍数;V:稀释前提取液体积,mL;M:紫叶李叶质量,g
2.4.2 黄酮类物质得率计算
根据芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素4种黄酮类物质的生物活性、研究现状及应用前景分别赋予不同权重,分别为0.1、0.2、0.3、0.4。根据上述权重情况计算黄酮类物质的得率,公式为:黄酮类物质得率=矢车菊素-3-O-葡萄糖苷花青素得率×0.4+芦丁得率×0.1+槲皮素得率×0.2+山奈酚得率×0.3。
2.5 单因素试验
设计单因素试验,分别考察液料比(5∶1、10∶1、15∶1、20∶1、25∶1)、乙醇体积分数(50%、60%、70%、80%、90%)、提取温度(30、40、50、60、70 ℃)、提取时间(30、40、50、60、70 min)对黄酮类物质得率的影响。液料比、乙醇体积分数、提取温度、提取时间四个因素的固定水平分别为15∶1、70%、50 ℃、60 min,在对各因素进行单因素试验探究时,其他因素均取固定水平。
2.6 响应面试验设计
采用统计分析软件Design-Expert 8.0.6,运用 Box-Behnken中心组合试验设计原理,基于单因素试验的基础,以液料比、乙醇体积分数、提取温度、提取时间为考察因素,以黄酮类物质得率为响应值,进行响应面试验设计,因素及水平见表2。
2.7 紫叶李叶最佳采收月份的确定
使用最佳工艺制备不同月份(4~12月份)紫叶李叶提取液,按“2.1”项下色谱条件进样测定,通过“2.4”项中计算方法计算出不同月份矢车菊素-3-O-葡萄糖苷花青素、芦丁、槲皮素、山奈酚4种物质的得率及黄酮类物质得率。
2.8 统计分析
3 结果与分析
3.1 标准曲线的绘制和方法学考察结果
3.1.1 标准曲线的绘制
通过对4种对照品溶液进行测定,得到的各标准品的峰面积与质量浓度的线性回归方程见表3。从计算结果来看,矢车菊素-3-O-葡萄糖苷花青素、芦丁、槲皮素、山奈酚4种物质的相关系数分别为0.998 4、0.999 3、1.000 0、0.999 3,说明此4种物质分别在0.010~10、0.025~10、0.010~10、0.025~5 μg/mL范围内峰面积与质量浓度呈现良好的线性关系。
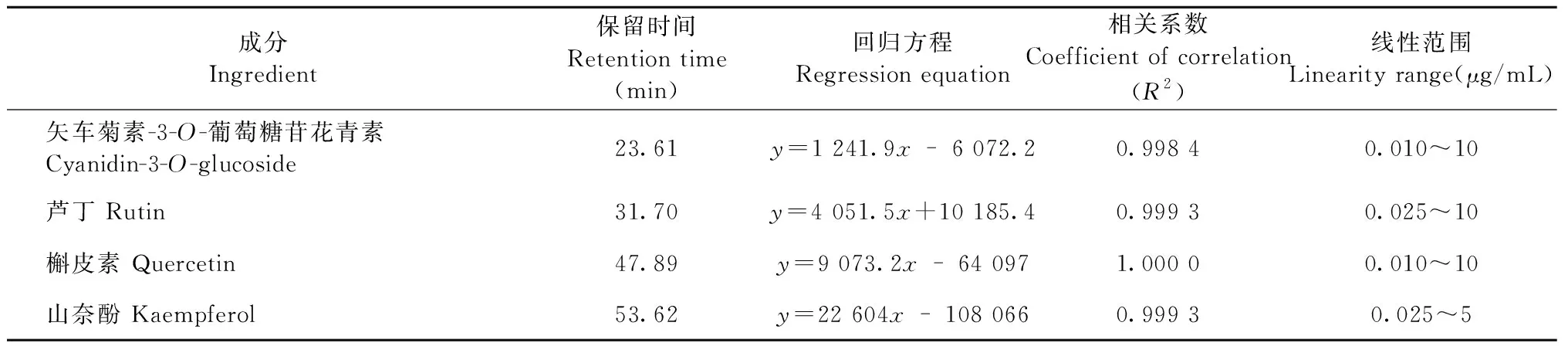
表3 线性回归方程及相关系数
3.1.2 方法学考察结果
系统适应性试验,色谱图见图1,理论塔板数按矢车菊素-3-O-葡萄糖苷花青素峰计不低于5 000,分离度大于1.5,分离良好。精密度试验,芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素峰面积RSD分别为1.37%、2.26%、2.66%、2.99%,表明仪器的精密度良好;重复性试验,芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素峰面积RSD分别为1.56%、2.79%、2.97%、3.13%,表明该方法的重复性良好;稳定性试验,芦丁、槲皮素、山奈酚、矢车菊素-3-O-葡萄糖苷花青素峰面积RSD分别为1.26%、2.34%、2.76%、3.01%,表明供试品溶液室温下放置24 h内稳定;加样回收率试验,4种黄酮类物质在三种不同添加浓度下的平均回收率在85.66%~108.07%之间,RSD<2%。.
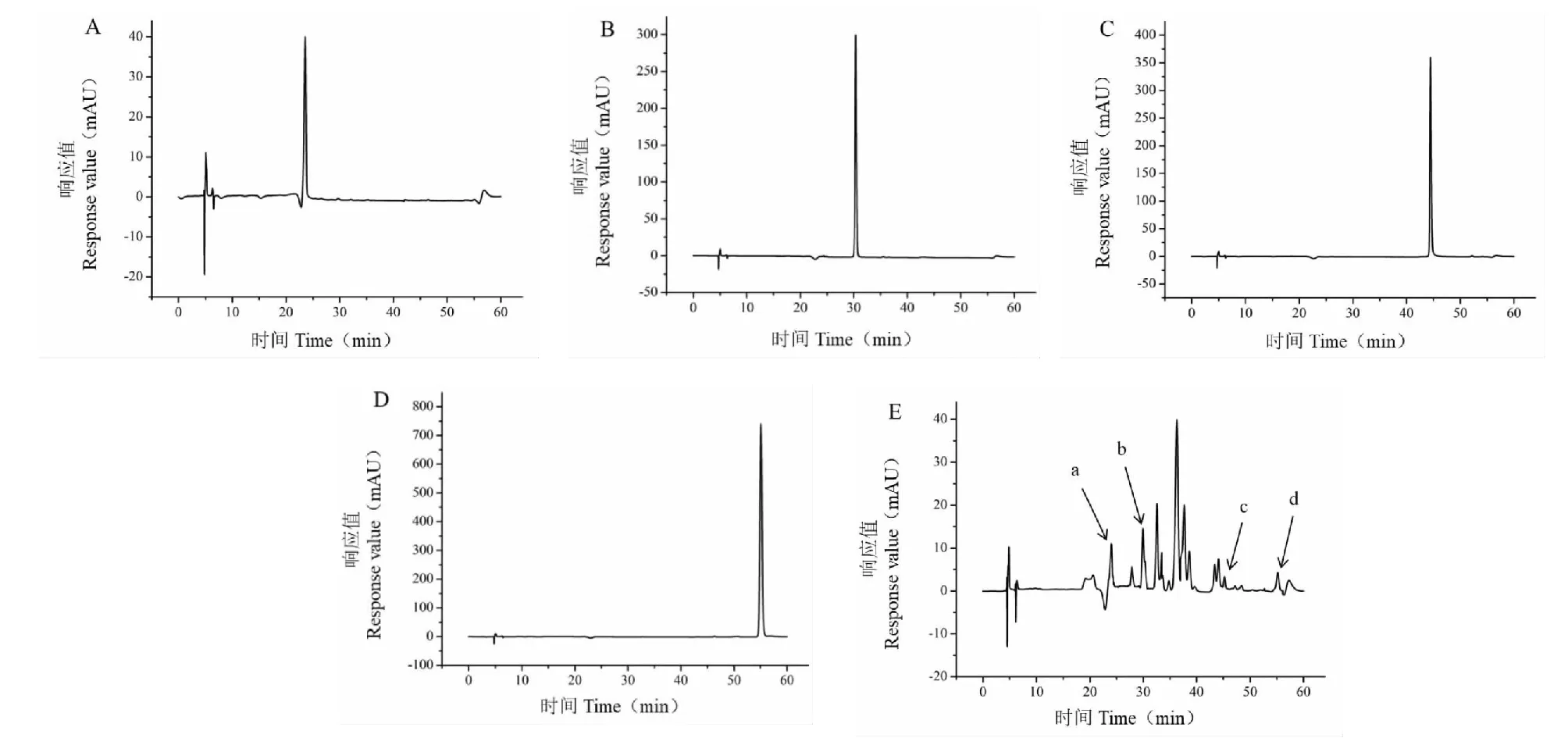
图1 高效液相色谱图Fig.1 HPLC chromatograms注:对照品:(A)矢车菊素-3-O-葡萄糖苷花青素;(B)芦丁;(C)槲皮素;(D)山奈酚。样品:(E)紫叶李叶提取液:(a)矢车菊素-3-O-葡萄糖苷花青素;(b)芦丁;(c)槲皮素;(d)山奈酚。Note:Reference substance:(A) Cyanidin-3-O-glucoside;(B) Rutin;(C) Quercetin;(D) Kaempferol. Sample:(E) Extraction solution of Prunus cerasifera leaves:(a) Cyanidin-3-O-glucoside;(b) Rutin;(c) Quercetin;(d) Kaempferol.
3.2 单因素试验结果
乙醇体积分数对黄酮类物质得率的影响如图2(A)所示,当乙醇体积分数在50%~60%之间时,黄酮类物质得率随乙醇体积分数增加而增加,乙醇体积分数为60%时,黄酮类物质得率达到最大为0.098%±0.000 3%。当乙醇体积分数继续增加时,黄酮类物质得率逐渐降低。液料比对黄酮类物质得率的影响如图2(B)所示,随着液料比的增加,黄酮类物质得率逐渐增加,当液料比为20∶1时,黄酮类物质得率达到最大为0.127%±0.000 5%。之后随着液料比的增加,黄酮类物质得率降低。提取温度对黄酮类物质得率的影响如图2(C)所示,提取温度在30 ℃~50 ℃时,黄酮类物质得率随温度的升高而增加,50 ℃时黄酮类物质得率最大为0.085%±0.000 3%,之后黄酮类物质得率随温度升高而降低。提取时间对黄酮类物质得率的影响如图2(D)所示,随提取时间的延长,黄酮类物质得率先增加后降低。提取时间为50 min时黄酮类物质得率达到最大为0.057%±0.000 2%,提取时间超过50 min后黄酮类物质得率下降。从上述单因素试验结果得出,当其他因素固定时,乙醇体积分数,液料比,提取温度和提取时间分别为60%,20∶1,50 ℃和50 min时,黄酮类物质得率最大。
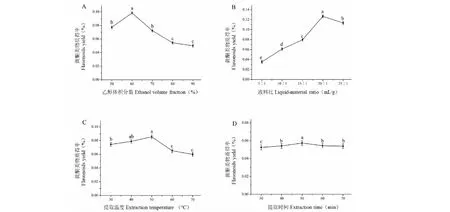
图2 乙醇体积分数、液料比、提取温度、提取时间对黄酮类物质得率的影响Fig.2 Effects of ethanol volume fraction,liquid-material ratio,extraction temperature,extraction time on yield of flavonoids注:图中小写字母表示单因素试验中具有显著差异的不同处理组(P<0.05)。Note:Lowercase letters mean a significant difference among the different treatments at P<0.05 level in single factor test.
3.3 Box-Behnken响应面优化
3.3.1 响应面试验结果与分析
在单因素试验的基础上,选取液料比、乙醇体积分数、提取温度、提取时间4个因素为变量,以紫叶李叶提取液中黄酮类物质得率为响应值,采用Design-Expert 8.0.6统计软件进行4因素3水平试验,结果见表4。
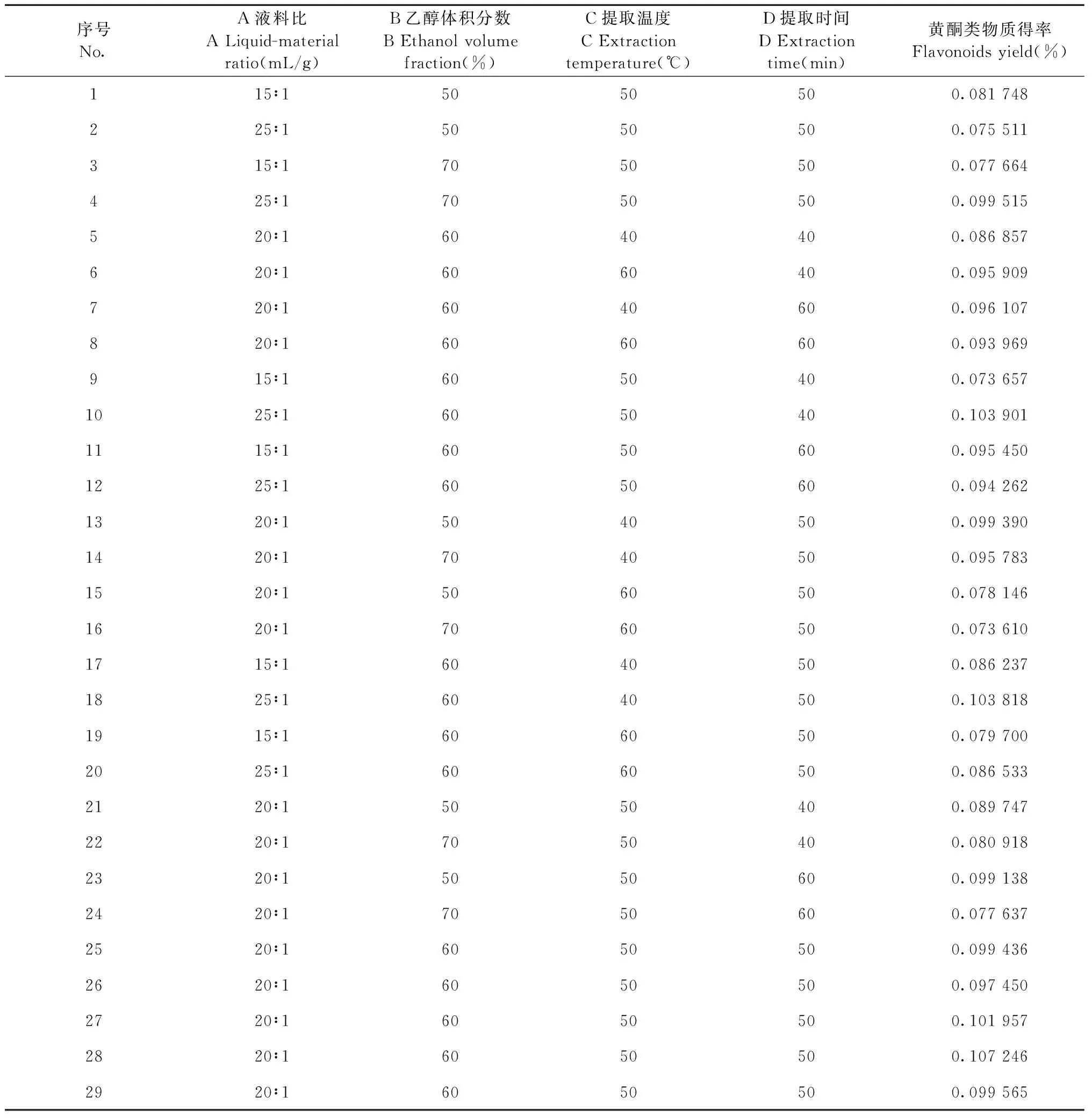
表4 Box-Behnken试验的设计及结果
采用 Design-Expert 8.0.6 软件对试验结果进行二次多元回归分析,对自变量A、B、C、D和黄酮类物质得率进行多元二项式方程拟合。以紫叶李叶中黄酮类物质得率为响应值,经回归拟合后得到的回归方程如下。
Y=0.10+5.757×10-3A-1.546×10-3B-5.027×10-3C+2.131×10-3D+7.022×10-3AB-2.687×10-3AC-7.858×10-3AD-2.322×10-4BC-3.168×10-3BD-2.797×10-3CD-6.866×10-3A2-0.011B2-4.608×10-3C2-3.172×10-3D2。
对回归方程进行方差分析,结果见表5。回归方程显著性检验P<0.05,表明模型具有显著性;失拟项P=0.07>0.05,表明方程拟合程度高,无明显失拟存在,此模型成立。根据表5中F值的大小可以判断4个因素对黄酮类物质得率的影响程度为:液料比>温度>时间>乙醇体积分数。一次项A、C,交互项AB、AD,二次项A2对黄酮类物质得率的影响显著(P<0.05);二次项B2对黄酮类物质得率具有极显著的影响(P<0.01)。
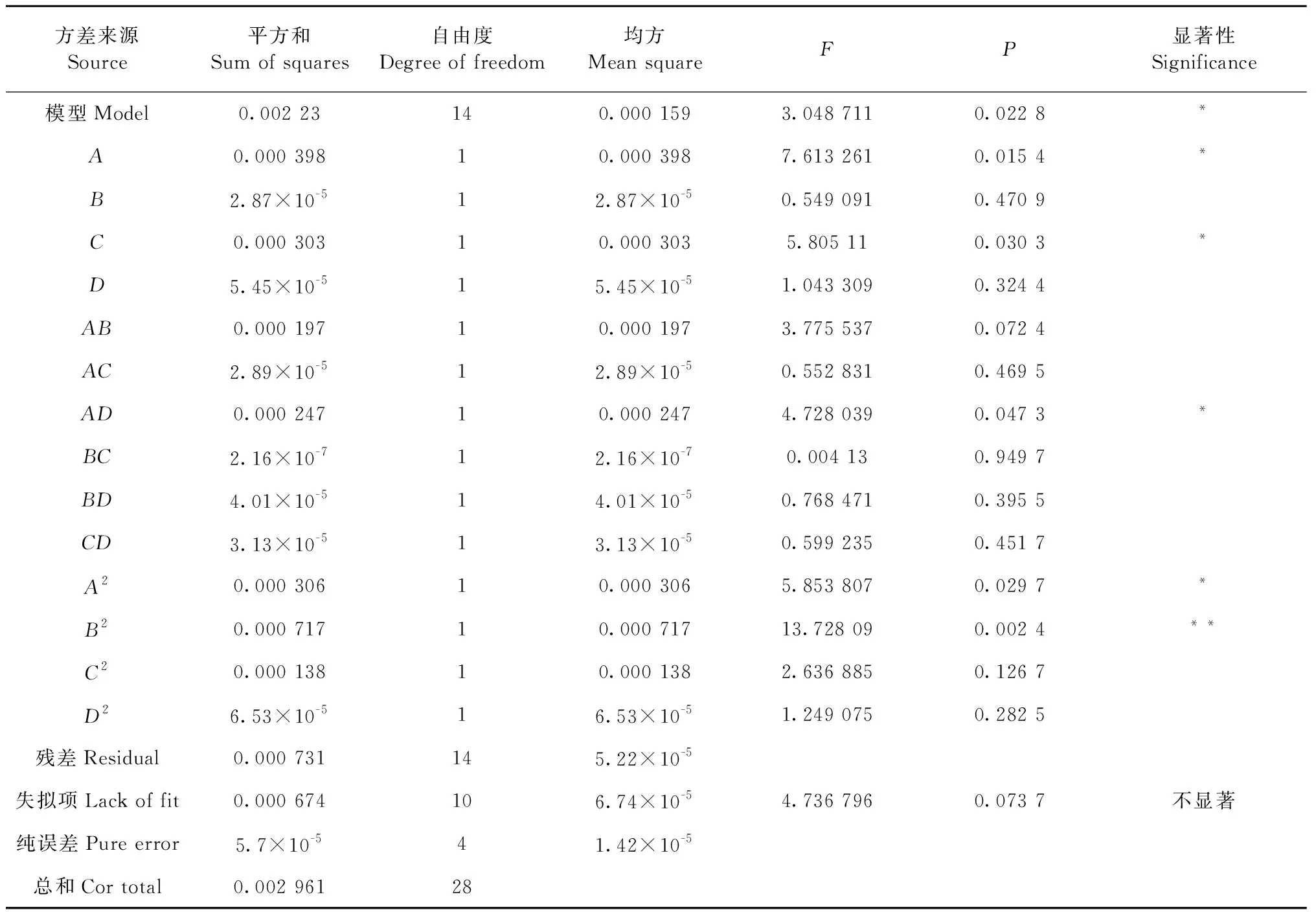
表5 方差分析结果
黄酮类物质得率的响应面图见图3,响应面图可以直观地反映各因素间的交互作用对响应值的影响程度。响应面坡度越陡表示两因素交互作用越大,反之则表示两因素交互作用不显著[14]。可在图3(C)中看出,液料比和提取时间交互项的响应面坡度最陡,说明两因素交互作用显著,而其他因素的交互作用不显著。与表5方差分析结果一致。
经软件分析,提取紫叶李叶中黄酮类物质的最佳工艺条件为乙醇体积分数63.93%、液料比25∶1、提取温度44.08 ℃、提取时间41.62 min,预测黄酮类物质得率为0.105 8%。
3.3.2 验证试验
在接下来的工作中为了便于控制试验条件,将最佳工艺条件调整为乙醇体积分数64%、液料比25∶1、提取温度44 ℃、提取时间42 min。应用此条件做3次平行试验,平均黄酮类物质得率为0.106 2%±0.000 2%。
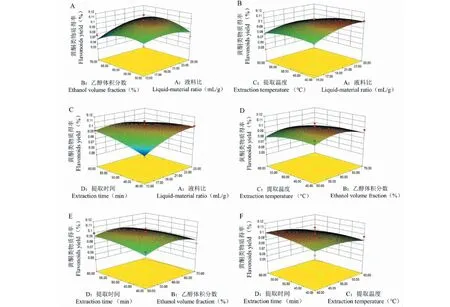
图3 各因素交互作用对紫叶李叶黄酮类物质得率影响的响应面图Fig.3 Responses surface plot showing the interactive effects of different factors on the yield of flavonoids from P. cerasifera leaves
3.4 最佳采收月份的确定
使用软件分析所得的最佳工艺条件处理不同月份的紫叶李叶,并测定提取液中黄酮类物质得率。不同月份紫叶李叶4种黄酮类物质得率变化见图4(A)。在4~12月份,矢车菊素-3-O-葡萄糖苷花青素得率呈波浪形变化,在6、8、12月份较高,8~9月份迅速下降;而芦丁得率总体呈上升趋势,7~8月份迅速升高,在11月份达到峰值,12月份骤降;槲皮素和山奈酚得率受采摘月份影响均不显著。加权后的黄酮类物质得率变化见图4(B),在 4~12月份黄酮类物质得率总体呈波浪形变化,12月份最高,8月份得率仅次于12月份。
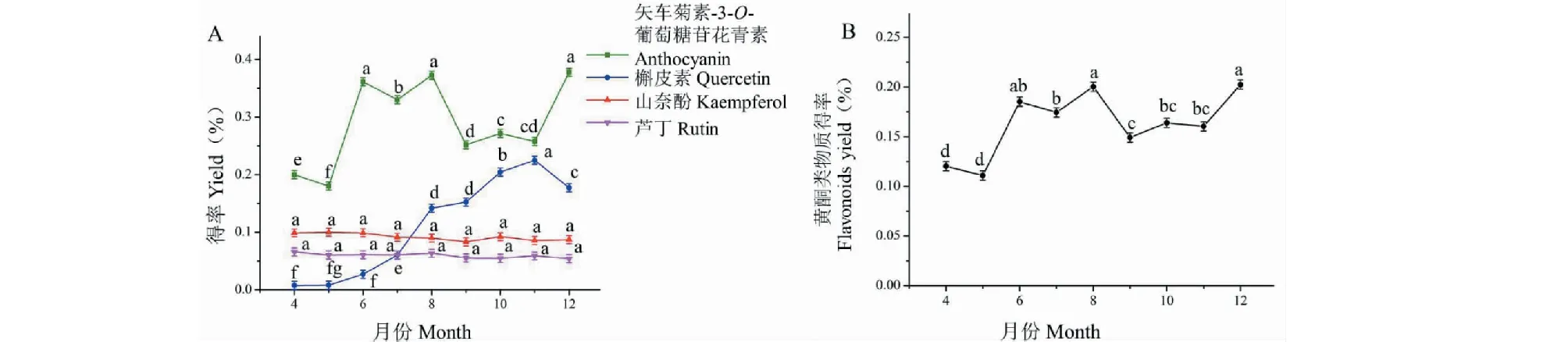
图4 不同月份紫叶李叶中黄酮类物质得率Fig.4 The yield of flavonoids in Prunus cerasifera leaves in different months注:(A)不同月份紫叶李叶中四种黄酮类物质得率;(B)不同月份紫叶李叶中四种黄酮类物质经加权后的得率。Note:(A) The yield of four kinds of flavonoids in Prunus cerasifera leaves in different months;(B) The weighted yield of four kinds of flavonoids in Prunus cerasifera leaves in different months.
4 讨论与结论
本试验对HPLC法中流动相的组成进行了前期考察,结果发现,使用甲醇-1%乙酸为流动相进行测定能够同时对4种黄酮类物质进行很好的分离,且均能达到对称峰型,无拖尾现象发生,理论塔板数较高,亦无其他色谱峰干扰。同时,相关文献[11-13]的实验研究亦表明以甲醇-1%乙酸等为流动相的分离度较好,结果稳定,可信度高。因此,本试验最终确定以甲醇-1%乙酸为流动相,检测波长为360 nm。
本试验采用Box-Behnken分析方法,探讨以紫叶李叶为试验材料,采用超声波法提取黄酮类物质的最佳工艺及其优化。在单因素试验中,采用乙醇溶剂提取,符合黄酮化合物易溶于醇溶剂的特性,同时乙醇体积分数的增加在一定程度上能够提高黄酮类物质得率,但乙醇体积分数过高会溶解更多杂质,这些杂质会与黄酮类物质竞争溶剂导致黄酮类物质的溶解度降低[15,16];对液料比而言,液料比的增加在一定程度上能提高黄酮类物质得率,当液料比增加到一定程度,底物中的其他杂质的溶解度也增大,反而会导致黄酮类物质得率降低[15,17],因此适合的液料比可以有效地溶解黄酮类物质,而且不会造成溶剂的浪费;提取温度方面,适当的提高温度在一定程度上能提高黄酮类物质得率,但温度过高会导致黄酮类物质氧化以及其他杂质溶解度增加,从而导致黄酮类物质得率降低[18,19];合适的提取时间可以提高黄酮类物质得率,过长的提取时间可以使紫叶李叶中杂质也相应的溶出,从而会导致黄酮类物质得率降低。在上述单因素试验的基础上,按照Box-Behnken中心组合试验设计原理,以黄酮类物质得率为响应值,以液料比、乙醇体积分数、提取温度、提取时间为影响因子设计4因素3水平响应曲面试验,对紫叶李叶黄酮类物质提取工艺进行优化,得到的二次回归模型相关性显著(P<0.05),准确度、精密度较高,并得出其最佳提取条件为乙醇体积分数63.93%、液料比25∶1、提取温度44.08 ℃、提取时间41.62 min。同时,还进行了相关的验证试验,结果与预测值接近且重复性好,说明了响应面的Box-Behnken 模型优化紫叶李叶中黄酮类物质提取工艺的效果良好,该条件具有实际意义,将为其进一步的研究开发提供科学依据。
紫叶李叶中黄酮类物质的含量会受成熟度、品种、部位、环境条件、生长季节等的影响,其中以随时间变化有规律可循。紫叶李叶中黄酮类成分主要是花色素,根据史宝胜[20]的研究了解到紫叶李叶花色素含量的变化主要受光照和温度的影响,当温度在15 ℃时,相关酶的活性显著增强,所以花色素的含量会呈现上升趋势,但温度大于35 ℃时,酶活性会受到抑制,花色素的含量会受到影响,甚至会导致花色素的分解。光照对花色素含量的影响较大,涉及的原因较多,一般是在春秋两季节花色素含量较多,夏季含量较少,因此7月份花色素含量下降是合理的。根据保定市气象局记录[21],保定市的光照强度也呈现波浪式变化,在2~5月呈上升趋势,5~7月呈下降趋势,而温度在6月的下半个月基本上升到30 ℃以上,7月后温度继续升高,甚至会达到40 ℃的高温,酶活性严重受到影响。而保定的雨季也基本集中在7、8两个月,雨季天空云较多,对光照也有影响。8~10月光照时间又是一个先上升后下降的趋势,温度在9月以后也基本转凉,因此紫叶李叶中黄酮类物质的得率总体呈现波浪形是合理的。
根据最佳采收月份的试验结果和上述的分析表明,12月份黄酮类物质得率应高于8月份得率,但12月份紫叶李叶生长状况差,难以大量收集,而8月份紫叶李叶生长旺盛。综合考虑不同月份紫叶李叶中4种黄酮类物质得率以及加权后的黄酮类物质得率动态累积变化情况、紫叶李叶的生长状况,最终确定8月份为最佳采收月份。这样既能保证矢车菊素-3-O-葡萄糖苷花青素、芦丁、槲皮素、山奈酚4种物质得率达到较高水平,又能保证加权后的黄酮类物质得率达到高峰。这与其生长发育及所处的月份有关,而这种变化的机理有待于进一步的深入研究。
本试验所采用的方法学对4种黄酮类物质的分离良好,且方法重复性高,稳定性好,具有较好的准确性。通过单因素试验确定了液料比、乙醇体积分数、提取温度和提取时间 4 个因素的最佳取值范围,建立了紫叶李叶中黄酮类物质得率的响应值与多因素之间的回归方程模型,确定其最佳提取工艺为乙醇体积分数63.93%、液料比25∶1、提取温度44.08 ℃、提取时间41.62 min。使用最佳提取工艺处理不同月份紫叶李叶,通过权重公式计算黄酮类物质得率,最终确定紫叶李叶最佳采收月份为8月份。该试验对后期相关具体成分的提取具有一定的借鉴意义,并对紫叶李的进一步开发利用具有一定的科学价值。

