腹腔镜手术治疗胃肠道间质瘤的效果及预后分析
李亚平,朱明杰,蒋鸿元
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是临床最常见的间叶源性消化道肿瘤,发病率为0.6%~3%,其中60%~70%的GIST发生于胃,20%~30%GIST发生于小肠,还可见于食管、结直肠及腹膜等部位[1-2]。GIST生物学行为可为良性或恶性,缺少统一病理分级标准。目前临床上多根据GIST的肿瘤最大直径、有丝分裂计数和肿瘤起源部位等分类指标进行危险度评估,并为其治疗方案选择和预后判断提供参考依据[3]。GIST以多学科治疗(multidisciplinary team, MDT)为基础,由于其对放化疗敏感性较差,分子靶向药物治疗尚在发展阶段,故根治性手术被认为是现阶段的最佳治疗手段,肿瘤直径>2 cm或直径≤2 cm但存在高危因素的GIST患者应及时手术切除,并尽可能保证切缘阴性以避免二次手术[4-5]。随着微创外科技术的发展,腹腔镜在腹部疾病中应用逐渐增多,本研究探讨了腹腔镜手术和开腹手术治疗GIST的效果及预后情况,旨在为临床选择合理手术方案提供依据。现报告如下。
1 资料与方法
1.1一般资料 回顾性分析我院2011年6月—2014年6月收治的157例GIST患者的临床资料。①纳入标准:术后病理确诊为GIST;术后能完成随访且患者临床资料保存完整;患者及家属知晓本研究并签署同意书。②排除标准:合并其他类型原发恶性肿瘤;已发生远处转移者。根据手术方案将患者分为腹腔镜组84例和开腹组73例。腹腔镜组男38例,女46例;年龄43~79(61.27±10.38)岁,肿瘤直径<5 cm者61例,≥5 cm者23例;病灶位置:胃57例,小肠18例,直肠9例;肿瘤风险分级[6]:高风险16例,中风险25例,低风险43例。开腹组男31例,女42例;年龄45~76(60.74±10.63)岁,肿瘤直径<5 cm者56例,≥5 cm者17例;病灶位置分别为胃52例,小肠13例,直肠8例;肿瘤风险分级高风险11例,中风险23例,低风险39例。2组性别、年龄、肿瘤直径、病灶位置等比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 2组患者术前均完善血生化、影像学及内镜等相关检查并做好术前准备,均采用气管插管全身麻醉。腹腔镜组患者取仰卧分腿位,常规于脐下缘穿刺,建立CO2人工气腹并维持压力为12~14 mmHg,脐部作10 mm切口为观察孔,然后根据肿瘤位置选择左侧或右侧锁骨中线肋缘下2~4 cm处为操作孔,采用30°腹腔镜探查腹腔和盆腔情况,明确肿瘤位置、大小及形态并选择适当手术方式进行切除,将标本自脐部切口取出送病理科进行冷冻切片和石蜡切片检查。开腹组患者取仰卧位,作腹部正中切口并自边缘2~3 cm处切除肿瘤组织送病理检查。2组术后均给予胃肠减压、腹腔引流及抗感染治疗,患者排气后拔除胃管并进流质饮食,次日根据引流情况酌情拔除引流管。
1.3观察指标 ①围术期指标:记录2组手术时间、术中出血量、排气时间、引流时间及住院时间等。②并发症:比较2组术后切口感染、肺部感染及吻合口瘘等发生率。③预后情况:2组术后均随访5年并观察患者总体生存率(OS)和无复发生存率(RFS),同时比较不同部位和不同危险分级GIST患者随访期间OS和RFS。
2 结果
2.1围术期指标比较 腹腔镜组手术时间、术中出血量、排气时间、引流时间及住院时间均少于开腹组(P<0.05)。见表1。

表1 2组GIST患者围术期指标比较
2.2术后并发症比较 腹腔镜组术后并发症总发生率低于开腹组(P<0.05)。见表2。

表2 2组GIST患者术后并发症比较[例(%)]
2.3随访期间生存情况比较 2组术后5年OS分别为85.71%、79.52%,RFS分别为72.60%、65.81%。2组5年OS和RFS比较差异无统计学意义(P>0.05)。见图1。
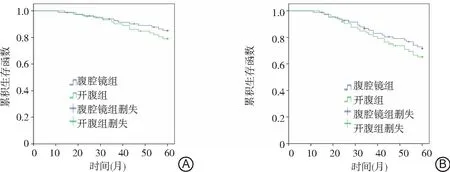
图1 2组GIST患者随访5年OS和RFS比较A. 2组GIST的OS比较; B.2组GIST的RFS比较;GIST为胃肠道间质瘤,OS为总体生存率,RFS为无复发生存率
2.4不同部位GIST患者随访期间生存情况比较 157例GIST患者中发生于胃部占69.43%(109/157),该部位患者的5年OS为86.20%,RFS为74.30%;发生于小肠及直肠占30.57%(48/157),该部位OS、RFS分别为75.04%和58.30%。小肠及直肠GIST患者的RFS显著低于胃GIST(P<0.05),但二者OS比较差异无统计学意义(P>0.05)。见图2。
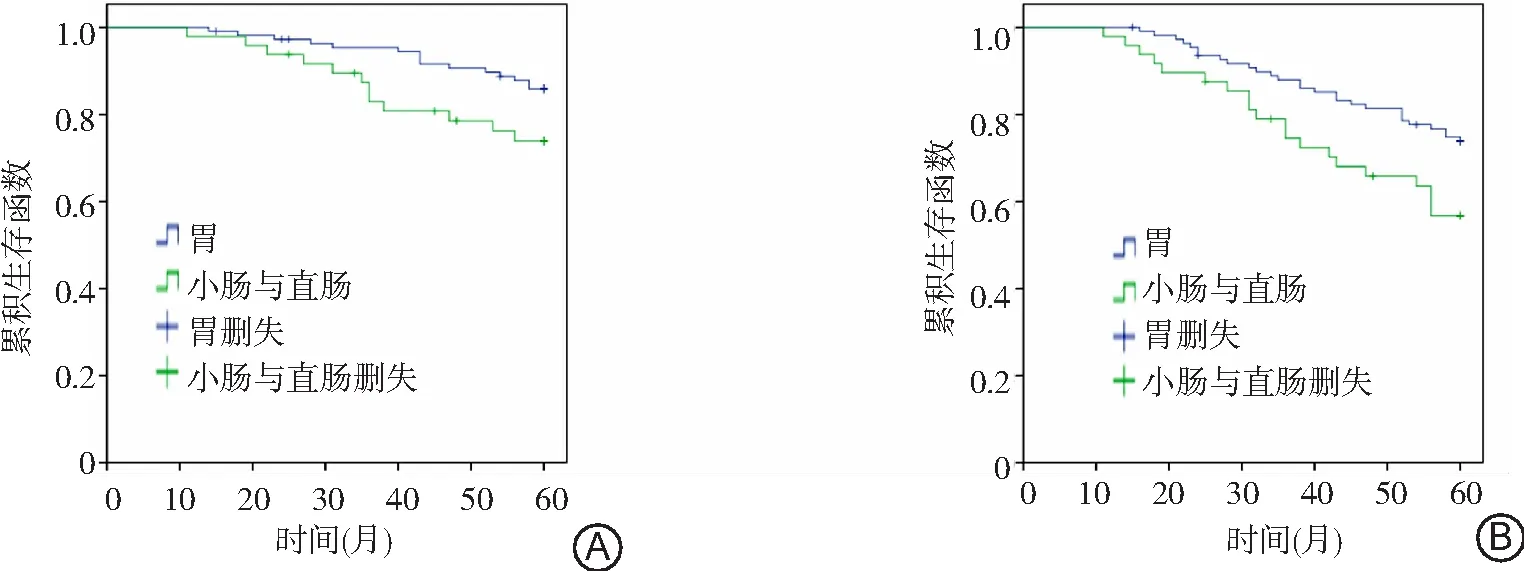
图2 不同位置GIST患者随访5年OS和RFS比较A.不同部位GIST的OS比较;B.不同部位GIST的RFS比较;GIST为胃肠道间质瘤,OS为总体生存率,RFS为无复发生存率
2.5不同危险分级GIST患者随访期间生存情况比较 157例GIST患者的风险度分别为高风险17.20%(27/157),中风险30.57%(48/157),低风险52.23%(82/157),3组5年OS分别为65.41%、83.32%和89.22%,RFS分别为51.90%、66.71%和76.82%。中、高风险GIST患者5年OS和RFS均低于低风险GIST患者,且高风险GIST患者低于中风险GIST患者(P<0.05)。见图3。
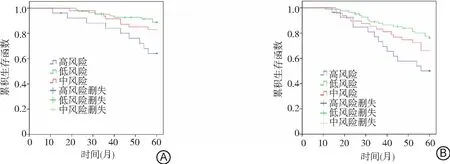
图3 不同危险分级GIST患者随访5年OS和RFS比较A.不同危险分级GIST患者OS比较;B.不同危险分级GIST患者RFS比较;GIST为胃肠道间质瘤,OS为总体生存率,RFS为无复发生存率
3 讨论
1983年Mazur和Clark对27例胃壁间叶来源肿瘤进行免疫组化分析并提出GIST概念,该类患者缺乏特异性临床表现,早期常无明显自觉症状,其诊断主要依据影像学检查、免疫组化和基因检测[7-8]。GIST可见于各年龄段,但50岁以上患者占比超过80%,不同国家和地区发病率存在一定差异,总体约为1/10万,近年来随着影像学和病理诊断技术的不断发展,其检出率呈明显上升趋势,因此探讨更为安全有效的GIST治疗方案具有重要临床意义[9]。
目前GIST常用手术方案包括腹腔镜、内镜和开放手术,内镜的疗效与开腹手术相当,且在术中出血量和术后康复速度方面均具有明显优势,但内镜平均切除直径仅1.7 cm,因此多用于直径<2 cm的患者治疗[10-12]。随着腹腔镜技术的快速发展,其在GIST病灶切除中的效果已获得认可,腹腔镜手术较传统开腹手术具有创伤小和康复快等微创优势。近年来国内外均有报道称腹腔镜可用于直径≥5 cm的GIST切除且2010年后NCCN指南已不再将肿瘤体积列为禁忌证[13-14]。腹腔镜GIST手术根据肿瘤位置和大小可采用不同术式,以胃楔形切除、胃大部切除或全胃切除等应用较为广泛。本研究结果显示,腹腔镜组手术时间、术中出血量、排气时间、引流时间及住院时间均明显少于开腹组,且术后并发症发生率较开腹组明显降低,切口感染、肺部感染、术后出血、吻合口瘘及肠梗阻发生情况较少。表明腹腔镜手术治疗GIST有利于减轻手术创伤和并发症,对促进患者术后康复具有积极作用,与Pelletier等[15]、Cui等[16]报道结果基本一致。GIST患者预后情况普遍较好,Ntahompagaze等[17]报道,腹腔镜手术和开腹手术后1、3、5年生存率分别为98.5%、92.9%、87.4%和91.7%、85.2%、76.8%,两种手术方案患者预后相近。本研究结果显示,腹腔镜组和开腹组5年OS分别为85.71%、79.52%,RFS分别为72.60%、65.81%,2组整体生存情况比较差异无统计学意义。表明腹腔镜手术治疗GIST临床效果与开腹手术相当。
GIST预后与生物学行为关系密切,目前主要综合肿瘤解剖形态、组织病理和临床症状等多方面进行危险度评估来判断预后情况,以美国国立卫生研究院(NIH)共识方案应用较为广泛,其评估内容大致包括肿瘤最大径、有丝分裂计数和起源部位等方面,胃部GIST生物学行为大多呈一定惰性,但小肠和直肠等部位GIST则具有较强侵袭性,可能导致患者术后复发或转移风险增加[18-19]。本研究结果显示,胃部患者术后5年OS为86.20%,RFS为74.30%;小肠及直肠患者术后5年OS为75.04%,RFS为58.30%,且2组RFS比较差异有统计学意义,表明胃部GIST患者预后情况相对更好。李鹏等[20]研究认为肿瘤直径及核分裂象是GIST患者预后重要危险因素,而两者均是NIH危险分级的主要内容。本研究结果显示高、中、低风险GIST患者术后5年OS分别为65.41%、83.32%和89.22%,RFS分别为51.90%、66.71%和76.82%,三者间比较差异均有统计学意义。表明随着危险程度增加,GIST患者远期存活率明显降低,因此对高风险GIST患者术后应加强随访,观察肿瘤有无复发或转移,并及时给予合理干预。
综上所述,腹腔镜手术与开腹手术治疗GIST均具有良好效果,且腹腔镜具有减轻手术创伤和并发症等微创优势。另外胃部和高危险度GIST患者预后情况相对较差,术后需加强随访。

