预后营养指数与肝癌患者住院天数的相关性
何伟锋
(惠州市第一人民医院,广东 惠州 516001)
肝癌是全球最常见的恶性肿瘤之一,占肿瘤死亡第三位[1]。随着科学生物工程技术的发展,癌症早期可以进行放疗、化疗、生物治疗等。在患者身体条件允许的情况下,手术仍然是实体瘤治疗的最重要方式。肝癌患者术后营养不良的风险极高,其发生率高达74.36%[2]。肝癌患者围手术期的营养、生物免疫状态与术后预后及远期结局存在相关关系[3]。
营养评估指标包括人体体成分分析、皮褶厚度、上臂围、上臂肌围、实验室生化指标等。在众多指标中,Onodera's预后营养指数(prognostic nutritional index,PNI)仅用血清白蛋白及外周血总淋巴细胞计数两项计算得出,在临床应用中是最方便和最省时的一种方法[4]。Onodera's 预后营养指数被认为是一个较全面的用于评估患者机体状态的指数,因为血清白蛋白和总淋巴细胞计数可以反映营养、炎症及免疫情况[5]。Onodera's 预后营养指数最开始用于结肠癌等胃肠手术,评估手术耐受性、风险性,预测不良结局。近年来,有文献提出,Onodera's 预后营养指数可以用来预测肝细胞癌的生存率和总体生存期,并可以作为预后的独立影响因子[6-7]。本研究欲通过比较肝癌患者术前术后PNI,找到评估肝癌患者围手术期营养状况的准确时间节点,为整个围手术期的营养治疗提供依据。
1 资料与方法
1.1 临床资料:本研究收集了惠州市第一人民医院肝胆小儿外科在2018年1月至2019年6月收治的首次接受肝癌切除术的52例原发性肝癌患者资料。患者的基线资料见表1。手术方式包括肝段切除、肝叶切除和半肝切除。纳入标准:①行肝癌肝切除患者;②术后切除标本经病理证实为肝细胞肝癌患者;③病例资料完整者。排除标准:①合并其他原发肿瘤者;②病例信息不完整者;③死亡原因与原发肿瘤无关者;④合并影响淋巴细胞计数或血清白蛋白含量的其他疾病者。通过本单位医学伦理委员会的审查。
1.2 PNI的计算公式及分组:PNI=血清白蛋白值(g/L)+5 ×总淋巴细胞计数(109/L)[4]。依时间分为术前(PNI-0)、术后第1天(PNI-1)、术后第3天(PNI-3)、术后第7天(PNI-7)四组。

表1 肝癌患者的基本资料

表2 肝癌患者术前及术后第1、3、7天的白蛋白水平及总淋巴细胞计数
2 结果
2.1 肝癌患者基础资料的描述:患者中位年龄为59岁;男性患者42例,占比80.8%;女性患者10例,占比19.2%。住院期间未出现死亡病例。平均住院天数为21.21 d。见表1和表2。
2.2 肝癌患者围手术期预后营养指数的动态分析:本研究统计术前及术后第1、3、7天的PNI值并分析,发现四组间存在的差异具有统计学意义(F=170.021,P=0.000)。同时进一步两两比较,两组间差异均有统计学意义(P=0.000)。我们发现,相比术前的PNI值,肝癌患者术后第1天的PNI值明显下降;术后第1、3、7天PNI值呈上升趋势。见表3。

表3 肝癌患者术前及术后第1、3、7天的PNI值
2.3 肝癌患者围手术期预后营养指数与住院天数的相关性分析:进一步我们采用Pearson相关分别分析四个时间点的PNI值与住院天数的相关性。研究发现,术前PNI值与住院天数成负相关,相关系数绝对值为0.6,具有统计学意义(P=0.000);术后第1、3、7天的PNI值与住院天数的相关性分析无统计学意义,但相关系数成递减趋势。见表4。

表4 肝癌患者术前及术后第1、3、7天PNI值与住院天数的相关性分析
2.4 术前 PNI最佳截点:本研究术前PNI值的ROC曲线下面积为0.805,面积的95%可信区间为(0.597-0.979),P=0.005,术前PNI值用于判断住院天数有统计学意义。当PNI值为51.1450时,灵敏度为0.8,特异度为0.81。见图1。
3 讨 论
根据2015年国际癌症研究署公布的数据,虽然我国肝癌的高发率在全球排第七位,但基于我国庞大的人口数(2019年14亿),中国仍然是世界肝癌患者的数量大国[8]。过去20年来,乡村的肝癌病死率明显下降,而城市的肝癌病死率稳定[9]。肝硬化和肝癌是肝病相关住院的主要原因。肝癌的高发率与这几十年来日新月异的科学及肝病的系统性、规范化诊疗明显相悖[10]。肝癌的治疗方式有放疗、化疗、介入、综合治疗等,但手术仍然是最重要的。手术会造成应激、糖利用障碍和负氮平衡[11],影响术后并发症的发生。肝癌患者较其他肿瘤患者具有额外的代谢紊乱风险,因此围手术期的营养状态的动态评估尤为重要。
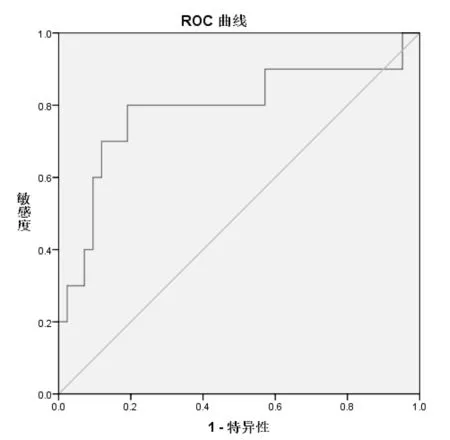
图1 预后营养指数的受试者工作特征曲线(ROC)
本院肝胆外科收治的肝癌患者术后未有死亡病例,平均年龄59岁,男性占总人数的80.8%。术前前白蛋白的均值及白蛋白的均值分别为0.18 g/L、41.25 g/L,基本在正常范围的下限。前白蛋白是主要在肝脏合成的一种糖蛋白,半衰期为2~4 d[12],主要生理功能是转运甲状腺素和维生素A,前白蛋白迅速的转化速率使其及时反映营养状况,临床上常用来评价蛋白质-能量营养不良和反映近期膳食摄入状况,特异性地反映肝细胞的功能[13]。白蛋白是血浆中含量最多的蛋白质,可用于预测手术风险程度及反映疾病的严重程度[14]。总体来看,研究对象术前的机体状态尚可,这为其术后康复奠定基础。
近年来众多文献报道,PNI与多种肿瘤(胃癌、结直肠癌、胰腺癌、肝癌)的术后生存预后相关[15-18]。本研究将肝癌患者围手术期不同时间节点的PNI进行动态统计分析,发现不同时间点的PNI的差异存在统计学意义(表3),与术前PNI相比,术后第1、3、7天的PNI均下降,这与手术切除肿瘤组织对肝脏的损伤引起的白蛋白降低有关。此外观察到术后三组PNI呈上升趋势。随着时间推移,术后抗感染及自身机体功能(免疫功能、肝脏修复)的调节,白蛋白、总淋巴细胞数逐渐增加(表3),PNI增加。随后我们将不同时间点的PNI与住院天数进行pearson相关分析,发现术前PNI值与住院天数成负相关,相关系数为-0.6(表4),低PNI值患者住院时间越长,延长病床周转率,增加住院费用。在我国,每例肝癌患者的平均医学诊疗费用已增加到4.0386万元[19]。为了找到术前PNI值的最佳界点,我们通过ROC分析,确定肝癌患者术前PNI的最佳截点值为51.1450。
综上所述,本研究的数据分析表明,常规统计记录术前肝癌患者的PNI并以51.1450作为截点值十分必要且具有重要意义。医护人员对术前PNI低于51.1450的患者应及时告知责任营养医师,运用多学科合作理念进行围手术期营养干预,使患者达到更佳的术前状态,以减少术后并发症、感染等的发生,缩短住院时间、减少住院费用。

