外源壳寡糖对唐古特白刺抗旱性的影响
石欣隆 杨月琴 侯小改 薛娴 李明聪 段明铅 霍建华 曾繁梓


摘要:为明确壳寡糖(chitooligosaccharide,COS)对干旱下唐古特白刺(Nitraria tangutorum)相关生理特性的影响,以两年生唐古特白刺为研究对象,设置对照组(蒸馏水)和COS处理组(40 mg/L),对唐古特白刺叶片进行整株喷施,测定不同干旱条件下(即断水后第11、13、15、17、19 d)植株的相关生理指标。结果表明,与对照组相比,断水第13 d及以后,COS处理组叶片的相对含水量提高12.76%~17.38%,叶绿素含量提高21.76%~45.46%,电解质外渗率降低14.20%~28.36%,丙二醛含量降低19.13%~25.30%,可溶性糖含量提高20.44%~36.85%,可溶性蛋白含量提高8.19%~23.19%,脯氨酸含量提高10.55%~32.34%;断水第15 d以后,COS处理组叶片超氧化物歧化酶活性提高22.85%~41.87%,过氧化物酶活性提高13.51%~25.80%,过氧化氢酶活性提高19.11%~28.50%。在不同断水时期,外源COS可显著提高唐古特白刺植株的相对含水量、叶绿素含量、渗透调节物质含量和抗氧化酶活性,同时明显降低了叶片电解质外渗率和丙二醛含量。
关键词:壳寡糖;唐古特白刺;干旱胁迫;叶绿素;抗氧化酶;渗透调节物质
中图分类号: S718.43文献标志码: A文章编号:1002-1302(2020)13-0172-06
收稿日期:2019-11-21
基金项目:国家自然科学基金(编号:U1804233);河南省自然科学基金(编号:162300410105);河南科技大学学科提升振兴A计划(编号:13660001);河南科技大学2017-2018学年实验技术开发基金(编号:SY1718052)。
作者简介:石欣隆(1994—),男,河南林州人,硕士研究生,主要从事植物生理生态学研究。E-mail:975184724@qq.com。
通信作者:杨月琴,博士,副教授,主要从事生态学和药材资源开发利用研究。E-mail:yyqyxf@126.com。干旱影响植物生长发育。研究发现,某些植物生长调节物可以增强植物对干旱、冷害、高盐等非生物胁迫的耐受性[1-4],使植物在同等逆境胁迫下生命力更旺盛,更有竞争力。壳寡糖(chitooligosaccharide,COS)是由壳聚糖通过降解得到的一种低聚糖,因具有高效、环保、来源广的特性被大量用于农业生产[5-6]。研究表明,干旱下,外源COS能提高植物葉片相对含水量,降低电解质外渗率,减少过氧化有害产物积累量,从而减小干旱对植物细胞膜系统及大分子生命物质的损伤[7];也能诱导光系统Ⅱ最大化光化学效率(Fv/Fm),明显提高光化学荧光猝灭系数(qP)和光系统Ⅱ电子传递量子产量(ΦPSⅡ)[8],增加可溶性糖(soluble sugar,SS)、可溶性蛋白(soluble protein,SP)、脯氨酸(prolin,Pro)等渗透调节相关代谢产物含量,从而改变细胞质膜的相对渗透率[9],增强植物耐旱性;还能提高植物体内超氧化物歧化酶(superroxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等保护酶活性[10],从而提高植物对干旱的抵抗能力。
唐古特白刺(Nitraria tangutorum)为蒺藜科(Zygophyllaceae)白刺属(Nitraria L.)的一种多年生小灌木,抗逆性强,经济价值高,是我国西北部和北部干旱地区的主要建群种[11-13]。近年来,国内外学者对唐古特白刺的品种选育和鉴定[14]、表型性状评价和种质遗传多样性[15]、栽培管理技术[16]等方面进行了研究,在唐古特白刺抗逆性方面也有涉及,祁迎林综述了唐古特白刺抗旱性、抗盐碱性、抗风沙性及开发价值[17]。杜玉玲研究了外源水杨酸对盐胁迫下唐古特白刺活性氧(reactive oxygen species,ROS)代谢及抗坏血酸-谷胱甘肽(AsA-GSH)循环的影响[18]。Yang等研究了盐对白刺愈伤组织中抗氧化酶的影响[19]。杨颖丽研究了硝普纳处理对白刺愈伤组织膜脂过氧化及抗氧化酶活性的影响[20]。但是国内外关于COS对干旱下唐古特白刺幼苗生理特性的影响鲜有报道。
本研究采用逐渐干旱[21]的方式,研究不同断水条件(断水后11、13、15、17、19 d)下叶面喷施COS对两年生盆栽唐古特白刺抗旱性的影响,探讨外源COS促进植物生长、提高植物干旱适应性的作用机制,以期阐明唐古特白刺抗旱机制,为进一步提高唐古特白刺抗旱性寻找新的途径和方法。
1材料和方法
1.1试验材料
供试唐古特白刺(Nitraria tangutorum)为两年生播种苗,由青海省乌兰县农场提供,2016年4月定植于花盆(口径20 cm,高20 cm)中,以等量纯净河沙作为栽培基质,每盆1株,用Hoalglands完全营养液浇灌并在温室(25 ℃)中培养。供试壳寡糖购自上海圻明生物科技有限公司,分子量<3 000,为浅色或微黄色粉末,易溶于水,是以丰富的海洋生物资源(虾、蟹壳)为原料,通过先进的生物酶降解技术得到的聚合度低于20的低聚糖,由氨基葡萄糖以β-1,4糖苷键连接而成,又称β-1,4-寡聚-葡萄糖胺或几丁寡糖。
1.2试验设计
试验在河南科技大学农场进行,于2016年5月25日浇透水后进行逐渐干旱[21-22],设置2个处理组:CK组(对照组)和COS处理组,每组处理20盆植株。断水5 d后,采用整株喷施法连续3 d喷施蒸馏水(CK)和COS溶液(40 mg/L,该浓度在预试验下效果最佳),以叶片上下表面滴水为标准[23],每株喷施量约为20 mL。喷施结束2 d后开始取样,每次取3株,取样时间为09:00—10:00,取叶部位为基径以上20~50叶,以后每2 d取样1次,即断水后11、13、15、17、19 d取唐古特叶片进行相关指标测定,备用叶片置于-80 ℃冰箱内保存。
1.3测定指标与方法
1.3.1叶片相对含水量采用饱和含水量法[24]测定叶片相对含水量(relative water content,RWC)。
RWC=[(FW-DW)/(TW-DW)]×100%。
式中:FW为叶片鲜质量;TW为吸水24 h后的叶片质量;DW為80 ℃下烘干48 h后的叶片质量。
1.3.2叶绿素含量采用丙酮法[24]测定叶绿素含量(chlorophyll content)。
1.3.3叶片电解质外渗率和丙二醛含量电解质外渗率(electrolyte leakage)采用电导仪法,用DD3-307型电导率仪测定;丙二醛(malondialdehyde,MDA)含量采用用硫代巴比妥酸法测定[25]。
1.3.4叶片保护酶活性超氧化物歧化酶活性采用氮蓝四唑比法测定;过氧化物酶活性采用愈创木酚氧化法测定,以1 min内D470 nm增加0.01为1个酶活性单位(U);过氧化氢酶活性采用紫外分光光度法测定,以1 min内D240 nm减少0.1为1个酶活性单位(U)[25]。
1.3.5叶片渗透调节物质采用蒽酮乙酸乙酯法测定可溶性糖含量;采用考马斯亮蓝G250法测定可溶性蛋白含量;采用磺基水杨酸法测定脯氨酸含量[24-25]。
1.4数据处理
采用Excel 2010整理数据,SPSS 19.0分析软件进行LSD显著性检验,Origin 2018绘图。
2结果与分析
2.1COS对干旱下唐古特白刺叶片相对含水量的影响
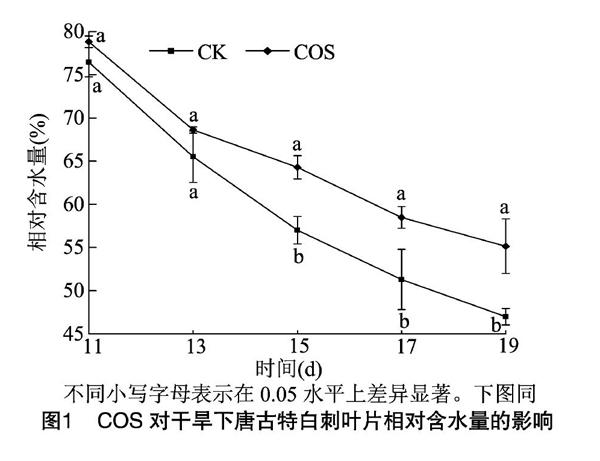
随着断水时间的延长,唐古特白刺叶片相对含水量逐渐降低。由图1可知,相同断水时间内,COS处理组叶片相对含水量较CK组分别提高3.11%、14.75%、12.76%、14.01%和17.38%;断水后第11、13天2处理下叶片相对含水量差异不显著;断水后15、17、19 d,COS处理组叶片相对含水量显著高于同时期CK组,另外,试验中观察发现,断水后第19天COS处理组唐古特白刺生长正常,而CK组出现萎蔫(叶片含水量46.98%)现象,说明随着干旱程度的加剧,叶面喷施COS能显著提高唐古特白刺叶片的保水能力。
2.2COS对干旱下唐古特白刺叶片叶绿素含量的影响
随着断水时间的延长,CK组和COS处理组唐古特白刺叶片叶绿素含量均呈先上升后下降趋势(图2)。相同断水时间内,COS处理组叶绿素含量均高于CK组,特别在断水后13、15、17、19 d,COS处理组叶片叶绿素含量比同时期CK组分别显著提高了21.76%、28.31%、32.94%、45.46%,表明断水条件下,叶面喷施COS可显著增加唐古特白刺叶片的叶绿素含量。
2.3COS对干旱下唐古特白刺叶片电解质外渗率和MDA含量的影响
随着断水时间的延长,COS处理组和CK组唐古特白刺植株叶片的电解质外渗率和MDA含量均呈现上升趋势(图3)。与CK组相比,断水后第11和13天,COS处理组唐古特白刺叶片电解质外渗率差异不显著,断水后15、17和19 d,分别显著降低了14.20%、20.68%和28.36%(图3-A);断水后第11天,唐古特白刺叶片MDA含量差异不显著,断水后13、15、17、19 d,分别显著降低了21.58%、19.13%、23.76%、25.30%(图3-B)。说明在干旱下叶面喷施COS能减小唐古特白刺植株叶片电解质外渗率,减少细胞膜脂过氧化产物生成量,且在断水中后期,外源COS对唐古特白刺叶片电解质外渗率和MDA含量的影响达到显著水平。
2.4COS对干旱下唐古特白刺叶片保护酶活性的影响
随着断水时间的延长,唐古特白刺叶片SOD、POD、CAT活性均表现为先上升后下降的趋势(图4)。与CK组相比,断水后11和13 d,COS处理组唐古特白刺叶片SOD、CAT活性差异不显著,断水后第15、17和19天,SOD活性分别显著提高了22.85%、41.87%和28.77%(图4-A),CAT活性分别显著提高了19.11%、28.50%和24.01%(图4-C);断水后11 d,COS处理组唐古特白刺叶片POD活性差异不显著,断水后13、15、17和19 d,分别显著提高了11.94%、13.51%、24.56%和25.80%(图4-B)。这说明干旱下喷施COS对唐古特白刺保护酶SOD、POD、CAT活性的影响较为明显,因此可初步认为,COS与提高唐古特白刺抗旱性和保护酶活性有关,且COS对唐古特白刺叶片SOD、POD、CAT活性的影响均在断水中后期达到显著水平。
2.5COS对干旱下唐古特白刺叶片渗透调节物质的影响
随着断水时间的延长,COS处理组唐古特白刺叶片中SS、SP、Pro含量均呈先升高后降低趋势且均在断水后第15 d达到最高值(图5)。与CK组相比,断水后第11天,COS处理组唐古特白刺叶片的SS、Pro含量差异不显著,断水后13、15、17、19 d,SS含量分别显著提高了20.44%、33.46%、36.85%、27.05%(图5-A),Pro含量则分别显著提高了10.55%、17.21%、13.69%和32.34%(图5-C);整个断水期间,COS处理组唐古特白刺叶片的SP含量分别显著提高了9.66%、17.40%、8.39%、8.19%和23.19%(图5-B)。以上结果表明,干旱下叶面喷施外源COS整体上可显著提高唐古特白刺叶片渗透调节物质SS、SP、Pro含量,有效增强植物抵御干旱的能力。
3结论与讨论
我国西北部地区大多为荒漠或半荒漠,气候恶劣,干旱频发,水分变化是影响该地区植被生长发育和分布的关键生态因子[26]。研究表明,植物叶片中的相对含水量随着干旱胁迫程度增加而逐渐降低[27],较高的叶片相对含水量可以保持细胞结构,提高叶绿素含量,促进植物进行光合作用[28]。本试验结果表明,唐古特白刺植株在干旱条件下,土壤中可利用水分减少,植株叶片相对含水量降低,干旱时间越长,水分亏缺越严重,但COS处理组植株叶片相对含水量均高于同时段CK组植株,且在断水中后期(断水15 d)达到显著水平。随着断水时间的延长,CK组和COS处理组唐古特白刺叶片叶绿素含量均呈先上升后下降趋势,可能因为干旱前期植物通过自身调节抵御了一定胁迫,但随着干旱时间的延长,胁迫程度超出了植物自身调节的范围,植物组织水分亏缺,叶绿体结构被破坏,因而叶绿素含量降低。相同断水时间内,COS处理组叶绿素含量整体上显著高于CK组,这表明干旱条件下,叶面喷施COS可通过维持唐古特白刺叶片较高的相对含水量来保持细胞结构的稳定性,显著增加唐古特白刺叶片的叶绿素含量,从而使植株保持较高水平的光合作用,进而提高植株的保水能力。
逆境条件下,植物叶片电解质外渗率和MDA含量可反映植株受自由基毒害的程度[29]。试验期间随着断水时间的延长,唐古特白刺叶片电解质外渗率上升,MDA含量增加,表明干旱打破了植物细胞膜内外渗透压的动态平衡,细胞膜质过氧化反应加快,细胞结构破坏严重,植物受毒害程度加大。相同断水时间内,COS处理组叶片电解质外渗率和MDA含量整体上均显著低于CK组,表明干旱下外源喷施COS对植物抗旱和维持细胞稳态有一定促进作用[30],能在一定程度上维持植物细胞内外渗透压平衡,减缓细胞膜质过氧化反应,进而降低MDA含量,降低干旱对植物造成的损伤。
植物在长期演化过程中形成了一套有效的酶促清除活性氧系统,正常情况下,植物体内的水分含量相对稳定,活性氧产生与清除处于动态平衡状态,不会导致细胞结构损伤和代谢紊乱,逆境下,植物可以通过提高体内抗氧化酶活性和渗透调节相关物质的含量[27],增强对胁迫的抵抗能力[31-33]。本研究中,唐古特白刺叶片SOD、POD和CAT的活性随着干旱程度的加剧均呈现先升高后降低趋势,表明在轻度干旱下,唐古特白刺植株可通过自身调节提高SOD、POD和CAT的活性来有效清除逐渐增多的活性氧自由基,提高植物适应干旱的能力,但随着干旱时间延长和胁迫程度的加剧,植物体内活性氧积累量超出自身清除范围,植物受毒害程度加重,细胞結构遭到破坏,SOD、POD和CAT等酶活性逐渐降低,植物受毒害程度加重。植物体内的抗氧化酶SOD、POD和CAT具有协同作用,相同断水时间内,COS处理组叶片SOD、POD和CAT的活性整体上均显著高于CK组,表明干旱下外源喷施COS可以有效提高植物体内抗氧化保护酶活性,从而增强唐古特白刺的抗旱能力。孙君艳等研究也表明外施COS能增强花生幼苗叶片保护酶SOD、POD和CAT的生理活性,延缓干旱对花生幼苗的伤害,从而增强花生早期的抗旱能力[10]。
植物组织中的SS、SP和Pro是植物体内重要的渗透调节物质,植物抵抗外界胁迫的能力与SS、SP和Pro等渗透调节相关物质的含量密切相关[27]。本研究中,COS处理组和对照组唐古特白刺植株叶片中SS、SP、Pro含量均呈先升高后降低趋势,说明干旱下植物自身调节能力有限[34],轻度干旱下,植物可通过增加体内SS、SP、Pro含量来维持细胞渗透平衡,从而抵御胁迫,但随着干旱时间的延长,胁迫程度超出植物自身调节范围,细胞膜结构遭到破坏,胞内氨基酸、糖类等物质外渗,细胞渗透势改变,细胞内环境不稳定,最终导致叶片SS、SP、Pro含量逐渐降低。周艳霞研究COS提高菜心(Brassica campestris L.)品质及抗旱性的作用机制,结果表明,在幼苗时期喷施50 μg/L COS能有效提升菜心品质,而且在轻度、中度和重度干旱胁迫下,喷施低浓度壳寡糖能显著增加SS、SP、Pro含量以及提高CAT、POD、SOD活性,通过抑制MDA产生的方式增强菜心幼苗的抗旱性[35],与本研究结果一致。由此可初步认为,外源COS不仅可以提高唐古特白刺植株的抗氧化酶活性,还可以通过增加植物体内渗透调节物质的含量,增强其抵御干旱胁迫的能力。
综上,干旱下外源喷施40 mg/L COS能显著提高唐古特白刺叶片的相对含水量、叶绿素含量,显著提高叶片中抗氧化保护酶SOD、POD和CAT的活性,增强其抗氧化能力,显著提高渗透调节物质SS、SP、Pro含量,增强细胞维持渗透平衡的能力,显著降低电解质外渗率和MDA含量,对清除干旱下唐古特白刺叶片中活性氧自由基、维持细胞渗透势、提高细胞保水能力有重要促进作用,可有效缓解干旱对植物体的毒害作用。本研究通过生理特性研究阐明了壳寡糖缓解唐古特白刺干旱胁迫的机制,进一步丰富了COS在农业生产应用中的理论基础,为提高唐古特白刺抗旱性研究提供了新的途径和方法,但也存在诸多不足。未来研究将尝试探寻COS喷施对唐古特白刺植株花期、籽粒产量及籽油品质等的影响,以确定不同条件下的最佳喷施剂量,研究唐古特白刺根部对干旱的应答机制,并从基因层面研究外源COS对干旱下唐古特白刺抗旱基因表达的影响。
参考文献:
[1]赵肖琼,梁泰帅,赵润柱. 壳寡糖对PEG胁迫下小麦幼苗生长及抗氧化系统的影响[J]. 中国农业科技导报,2018,20(4):20-28.
[2]Guan Y J,Hu J,Wang X J,et al. Seed priming with chitosan improves maize germination and seedling growth in relation to physiological changes under low temperature stress[J]. Journal of Zhejiang University-Science B,2009,10(6):427-433.
[3]张艳艳,刘威,宣亚楠,等. 水杨酸对盐胁迫下唐古特白刺活性氧代谢和细胞膜透性抑制的缓解效应[J]. 东北林业大学学报,2013,41(12):56-59.
[4]张锦春,赵明,张应昌,等. 植物生长剂和固沙剂对民勤沙区植被生长的影响[J]. 中国水土保持科学,2006,4(1):35-39.
[5]Khan Bilal Mukhtar Ahmed,Khan M A,Siddiqui H,et al. Chitosan and its oligosaccharides,a promising option for sustainable crop production- a review[J]. Carbohydrate Polymers,2020,227:115331.
[6]Yuan X B,Zheng J P,Jiao S M,et al. A review on the preparation of chitosan oligosaccharides and application to human health,animal husbandry and agricultural production[J]. Carbohydrate Polymers,2019,220:60-70.
[7]阮松林,薛庆中. 壳聚糖包衣对杂交水稻种子发芽和幼苗耐盐性的影响[J]. 作物学报,2002,28(6):803-808.
[8]刘晓霞,邹成林,李训碧,等. 壳寡糖对干旱胁迫下甘蔗叶片生理指标的影响[J]. 南方农业学报,2014,45(10):1759-1763.
[9]李艳,曾秀娥,李洪艳,等. 壳寡糖对干旱胁迫下油菜叶片生理指标的影响[J]. 生态学杂志,2012,31(12):3080-3085.
[10]孙君艳,李淑梅,仝胜利. 干旱胁迫下壳寡糖对花生幼苗叶片光合特性及保护酶的影响[J]. 江苏农业科学,2015,43(6):98-100.
[11]王尚德,康向阳. 唐古特白刺研究现状与建议[J]. 植物遗传资源学报,2005,6(2):231-235.
[12]Ming Z,Ma J B,Bi H T,et al. Characterization and cardioprotective activity of anthocyanins from Nitraria tangutorum Bobr. by-products[J]. Food & Function,2017,8(8):2771-2782.
[13]Zhao B T,Jing L,Xin C,et al. Purification,structure and anti-oxidation of polysaccharides from the fruit of Nitraria tangutorum Bobr.[J]. RSC Advances,2018,8(21):11731-11743.
[14]柴文敏,李毅,蘇世平,等. 唐古特白刺(Nitrariatangutorum)抗旱优良家系的生理特性[J]. 中国沙漠,2017,37(6):1158-1170.
[15]唐欣,王瑞辉,杨秀艳,等. 唐古特白刺液泡膜Na+/H+逆向运输蛋白基因NtNHX1的克隆与表达分析[J]. 林业科学,2014,50(3):38-44.
[16]刁庆发. 唐古特白刺繁殖栽培技术及保护利用[J]. 中国园艺文摘,2012(8):130-131.
[17]祁迎林. 唐古特白刺抗逆性及开发价值[J]. 柴达木开发研究,2003(5):48-50.
[18]杜玉玲. 外源水杨酸对盐胁迫下唐古特白刺ROS代谢及 AsA-GSH循环的影响[D]. 哈尔滨:东北农业大学,2017.
[19]Yang Y L,Shi R X,Wei X E,et al. Effect of salinity on antioxidant enzymes in calli of the halophyte Nitraria tangutorum Bobr.[J]. Plant Cell Tissue and Organ Culture,2010,102(3):387-395.
[20]杨颖丽,范庆,魏学玲,等. 硝普纳处理对白刺愈伤组织膜脂过氧化及抗氧化酶活性的影响[J]. 植物研究,2009,29(3):303-307.
[21]Guo L,Guo D L,Yin W L,et al. Tolerance strategies revealed in tree peony (Paeonia suffruticosa; Paeoniaceae) ecotypes differentially adapted to desiccation[J]. Applications in Plant Sciences,2018,6(10):e01191.
[22]Zhao D Q,Zhang X Y,Fang Z W,et al. Physiological and transcriptomic analysis of tree peony (Paeonia section Moutan DC.) in response to drought stress[J]. Forests,2019,10(2):135.
[23]彭小琴,惠竹梅,张晖,等. 24-表油菜素内酯对农药处理下葡萄叶片光合特性和抗逆性的影响[J]. 干旱地区农业研究,2015,33(3):130-138.
[24]张志良,翟伟菁,李小芳. 植物生理学实验指导[M]. 北京:高等教育出版社,2000:62-123.
[25]李合生,孙群,赵世杰,等. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2000:105-263.
[26]褚建民. 干旱区植物的水分选择性利用研究[D]. 北京:中国林业科学研究院,2007.
[27]刘世鹏,刘济明,陈宗礼,等. 模拟干旱胁迫对枣树幼苗的抗氧化系统和渗透调节的影响[J]. 西北植物学报,2006,26(9):1781-1787.
[28]Colom M R,Vazzana C. Photosynthesis and PSⅡ functionality of drought-resistant and drought-sensitive weeping lovegrass plants[J]. Environmental and Experimental Botany,2003,49(2):135-144.
[29]Shao H B,Chu L Y,Shao M A,et al. Higher plant antioxidants and redox signaling under environmental stresses[J]. Comptes Rendus Biologies,2008,331(6):433-441.
[30]Hussain S,Zhang J H,Chu Z,et al. Effects of salt stress on rice growth,development characteristics,and the regulating ways:a review[J]. Journal of Integrative Agriculture,2017,16(11):2357-2374.
[31]王金缘,娄钠,徐萌,等. PEG预处理对干旱和盐复合胁迫下水稻幼苗AsA-GSH循环的影响[J]. 江苏农业科学,2018,46(7):51-54.
[32]辛松林,秦文,孙传红,等. 腐皮镰孢霉菌侵染及保鲜剂处理对秋葵相关抗性酶的影响[J]. 江苏农业学报,2018,34(5):1161-1168.
[33]陈天,刘云根,王妍,等. 外源磷对砷胁迫下挺水植物抗氧化酶系统的影响[J]. 江苏农业学报,2019,35(5):1040-1046.
[34]孙志虎,王庆成. 应用PV技术对北方4种阔叶树抗旱性的研究[J]. 林业科学,2003,29(2):33-38.
[35]周艳霞. 壳寡糖提高菜心品质及抗旱性机理的研究[D]. 南宁:广西大学,2012.陈碧露,罗素梅,刘小平,等. 不同品种月季的耐热性鉴定[J]. 江苏农业科学,2020,48(13):178-180.doi:10.15889/j.issn.1002-1302.2020.13.035

