沙福芽孢杆菌氧化磷酸化通路相关基因对锰胁迫的应答
龙 红, 牛 熙, 黄世会, 冉雪琴, 王嘉福
贵州大学农业生物工程研究院/贵州大学动物科学学院, 贵州 贵阳 550025
三磷酸腺苷(ATP)是由腺嘌呤、核糖及3个磷酸基团连接组成,水解时释放大量能量,是生物体内最直接的能量来源。在产能代谢过程中,微生物可通过底物水平磷酸化和氧化磷酸化将有机物分解或无机物氧化过程中释放的能量储存在ATP分子中,用于DNA复制、转录和蛋白合成等生理过程[1]。当胞内的线粒体异常和氧化磷酸化途径受损时,底物水平磷酸化可发挥其作用弥补ATP的合成。但生命活动所需能量主要来源于氧化磷酸化,这种方式合成的ATP约占总数的95%。[2-4]。氧化磷酸化途径由电子传递链(electron transport chain,ETC)和磷酸化两部分构成,电子通过ETC产生跨膜的质子梯度即质子动势,用于驱动ATP合酶合成ATP[5]。
锰是生物体不可缺少的微量元素之一[6]。锰过氧化氢酶[7]、锰超氧化物歧化酶[8]以及磷酸化酶等都需要锰作为辅因子,参与细菌能量代谢和抗氧化等重要生理过程[9]。当环境中的锰过量导致细菌胞内锰过剩,则会引发锰毒害作用。研究表明锰胁迫时,可导致线粒体的能量代谢失活[10,11],细胞内的ATP水平降低,并证明能量不足是发生锰毒害的主要原因[12]。ATP合成酶在氧化磷酸化中起核心作用,细菌的ATP合成酶由膜内的疏水结构域F0和膜外可溶的亲水头部F1两部分组成,F0具有质子运输功能,将质子传递给二磷酸腺苷(ADP)和无机磷酸盐(Pi)在F1中合成ATP结合[13-15]。F1的α3、β3和γ亚基由atpA、atpD和atpG编码[16]。α亚基是ATP合成酶的催化结构域,敲除atpA基因使ATP生成量下降,抑制大肠杆菌的呼吸作用[17]。敲除M.smegmatis的atpD基因,不仅引起ATP合成量下降、呼吸减慢,同时生物膜减少[18]。分枝杆菌的蛋白组学研究发现,atpG对细胞存活起至关重要的作用[19]。细胞色素bc1氧化酶和细胞色素C氧化酶是电子传递链的两个末端氧化酶,是电子传递链中的关键酶,细胞色素bc 1氧化酶亚单位由qcrB基因编码,细胞色素C氧化酶亚基Ⅰ由ctaD基因编码[20,21]。这些基因控制着细菌的氧化磷酸化过程。
我们从锰矿土壤中分离到一株沙福芽孢杆菌S7,其耐锰能力高达2 200 mg/L[22]。本文选择耐锰菌株S7,研究锰胁迫条件下,ATP合成酶和细胞色素亚基编码基因的时序性变化,从能量代谢角度解析细菌对锰胁迫的应答机制。
1 材料与方法
1.1 菌株
该菌株S7是分离于贵州省松桃自治县锰矿土壤,经鉴定为沙福芽孢杆菌[21]。
1.2 培养基、试剂和培养条件
PYCM培养基:胰蛋白胨0.8 g,酵母粉0.2 g,K2HPO40.1 g,MgSO4.7H2O 0.2 g,NaNO30.2 g,CaCL20.1 g,(NH4)2CO30.1 g,蒸馏水1 L,调节pH为6.8~7.0,固体培养基加2%琼脂粉。LB培养基:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,蒸馏水1 L,固体培养基加1.5%琼脂粉。1×105Pa灭菌20 min。
MnCl2·4H2O溶于灭菌的三蒸水,配制浓度为505 mmol/L的溶液,以0.22 μm孔径的微孔滤膜过滤除菌,4 ℃冰箱保存。将1 mol/L HEPES稀释100倍,调节pH为8.0左右,以0.22 μm孔径的微孔滤膜过滤除菌,-20 ℃冰箱存放。称取0.04 g LBB粉末溶解于250 μL冰乙酸中,再加水定容至100 mL,需避光保存于4 ℃冰箱。
S7菌株活化,涂布于PYCM固体平板,28 ℃培养箱内倒置培养,挑取单菌落扩大培养至对数期,以1%的接种量加入200 mL PYCM液体培养基。
1.3 液体中Mn(Ⅱ)氧化定量
KMnO4标准曲线法[23]可定量测定菌株的锰氧化活性,配制1 mmol/L的KMnO4母液,将其稀释成12个等浓度梯度的溶液,分别取以上稀释液50 μL于EP管中,再加入250 μL LBB试剂,均匀混合,避光反应30 min。取200 μL反应混合物于96孔板中,酶标仪检测OD620的吸光值。以KMnO4浓度为横坐标,OD620值为纵坐标制作KMnO4标准曲线,公式为y=5.404 2x+0.126 9。测待测样品的OD620吸光值,在KMnO4标准曲线上计算对应的KMnO4浓度,该浓度值的2.5倍就是MnO2的浓度,再除以培养的时间最终得到该菌对Mn(Ⅱ)的氧化活性。
将沙福芽孢杆菌接种到250 mg/L Mn (II)的液体培养基中, 28 ℃,180 r/min,培养3 d,培养基中出现棕褐色沉淀,取1 mL 菌液离心, 去上清,加入50μLHEPES悬浮菌液,再加入250 μL LBB试剂。将体系置于25 ℃暗处反应 30 min,设置3个技术重复。
1.4 固体平板Mn(Ⅱ)氧化定性
在分别含Mn (II)浓度为0 mg/L和250 mg/L的PYCM固体培养基中均匀涂板,28 ℃倒置培养7 d,用LBB指示剂喷洒培养基表面,若为阳性菌株则呈蓝色,阴性菌株无色。
1.5 RT-qPCR
以沙福芽孢杆菌(BacillussafensisKTCC)的全基因组序列为模板,设计5个基因的特异性引物(表1)。提取细菌总RNA,反转录成cDNA,经PCR扩增得到目的基因片段,连接pGEM-T Easy载体,转化感受态大肠杆菌DH5α,于50 mg/L氨苄青霉素的固体LB平板筛选阳性克隆,提取测序正确的克隆菌株质粒,以10倍梯度稀释作为DNA模板,绘制标准曲线,计算扩增效率。RT-qPCR的扩增程序:95 ℃预变性,15 min;95 ℃变性,10 s;63 ℃,30 s;40个循环数;溶解曲线的设置为95 ℃,15 s,55 ℃,15 s,95 ℃,0.5 s。以16S rRNA为内参基因[24],采用2-ΔΔCt方法[25]计算基因的相对表达量。为减少样品之间的误差,每个样品重复测定3次。

表1 RT-qPCR引物
2 结果
2.1 沙福芽孢杆菌的锰氧化活性及变化
在固体氧化测定中,经过LBB试剂的显色反应,金色葡萄球菌的平板显些许淡蓝色,而沙福芽孢杆菌的平板则呈明显深蓝色(图1),说明沙福芽孢杆菌较金色葡萄球菌具有强的锰氧化作用。为进一步测定沙福芽孢杆菌的锰氧化活性,利用LBB试剂能特异性结合Mn(IV)和Mn(III)这一特点(图2),通过高锰酸钾标准曲线法进行定量测定,最后计算得到MnO2的浓度的平均值为23.25 μmol/L,该菌株的锰氧化活性约为7.75 μmol/(L·d)。为进一步证实沙福芽孢杆菌的锰氧化特性,将无锰培养和有锰培养的沙福芽孢杆菌做扫描电镜(SEM),结果显示无锰培养的沙福芽孢杆菌表面光滑,而有锰培养的沙福芽孢杆菌表面则附着明显的锰氧化物(图3)。经过以上试验佐证,证实沙福芽孢杆菌确实为锰氧化细菌且具有锰氧化能力。锰氧化物的变化曲线则显示沙福芽孢杆菌在0 h~4 h之间没有发生锰氧化,4 h ~16 h之间发生剧烈的变化,8 h达到峰值,而之后下降,16 h后又回升(图4)。说明沙福芽孢杆菌的锰氧化(锰耐受)不是一个固定不变的进程,而是具有时序性变化的。


1:LBB原液对照;2:沙福芽孢杆菌;3:沙福芽孢杆菌+Mn(Ⅱ)
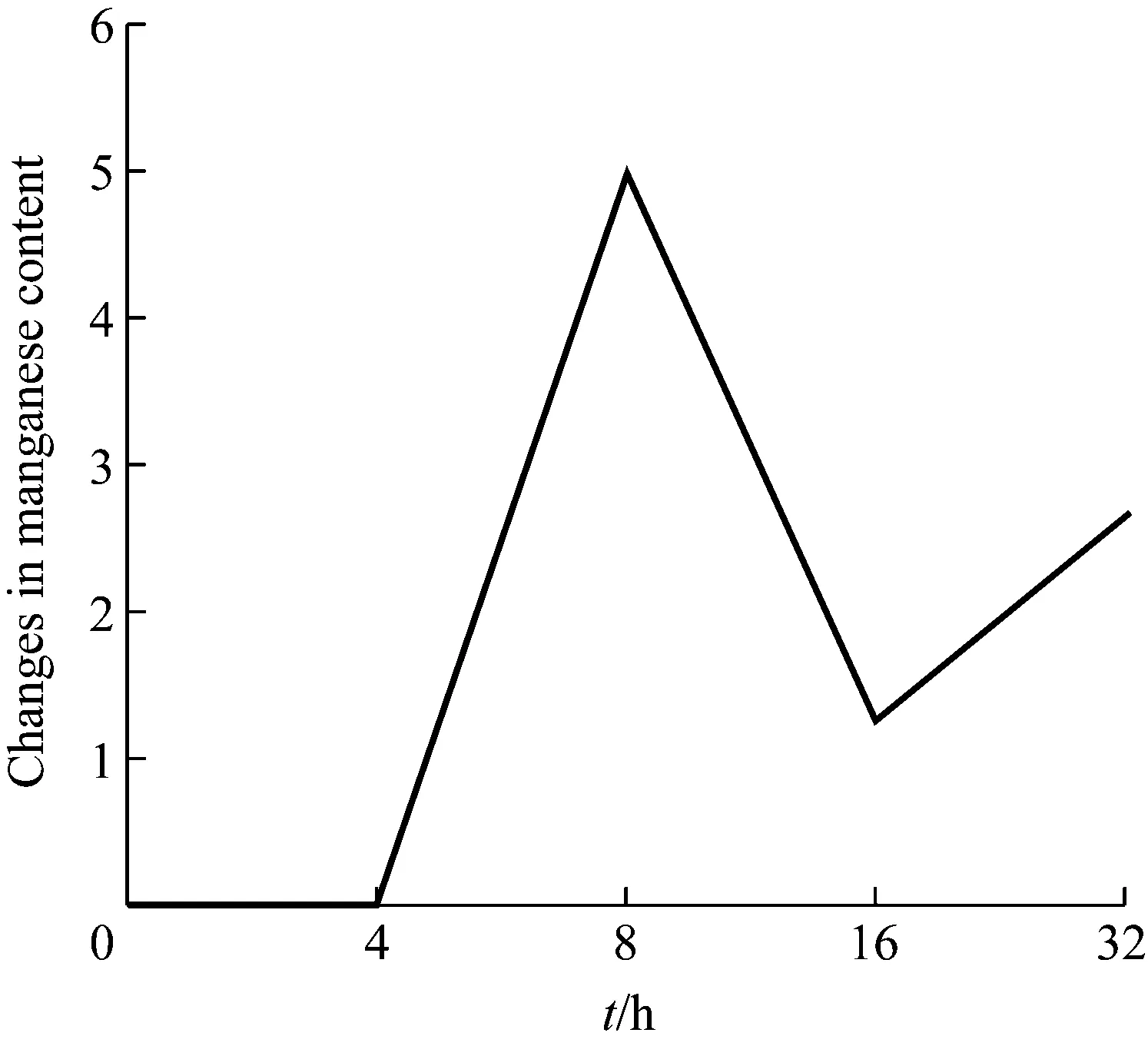
图4 锰氧化物含量变化
2.2 基因的扩增及测序
以沙福芽孢杆菌cDNA为模板,经扩增,分别获得123、133、113、150、108 bp基因片段,经克隆测序,与BacillussafensisKCTC参考基因组比对,各基因测定序列与参考基因组序列的相似性均为100%。
2.3 克隆菌株的构建与表达
提取qcrB、ctaD、atpA、atpD、atpG5和16S rRNA6个基因的阳性克隆菌株的质粒, 梯度稀释8倍, 以质粒为模板进行PCR扩展,绘制6个基因的标准曲线。结果见表2, 6个基因的线性关系数(R2)范围在0.992~0.998之间,具有较好的线性关系。扩增效率均在90%~110%之间,符合RT-qPCR对扩增效率要求,说明6个基因的扩增效率好,有利于进行下一步上样试验。
根据沙福芽孢杆菌的生长曲线[26],结合细菌20 min就能繁殖一代的生理习性。设置培养时间点为0.3 h、0.6 h、1 h、4 h、8 h、16 h和32 h,锰作用浓度设置为0 mg/L、250 mg/L、2200 mg/L,经定量PCR检测,5个基因的表达量4 h前维持在低水平,4 h之后开始上升,8 h达到峰值,16 h表达量最低,atpA基因32 h时再次达到峰值,形成双峰趋势(图5~图9)。
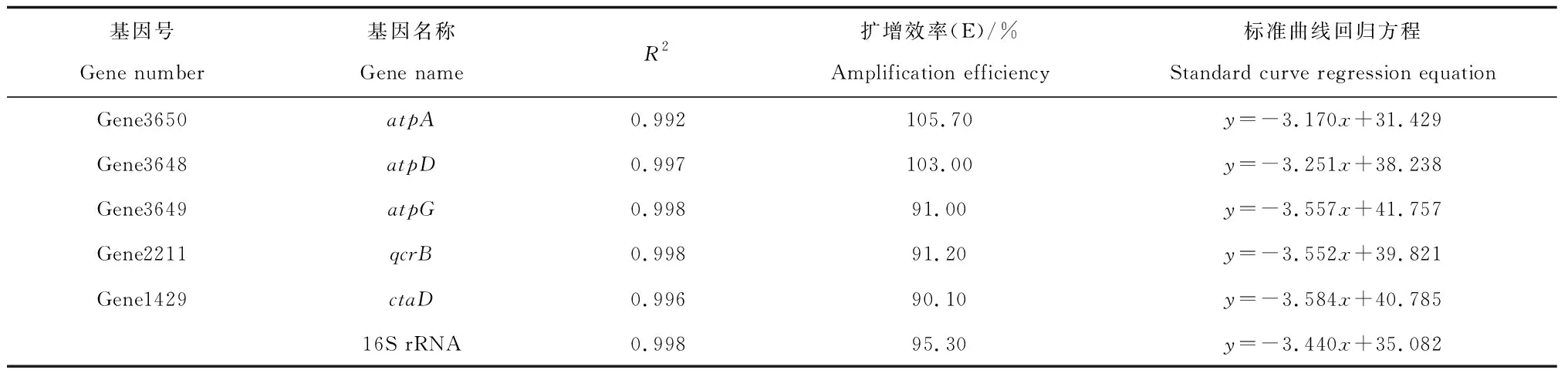
表2 标准曲线和扩增效率
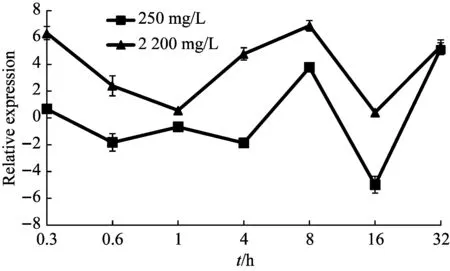
图5 atpA基因的表达变化
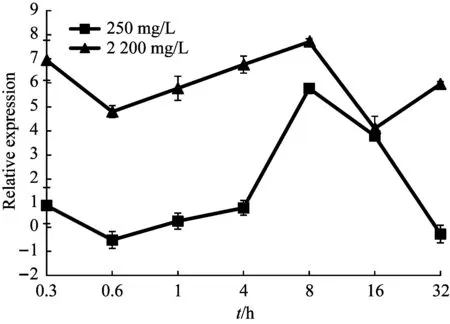
图6 atpD基因的表达变化
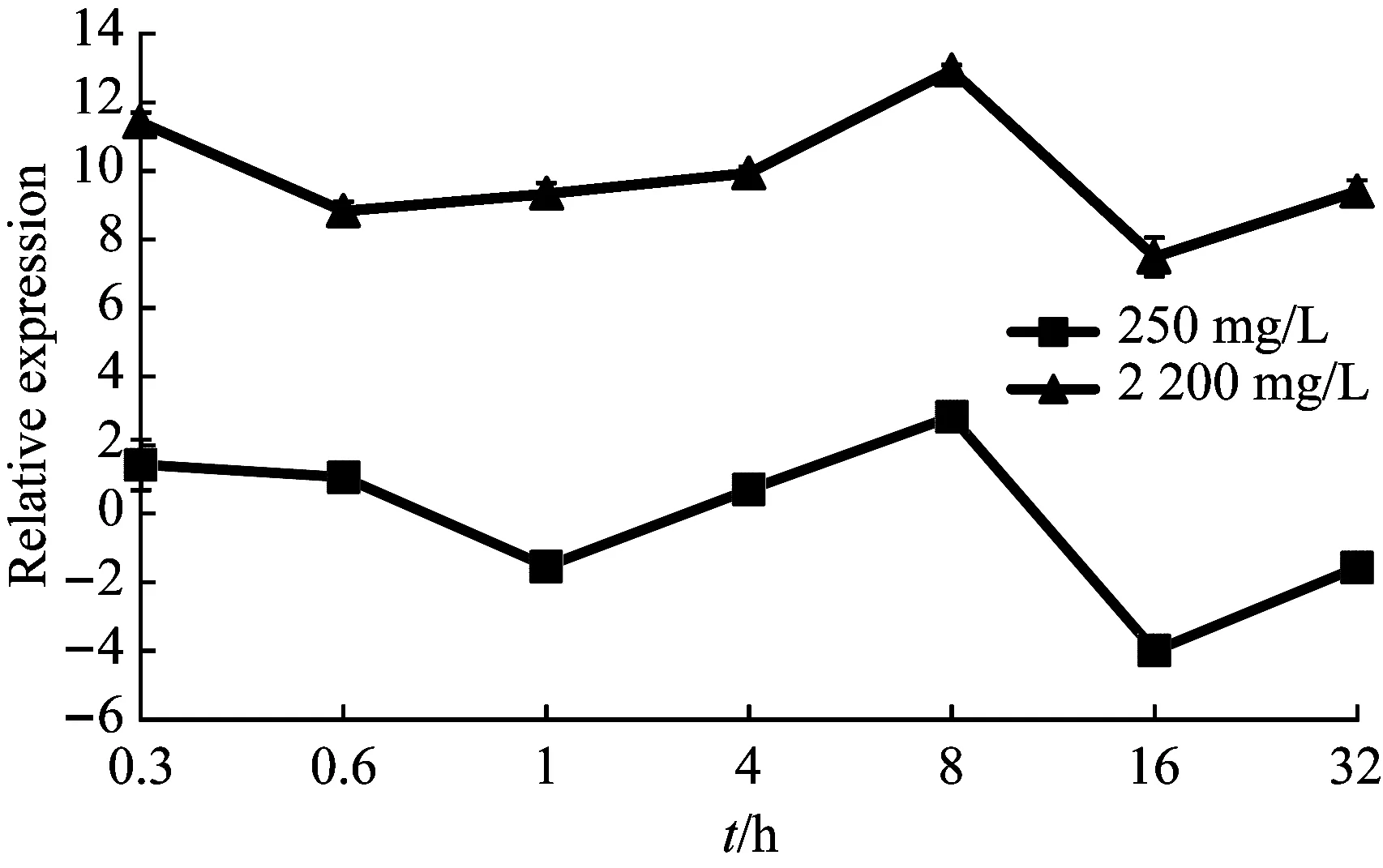
图7 atpG基因的表达变化
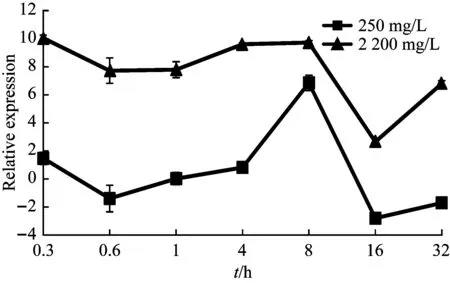
图8 qcrB基因的表达变化
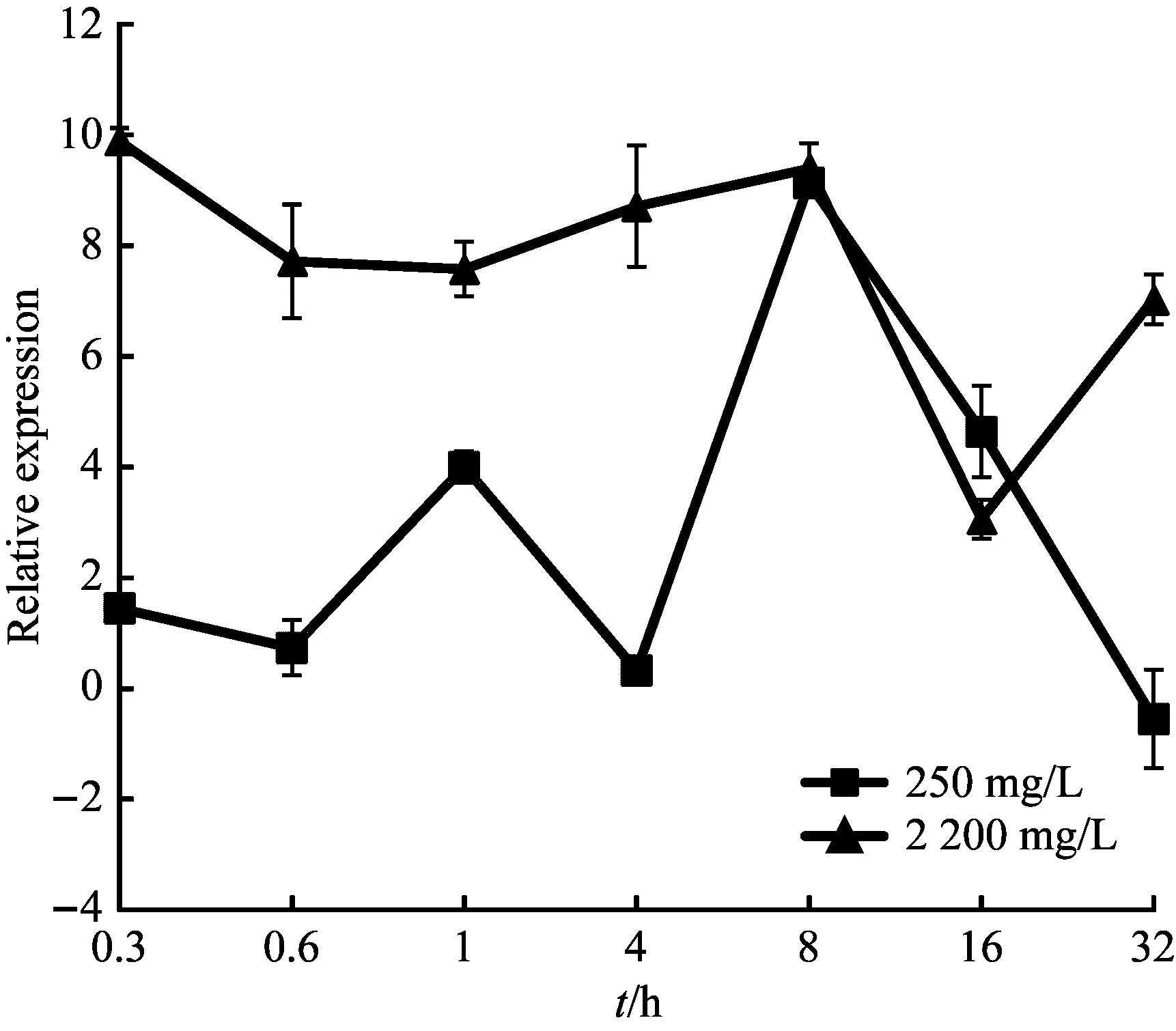
图9 ctaD基因的表达变化
3 讨论与结论
本试验以16S rRNA为内参基因,研究在不同培养时间、不同锰胁迫条件下,qcrB、ctaD、atpA、atpD和atpG5个基因的表达情况。依据q-PCR的结果,发现沙福芽孢杆菌在低浓度或高浓度锰胁迫下均呈现相似的表达模式,即5个基因的表达量在4 h前维持低水平表达且稳定,8 h到达峰值,但在4 h ~16 h之间发生表达量的剧烈变化。
生命体内发生的各种生理活动都需要ATP的支持[27]。近年来对生物体受到重金属胁迫研究中发现,氧化磷酸化、碳同化和三羧酸循环途径都参与到了细胞的抗毒害活动中,通过促进细胞恢复能量产生和提高能量转化效率来解毒,证实了能量衰竭可能是造成毒害的原因[28-30],近年来的研究证明ATP合酶基因在抗胁迫中起作用。大肠杆菌DH5α中过表达atpA基因,在一定程度上改善了菌体的生长[31]。在胁迫条件下,ATP合酶的亚基增多,意味需要更多的ATP合酶将质子输出到胞外,达到保护细菌的目的[32]。本研究发现,atpA基因的表达在8 h和32 h有双峰,32 h是沙福芽孢杆菌在2 200mg/L锰胁迫下的对数生长期点,在大肠杆菌过表达atpA基因也是在对数期提高菌体数量,但没有出现表达的双峰模式。研究不同pH条件下,atpD基因在两株乳杆菌(Lp9和Lp91)的表达情况,发现Lp91显现更强的耐酸性且atpD基因的表达量高于另一菌株,表明ATP合酶可能是胃内益生菌在遇到胃内强酸环境胁迫下的耐受性中起关键作用,而且在不同的酸性条件下,atpD基因的表达受到正调控[33],这与我们的试验结果一致,在不同锰浓度胁迫下,atpD基因的表达受到正调控。atpG基因在不同时间的脱水胁迫条件下均有表达且具有明显变化,可能参与了砂藓的脱水胁迫应答。将海洋藻类和淡水藻类的atpG基因转入大肠杆菌,发现转入海洋藻类atpG基因的大肠杆菌耐盐性高于另一组,说明该基因参与了逆环境的胁迫应答[34,35]。qcrB常作为结核分枝杆菌耐药性研究的药物靶点,通过抑制氧化磷酸化,消耗体内ATP储存来抑制结核分枝杆菌的生长[36,37]。ΔctaD菌株呈现较差的生长性,且ΔctaD中细胞色素bc1的表达水平均低于野生型[38]。目前关于氧化磷酸化与能量代谢关系的研究,主要集中在基因的功能性研究,缺乏对基因表达的时序性研究。
微生物和动植物受外界环境胁迫会发生氧化应激,产生的活性氧会抑制其生长[39,40]。在前期研究中发现,锰胁迫条件下,超氧化物歧化酶和过氧化氢酶的活性在10 h前维持低水平表达,10 h后开始上升,14 h到达峰值之后逐渐减少,到34 h又开始有上升趋势[26]。推断细菌在锰胁迫下,前8 h受到氧化应激的抑制作用,而此时细菌内超氧化物歧化酶和过氧化氢酶的活性较低,不能抵消活性氧的毒害,增加ATP合成量,可能用于外排锰,以减少锰对细胞内蛋白的毒害作用,5个基因在此阶段表达上调。在10 h ~14 h,超氧化物歧化酶和过氧化氢酶的活性急剧提升大约3倍,降低了胞内的氧自由基的毒害作用。此时细菌不需要更多的ATP来抵抗氧化应激,对应时间点5个基因的表达急剧下降。研究结果表明,耐锰菌沙福芽孢杆菌S7的能量代谢水平随着作用时间和浓度的提高而上升,以产生大量的ATP应对锰毒害作用。

