金黄色葡萄球菌和单增李斯特菌快检试剂盒(溶液)的评价验证
曹永梅
上海旺旺食品集团有限公司,上海 201103
食品安全是全球关注的重大问题。金黄色葡萄球菌[1]、单核细胞增生李斯特氏菌以及沙门氏菌等食源性致病菌的检出有赖于快速、高效、专一和灵敏的检测方法[2-6]。笔者应用自主研发的快检试剂盒(溶液)检测食源性致病菌。针对外部第三方客户(以下简称A)使用该快速试剂盒过程中出现的问题,经采用留存的同批次试剂盒和同批次样本进行了重复测试,得出了个别样本和对照组出现的假阳性和假阴性问题的可能原因以及相应采取的对策,从而为改进检测技术及试剂盒生产制备工艺优化提供有益的参考。
1 材料与方法
1.1 材料
金黄色葡萄球菌和单核细胞增生李斯特氏菌快检试剂盒(本实验室自主研发[7,8])。
菌种金黄色葡萄球菌CICC21600和单增李斯特菌CICC21635由本实验室保存。
1.2 试验方法
1.2.1菌种活化
1.2.1.1菌悬液制备
A根据菌种活化说明书,往菌粉中分别加入1支脑浸液,制成菌悬液,备用。本实验将菌种在37 ℃水浴中快速解冻,取一环菌液划线接种平板,培养过夜。取已灭菌的含30%甘油营养肉汤10 mL于15 mL 离心管中,刮取平板上的细菌于离心管中,混匀分装,4 ℃冷藏保存备用。
1.2.1.2接种
每种菌4个平板,每个平板接种200 μL,金黄色葡萄球菌于36 ℃、李斯特菌于30 ℃培养18 h~24 h,选取单个生长良好的菌落,备用。
1.2.2人工污染样本制备
1.2.2.1培养基制备
液体培养基配制量如表1, 121 ℃ 15 min灭菌后备用。制备金黄色葡萄球菌Baird-Parker平板和血平板、李斯特氏菌显色平板和PALCAM平板,冷藏备用。

表1 不同致病菌培养基种类及培养条件
1.2.2.2污染样本基质
人工染菌基质是果冻、QQ糖、牛奶和小馒头等四种食品, 每种所需的样本量为5 g, 接种量见表2。
(1) 空白组不接种菌:直接将配制好的液体培养基分装成4份,每份50 mL,依次加入装有试验样本的均质袋中,拍击混匀。

表2 不同菌的接种数
(2) 接种低浓度菌、高浓度菌:按表2将菌落分别接种到对应培养基中,搅拌混匀后分装,其余同(1)。
(3) 按表1的培养温度分别培养18 h~24 h。
1.2.3检测
国标法,其中金黄色葡萄球菌按GB4789.10-2016[9],单核细胞增生李斯特氏菌按GB4789.30-2016[10]操作。快检法[7,8]按照试剂盒说明书分别进行核酸提取和扩增检测。阴性对照处理(kit-)呈橙色,为阴性结果,阳性对照处理(Kit+)呈荧光绿色,为阳性结果。
2 结果
2.1 金黄色葡萄球菌测试结果
2.1.1金黄色葡萄球菌国标法
A实验中所有阴性样本均未检出,阳性样本全部检出。本实验阳性样本全部检出,但果冻I阴性对照样本平板上长菌,其他正常,如表4国标法。
2.1.2金黄色葡萄球菌快检法
A实验的阴性样本均未检出,但发现阳性样本只有QQ糖基质检出,果冻I和牛奶基质均未检出,重复试验发现仍然只有QQ糖阳性样本检出,另两种阳性样本均未检出(见表3)。
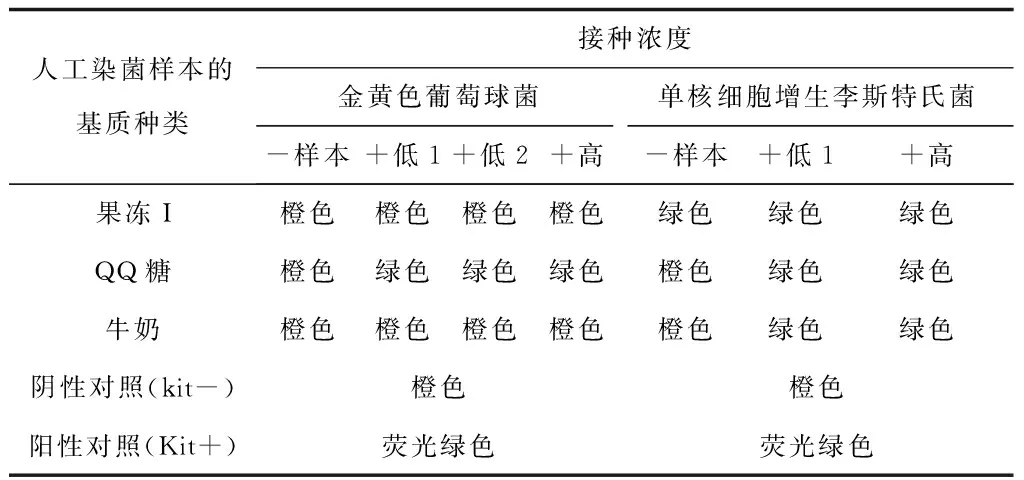
表3 A快检法结果
本实验采用快检法的结果如表4快检法和图2所示,4种基质的人工染菌阳性样本均被检出,QQ糖、牛奶和小馒头基质的阴性样本均未检出,然而果冻I阴性样本(即未人工污染样本)也被检出,与上述国标法检测结果一致。
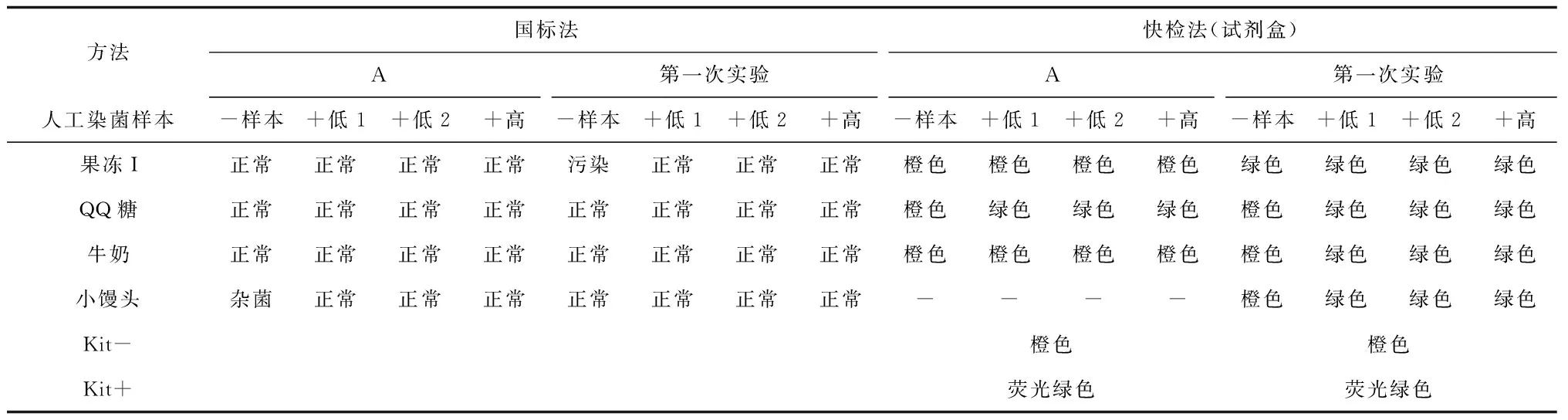
表4 金黄色葡萄球菌测试结果
2.1.3第二次重复测试
针对上述测试中,果冻I阴性对照样本采用国标法和快检法同时出现阳性结果的问题,本实验对果冻I和II两个批次果冻样本进行了重复测试。第二次国标法和快检法结果显示,果冻I和II的阴性样本均未检出,阳性样本均被检出,如表5、图3和图4。

图1 金黄色葡萄球菌国标法结果

图2 金黄色葡萄球菌快检法结果

表5 金黄色葡萄球菌果冻基质样本重复测试结果


图3 金黄色葡萄球菌果冻基质样本重复测试国标法结果

图4 金黄色葡萄球菌果冻基质样本重复测试快检法结果
2.2 单核细胞增生李斯特氏菌测试结果
2.2.1单增李斯特菌国标法
实验结果如表6和图5,4种基质所有阳性样本均被检出,PALCAM平板上呈小的圆形灰绿色菌落,周围有棕黑色水解圈,有些菌落有黑色凹陷[8];李斯特显色平板上有蓝绿色菌落,菌落周围有一不透明环。未接种阴性对照平板上不长菌,所有阴性样本均未检出。

表6 单核细胞增生李斯特氏菌测试结果
2.2.2单增李斯特菌快检法
A实验中果冻I基质的阴性样本和阳性样本均被检出,但经实验重复验证,结果显示4种基质所有阴性样本均未检出(图6),与上述国标法结果一致。

图5 单核细胞增生李斯特氏菌国标法结果

图6 单核细胞增生李斯特氏菌快检法结果
3 讨论与结论
3.1 金黄色葡萄球菌试剂盒测试果冻和牛奶阳性样本中出现假阴性的原因分析
此前本实验室在牛奶和果冻两种食品基质中均曾测试成功,检出灵敏度为1 CFU/25 g。本实验采用国标法和快检法对同批次试剂盒和同批次食品样本的重复测试实验中,4种基质阳性样本均被检出。
综上,假阴性问题可能是试剂在运输、储存以及实验过程中操作不当造成活性降低所引起。针对试剂的运输和储存环节,本实验室正在开展干粉化工艺优化。针对实验操作中可能出现的问题,可以通过对试剂进行小管分装、干粉化等方式防止试剂活性降低。
需要注意的是,果冻I阴性样本在本实验第一次测试中,国标法和快检法均呈阳性,但第二次重复验证两批阴性样本均未检出。分析原因,可能是操作过程中引入了金黄色葡萄球菌,或者样本中污染有分布不均的金黄色葡萄球菌(发生假阳性结果的样本批次早于用于重复测试的样本II),可排除试剂盒本身的质量问题。结果提示,检测反应体系的污染控制是非常关键的环节。另外,当检测到假阳性结果后,应重复实验,通过采用不同批次样本、不同批次试剂的方式控制实验过程,确认检测结果。
3.2 单增李斯特菌试剂盒对果冻基质阴性样本测试时出现假阳性的原因分析
分析推测,假阳性可能是由于实验室空间内的气溶胶污染所造成的。
作为一种快检方法,本方法灵敏度高,优点是可快速筛选出高危样本,尽可能避免阳性样本被漏检(假阴性);与之对应的缺点是,一旦实验室操作空间内有微量的待测菌或者DNA,相比国标培养法,更容易造成假阳性。这是所有PCR类核酸扩增方法普遍存在的问题。同理,当实验环境中高灵敏度方法与低灵敏度方法共存,更容易造成假阳性问题。因此,出现阳性时,通过国标法进一步验证。
既要保留核酸扩增反应的快速、高灵敏度特性,又要规避污染问题,是目前本领域的挑战之一。目前本实验室正就试剂盒生产工艺做改进,通过避免开盖、减少操作步骤等方式防范和减少污染,降低假阳性。
3.3 淀粉样本出现的预处理问题
小馒头基质在沉淀加入核酸抽提试剂,100 ℃ 15 min,碎冰或冰盒中静置10 min后会凝结成块,离心无法得到上清液。这是由于小馒头中含有大量淀粉,吸水性强,增菌液混入该介质后很容易凝结成块,发生上清液难以析出的问题。
本实验采用先将增菌液摇匀,略等基质沉淀后再取增菌液,在两种快检试剂盒上都取得预期的检测结果,即阴性样本均未检出,阳性样本均被检出。
因此,为避免类似基质造成困扰,可以在说明书中增加相关描述,如“略等食品介质沉淀后再取增菌液”。此外,还可以使用带滤膜的均质袋进行增菌,或者多加一步增菌步骤。
在研发过程中,不同食品由于大分子含量、pH、盐浓度等因素对于反应体系的各个环节会有不同程度的影响,如何让检测体系适应不同类型的检测对象,也是本实验目前研发工作的一个关注点。
3.4 检出限(灵敏度)
需要特别指出的是,在对样本进行人工染菌的操作环节,A测试与本实验室此前的操作有所不同。外部实验是从培养基平板上挑取经过纯培养的若干个单菌落接种样本;本实验室的方法是先将病原菌液体培养、计数、稀释,然后分别将16、8、4、2、1和0.5 CFU/mL细菌接种到拟检测的样本中。从方法设计上可以看出,自主研发的技术体系灵敏度更高。
为了与外部测试结果进行严格的比对,本次验证实验在人工染菌等环节,采用了与之相同的实验方法。
本文查明试剂盒初步测试结果出现假阴性和假阳性的原因,为下一步检测技术及试剂盒生产制备工艺的优化提供有益的参考。

