甘油葡萄糖苷αGG的制备方法及其研究进展
徐 恺, 李 丽, 付铭洋, 陈昱金, 徐 铮,2*
1.南京工业大学食品与轻工学院,南京 211816;2.材料化学工程国家重点实验室,南京 210009
甘油葡萄糖苷是一种由葡萄糖基和甘油通过糖苷键连接而成的糖苷化合物,其基本结构见图1。它是植物和微生物在胁迫条件下自发合成的一种渗透保护物质(Osmolyte);它可以保护细胞免受高渗透压、高温、干旱以及紫外线等恶劣环境的破坏[1]。在日本清酒、味噌、米醂中也发现含有甘油葡萄糖苷[2],一些异养细菌以及光合蓝藻在盐胁迫条件下也可以特异性合成并积聚甘油葡萄糖苷,它可作为可溶性有机分子的小分子量官能团的一种兼容溶质。到目前为止,在自然界中已鉴定出六种结构不同的甘油葡萄糖苷,它们分别具有不同的糖苷键或者不同的立体化学结构[3-5],其中以α糖苷键构成的包括:2-O-α-D-glucosylglycerol(αGG,图2a)、(2S)-1-O-α-D-glucosylglycerol(2S-1-αGG,图2b)、(2R)-1-O-α-D-glucosylglycerol(2R-1-αGG,图2c)。以β糖苷键构成的包括:2-O-β-D-glucosylglycerol(2-βGG,图2d)、(2S)-1-O-β-D-glucosylglycerol(2S-1-βGG,图2e)和(2R)-1-O-β-D-glucosylglycerol(2R-1-αGG,图2f),β类GG仅在高等植物中发现[6]。研究表明,αGG的甜度是蔗糖的55%,具有高耐热性、低热色性、低吸湿性、高持水性以及低美拉德反应等特点;不同于葡萄糖,在αGG存在时,人唾液中的口腔细菌不会产生酸,表现出非致龋性[2]。由于其具有低吸水性、高保湿性的特点,αGG可作为化妆品原料,用于提高皮肤的保湿效果[7,8],可以消除洁面后皮肤的紧绷感[9];另外,αGG是一种大分子稳定剂,可用于蛋白质药物等的长期保存[10]。

图1 αGG(2-O-α-D-glucosylglycerol)的结构式示意图
1 αGG的来源
在极端干旱的沙漠中,卷柏、密罗木等植物即使丧失自身质量高达98%的水分,仍可顽强生存度过旱季,并在雨季重新焕发活力,这种现象源于密罗木会产生一类天然防护物—压力防护分子。德国Bitop AG公司研究表明,αGG就是植物密罗木的主要活性成分,也是其能避免栖息地恶劣条件侵害的关键。密罗木累积了这种活性物质,它能保护植物结构不被破坏,缺水时,通过调节细胞内渗透压,减少水分流失到细胞外,保护植物不会被完全干燥;下雨时,αGG激活密罗木的细胞功能,快速进行细胞修复。目前,αGG可以通过化学法[12]、酶催化合成法[13]以及合成生物学方法[14-15]合成。但是化学法存在产物没有选择性,无法获得单一纯品GG的问题;而合成生物学法目前产量较低,暂难以工业化;酶催化法相对而言更有产业化价值。虽然现阶段已有多种αGG的合成方式,但是已报道的αGG产物分离方法还比较少;目前只有奥地利格拉茨工业大学的GOEDL等[13]人(2008)通过混合活性炭与硅藻土为分离介质从酶反应体系中吸附-洗脱获得了较高纯度的αGG[15]。

2 αGG的结构和性质
αGG的基本理化性质如表1所示:

表1 αGG的理化性质
αGG不仅可以在密罗木中发挥“复活”作用,对人体皮肤也具有保湿、防紫外线伤害等效果。αGG如今在护肤行业受到广泛关注,非常适合添加在天然类护肤品中。αGG不仅可以作为化妆品保湿,也可以作为细胞激活剂使用[16],因为其具有以下优异性能:①增加细胞活力和新陈代谢;②激活再生皮肤细胞;③增强皮肤细胞的抗氧化能力(SOD);④加速老化细胞中Ⅰ型胶原蛋白前体的合成。除了以上功效之外,αGG还具备一定的保健功效。研究发现αGG在治疗过敏性呼吸系统疾病[17]、保护眼角结膜[18]等具有潜在应用价值;另外,αGG与目前具有代表性的抗糖尿病药物voglibose有着相似的结构,所以其对肠道内双糖消化有相似的抑制作用,因此在降低血糖方面也可能发挥一定作用[19]。对于αGG还有众多功效和性质未被发现,但目前所展现出的性质已有了足够的利用价值,相信随着对其更加深入的研究,将会被运用到更多的领域。
3 αGG的制备方法
目前合成αGG的方法主要有化学法、酶催化合成法以及合成生物学方法。
3.1 化学合成法制备αGG
Tatsuuma-Honke酿酒公司报道了通过化学法合成αGG、2S-1-αGG和2R-1-αGG的技术,它们都是米酒中甘油葡萄糖苷的活性成分。利用高碘酸钠和硼氢化钠可催化麦芽糖醇为αGG,产率有18%。之后又利用乙酸、四乙酸铅和硼氢化钠催化异麦芽糖得到的2S-1-αGG,产率为12%。以海藻糖为原料,用四醋酸铅经乙二醇裂解合成了比例为73%:27%的2S-1-αGG和2R-1-αGG混合物,但产率仅为5%。正如TAKENAKA等[2]在文献中提到的,化学合成方法得到的αGG转化率太低、副产物多,因此后续纯化步骤将是非常复杂且不经济的。
3.2 蔗糖磷酸化酶催化合成αGG
αGG也可通过蔗糖磷酸化酶催化蔗糖和甘油获得。蔗糖磷酸化酶(EC 2.4.1.7)是一种特异性的转糖苷酶[8],曾在食品和制药工业中得到了较为广泛的应用,如在低聚糖的合成中[20,21]、化合物的羟基化修饰[22]等。蔗糖磷酸化酶大都存在于嗜糖假单胞菌Pseudomonassaccharophila[23]、长双歧杆菌Bifidobacteriumlongum[24]、巨大芽孢杆菌Bacillusmegaterium[25]、变异链球菌Stococcusmutans、肠膜明串珠菌Leuconostocmesenteroides中。蔗糖磷酸化酶(EC 2.4.1.7)属于13糖基水解酶的酶家族[26],主要催化两种反应:第一类,把蔗糖中的葡萄糖基转移到受体上。例如,磷酸在蔗糖磷酸化酶催化下能够生成1-磷酸-葡萄糖和D-果糖[26];第二类,它可以把1-磷酸-葡萄糖中的葡萄糖基转移到受体中。例如,D-果糖和1-磷酸-葡萄糖在蔗糖磷酸化酶催化下能够生成蔗糖。在没有外部影响的条件下,蔗糖磷酸化酶(EC 2.4.1.7)催化蔗糖和磷酸盐转变成α-葡萄糖1-磷酸(α-G-1-P)和D-果糖的可逆转化[27]。在不存在磷酸盐的情况下,甘油可以拦截与蔗糖反应的β-葡糖基酶中间体以产生αGG,另有微弱的水解副反应发生。因为在野生型菌株中有着非常复杂的代谢调控机制,所以在野生型菌株中的蔗糖磷酸化酶含量很低。自然菌株发酵生产得到的蔗糖磷酸化酶产量少,所以使用这种方法无法满足工业大规模生产运用的需求。因而,使用基因工程方法构建重组菌株,使肠膜明串珠菌大量表达,这对工业化大量生产αGG、提高生产效率有很大的帮助。目前使用最广的蔗糖磷酸化酶主要来自于BifidobacteriumlongumsplP、Bifidobacteriumadolescentis[28]和Leuconostocmesenteroides[29]的基因。其中BifidobacteriumlongumsplP基因长度是2.7 kb,已有报道的蔗糖磷酸化酶与其推测的氨基酸序列酶有较高同源性;在大肠杆菌中进行表达后,生成分子量为56 kDa的蛋白。在肠膜明串珠菌中,蔗糖磷酸化酶含有1 479个核苷酸,在大肠杆菌进行表达后所得重组蛋白相对分子量也在56 000左右。使用1-磷酸-葡萄糖和蔗糖作为供体时,蔗糖磷酸化酶都普遍具备受体特异性。在培养基优化后,获得的蔗糖磷酸化酶活性可达1.49 U/mg。BifidobacteriumadolescentisSucP基因包含1 515个核苷酸,它在大肠杆菌中进行表达后,获得了二聚体酶,它的分子量为58 kDa。BifidobacteriumadolescentisSucP与蔗糖磷酸化酶基因具有很高的同源性[30]。蔗糖磷酸化酶当用1-磷酸-葡萄糖当作糖基供体时,只能用阿拉伯糖、阿拉伯糖醇以及木糖醇作受体,但以蔗糖作糖基供体时,受体范围比较广,并且活性更高[31]。
3.3 通过合成生物学制备αGG
αGG的合成可以通过由盐胁迫处理寡养单胞菌(StenotrophomonasrhizophilaDSM14405)[14]或蓝藻等微生物[32]合成。与化学合成法和酶合成法相比,通过微生物合成GG具有产物成分简单、转化过程环境友好等优势。蓝藻(又叫蓝绿藻或蓝细菌)是原核生物,大多数蓝藻的细胞壁外面有胶质衣,因此又称为粘藻。在藻类中,蓝藻是最简单、最原始的单细胞生物,如微囊藻、念珠藻、鱼腥藻等。蓝藻没有细胞核,细胞中央有核物质,通常呈颗粒状或网状,色素均匀的分布在细胞质中。核物质没有核膜和核仁,但具有核的功能,故称为原核(或拟核)。蓝藻中有环状DNA质粒,担当运载体的作用。为了适应环境中的盐胁迫,蓝藻合成并积累包括αGG在内的一些相容性物质用于平衡细胞内外的渗透压和水势[32]。通过基因工程手段改造蓝藻集胞藻Synechocystissp. PCC6803,提高了蓝藻细胞中αGG的合成效率并实现了αGG产物向胞外的部分分泌[33]。αGG的生物合成水平取决于蓝藻的培养条件,尤其是外部氯化钠的浓度,在氯化钠的最大允许浓度范围内,αGG的生物合成是随着胞外氯化钠浓度的增加而增加[34]。除了盐,还有氮、二氧化碳和光的供应也可能影响蓝藻细胞中αGG的合成[35]。利用蓝藻生产αGG,能够在单一细胞内实现从二氧化碳到αGG产品的直接转化,具有高转化效率和低碳排放的特点,但蓝藻生产过程难以放大,因此该法制备αGG应用于工业化生产还有待时日。总之,现在已经开发了特别有效和选择性的转糖苷酶方法。这个过程应该为αGG作为工业化学品的生产提供基础,但是由于大多数产品的生产成本较高以及产品产率较低等限制,因此目前仍处于起步阶段。
4 αGG的分离与纯化
虽然现阶段已有多种αGG合成方式,但已报道的αGG下游分离方法还比较少。到目前,仅有利用活性炭以及树脂吸附分离αGG产物的研究报道。粉末活性炭以及葡聚糖凝胶G-15都能有效地从含有αGG的反应液中吸附分离αGG。但是当葡聚糖凝胶G-15处在高盐条件下时,αGG就不能被有效地洗脱出来。而粉末活性炭不单单能够从高浓度αGG标准样品中将αGG吸附分离出来,也能够从盐胁迫蓝藻培养液中(也就是含盐的αGG溶液)吸附分离αGG;再利用高效液相色谱进一步对产物进行分离纯化,使αGG达到较高纯度。但现有的分离纯化方式费用较高,过程相对复杂,对αGG工业化生产及应用有很大的限制。
4.1 葡聚糖凝胶G-15层析柱分离有盐溶液αGG
将葡聚糖凝胶G-15干粉进行预处理,使葡聚糖凝胶G-15干粉达到完全溶胀的状态[36];使用预先处理后的葡聚糖凝胶G-15吸附分离αGG,洗脱液为蒸馏水,控制流速为0.8 mL/min,采集吸附分离后的αGG溶液。在高盐条件下的GG溶液,虽然葡聚糖凝胶G-15对αGG的吸附率可以达到100%,但是结果显示,对于有盐αGG溶液,αGG的洗脱率仅有35.5%。这有可能是由于有盐αGG溶液中的高浓度的盐离子(约600 mmol/L氯化钠)干扰了αGG洗脱,造成αGG洗脱率偏低[37]。
4.2 活性炭吸附分离αGG
取αGG溶液25 mL,按一定比例加入粉末活性炭,密封,在温度28 ℃、速度120 r/min的摇床上震荡30 min后取出,用真空抽滤器抽滤,将得到的已吸附样品的活性炭用不同浓度的乙醇进行重悬;相同条件下摇床震荡30 min后取出,进行真空抽滤,取滤液。将吸附前、吸附后以及乙醇洗脱后得到的液体,各取样1 mL稀释50倍,按相同的方法进行离子色谱测试[38]。结果表明粉末活性炭对不同浓度的标准αGG溶液中的αGG都有吸附作用,且对1.7 g/L~12 g/L这一浓度范围的αGG都能有效吸附和洗脱。此外,粉末活性炭能够有效吸附蓝藻集胞藻PCC6803突变株ΔggtCDΔggPR培养液中的αGG,吸附率为83%左右,而乙醇洗脱率也可以达到70%以上。对于有盐的αGG溶液,当活性炭使用量小于5 g时,含盐的αGG溶液的洗脱率随着活性炭用量的增加逐步升高;但当使用量大于5 g时,洗脱率却有所下降。这可能是活性炭用量过少时,活性炭未能充分吸附溶液中的αGG,因而降低了洗脱率。而活性炭用量超过一定量时,溶液浓度是固定的,被吸附的αGG的量也是固定的,从而造成洗脱率下降;随者乙醇浓度的增加,粉末活性炭对αGG溶液吸附后的洗脱率也随之逐步增加。当乙醇浓度为50%时,粉末活性炭对αGG的洗脱能力最大,洗脱率可以达到75%以上。当再一次提高乙醇浓度,洗脱率却有所下降,因为粉末活性炭为非极性吸附剂[39];随着乙醇-水的比例增加洗脱能力随之增强,当比例达到1∶1时,洗脱能力最大。综上,确立了活性炭用量5 g,浓度50%的乙醇为活性炭从有盐αGG溶液中吸附分离αGG的最佳条件,得到83.9%αGG吸附率,76.6%洗脱率。
5 甘油葡萄糖苷αGG的应用
αGG是微生物在胁迫条件下合成的一种渗透保护物质(osmolyte);它可以保护细胞免受高渗透压、高温、干旱和紫外线等恶劣环境的破坏,因此αGG可作为细胞激活剂[16]。另外,αGG可作为蛋白质和酶的稳定剂,能够在高温或冷冻干燥条件下稳定蛋白质或酶等生物大分子结构[42]。其次,αGG还可以修复受损细胞,促进伤口愈合再生(如激光治疗、化学品致脱皮等的修复)。αGG在化妆品中充当细胞激活剂,它具有这些性能:(1)强效有力地激活细胞并且促进细胞再生;(2)增强细胞的活力和加快细胞新陈代谢的进程;(3)刺激皮肤细胞让其重新生长;(4)增强表皮肤细胞的抗氧化能力(SOD);(5)加快老化细胞中I型胶原蛋白前体合成。
5.1 αGG的保湿性能
根据德国Bitop AG公司研究发现αGG具有与透明质酸类似的锁水力,但其分子量要比透明质酸钠小5 000倍,因此其制成的化妆品肤感不粘腻,透气性好。众所周知,在低水合度时,膜之间的水很少,膜面受到侧向应力变成胶状。胶化后的膜,单个脂分子面积降低,膜厚度增加,此时αGG的渗透和体积能使水合度提高,膜间距增大,侧向应力降低,膜在低水合度状态下依然能保持流体状。随着αGG浓度的增加,渗透压也增加,在负水势状态下,高渗透压可使吸引力减小(即低负压),从而使膜间水分流失减少,膜平均间距增大,水合力减小,因此αGG能够保护细胞膜的稳定,锁住水分。德国Bitop AG公司以安慰剂做控制样,选择20名45岁皮肤正常衰老的女性测试者,每天两次涂抹含质量比为1% αGG的霜,在四周之后分别测试每名女性的皮肤保湿性、弹性以及光滑度,其实验结果发现(与安慰剂对比),使用剂量1%的αGG使皮肤的保湿性增加了23.3%,弹性度增加了93.3%,光滑度增加了61.8%。

表2 αGG合成方法的比较
5.2 αGG减轻皮肤发红(抗红疹)性能
德国Bitop AG公司对GG的抗红疹性能进行体内实验的研究,20名男、女受试者,分别在背部的4个区域涂抹(1处不涂+3处涂测试霜)含安慰剂霜、2%GG霜以及0.5%积雪草霜的三款产品,涂抹标准2 μL/cm2。利用TiVi®600测量红血球浓度,观察皮肤微循环变化,在紫外线照射48 h后,涂抹含安慰剂霜、2%GG霜以及0.5%积雪草霜的3种霜,反映有积极效果的受试者比例分别为35%、76%和41%。因此,实验证明,2% αGG霜具有缓解晒伤的作用,能够极大地减少红疹,因此αGG未来可以作为防晒类产品添加剂。
5.3 αGG延缓细胞衰老
αGG能够加速老化细胞中I型胶原蛋白前体的生成。德国bitop AG公司在对αGG的延缓细胞衰老的体外实验中,利用老化的真皮成纤维细胞,分别用0.2%、0.5%、1.5%的αGG处理老化的成纤维细胞72 h,测试其老化纤维细胞合成I型胶原蛋白的能力。研究发现,用0.17%、0.5%、1.5%的αGG处理的老化成纤维细胞对比正常水平的细胞,其合成I型胶原蛋白的量分别增加了11%、27%、36%。因此,αGG能减缓真皮成纤维细胞的老化进程,提升老化细胞中胶原蛋白的生成量,能够提高细胞氧化性以及增强细胞活力。德国Bitop AG公司在测定αGG对细胞的氧化性和细胞活力影响的体外实验中,用1% αGG培养老化的细胞72 h、96 h、120 h和144 h,分别与未用αGG的老化细胞进行比较,在测定老化细胞中SOD1的量之后发现,αGG能够显著增加老化细胞中SOD1的生成量,αGG处理的老化细胞SOD1的生成量比未处理的老化细胞提高了280%。在测定细胞中葡萄糖的消耗量时发现,αGG能将老化细胞的细胞活力增加170%,使细胞的新陈代谢明显加快,ATP增加并激活细胞再生。
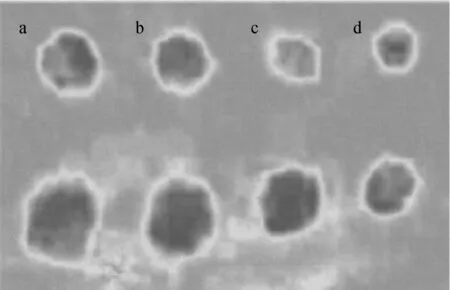
a:不涂;b:安慰剂;c:积雪草;d:GG图3 αGG及测试霜抗红疹实验对比图
5.4 αGG能促进伤口愈合/组织修复
德国Bitop AG公司在伤口愈合系列实验(间接皮肤模型和cDNA序列)中表明αGG具有优异的伤口愈合功效。与对照组(安慰剂)相比,伤口愈合速度明显加快。在间接体内皮肤模型实验中,用αGG处理伤口48 h后已经愈合。伤口愈合是应对皮肤感染的一种重要的适应性响应,对维持体内平衡必不可少[43]。受伤后,愈合过程迅速开始并经历三个阶段:发炎期、增殖期、重建期。这是一个有序复杂的过程,很多细胞在其中活跃,包括发炎、生长因子或细胞因子释放,细胞迁移以及增殖。表皮再生包括角质细胞和成纤维细胞的增殖、迁移,还有分泌影响其他细胞的细胞因子和生长因子[44],生长因子TGF-β1是一种已知的参与伤口愈合的细胞因子[45];FGF7是一种成纤维细胞和角质细胞生长因子,也参与到伤口愈合过程,而αGG能诱导这两种生长因子的表达,从而引发真皮细胞的增殖。此外,还能加强活性氧清道夫CAT,SOD2,TRDX的表达,这些活性氧清道夫的表达对伤口愈合至关重要[46]。
5.5 αGG在保健方面作用
在保健方面,αGG主要存在以下三方面作用:(1)与蔗糖不同,αGG存在的情况下人类唾液中口腔细菌不会产酸,表明αGG具有非致龋性;(2)αGG可能应用于糖尿病的治疗,αGG不可以被唾液淀粉酶、胃液或者胰腺淀粉酶消化,在实验中只能被大鼠肠道菌群部分水解。同时,αGG的存在可以有效抑制大鼠肠道菌群对麦芽糖、异麦芽糖以及蔗糖的消化,有一种治疗糖尿病的代表性药物—Voglibose与αGG有类似的结构,且对肠道二塘的消化也具有类似的作用;(3)αGG对促进益生菌生长,增强肠道耐受性极具潜力[47],这为αGG作为具有保健功能的食品添加剂提供了可能。
5.6 αGG作为大分子稳定剂方面作用
在作为蛋白稳定剂的应用方面,αGG主要是在冷冻保存过程中稳定一些商业化的蛋白产品,例如治疗用蛋白或工业化酶等,通常会发生变性从而导致失活。已经有研究通过建立一些酶保护模型证实αGG可以作为蛋白稳定剂使用[31,32]。同时,还研究了高温或者低温下αGG作为蛋白稳定剂对于不同酶的稳定作用,研究表明αGG完全可以取代传统蛋白稳定剂[48]。
6 总结
作为活性化合物,αGG显示了它对人皮肤的润湿作用,对大分子的稳定作用以及非致龋齿性。因此,αGG在化妆品、人类健康和制药行业有着许多潜在的应用。然而,市面上却很少有αGG类型的产品,其中最主要的原因是由于它的价格昂贵(3 000元人民币/kg,αGG含量50%),这可能是由于缺乏经济生产过程αGG。为了降低αGG的价格,需要创新技术来提高αGG的生产效率。在化妆品应用方面,自然界中许多天然物质都具有很好的保湿效果[49],同时这些天然提取物还对皮肤有其他营养价值,但目前生产成本过高,导致这些真正有价值的产品还未能得到普及。用天然物质中提取的优秀保湿剂代替现有的化学合成保湿剂,必将成为未来化妆品行业的焦点。

