Aurora A激酶在神经生物学领域的研究进展
乔爱敏,李洁仪,徐静雯
(1.广东药科大学生命科学与生物制药学院,生物资源和创新药物研究中心,广东 广州 510006; 2.广东药科大学生命科学与生物制药学院,广东省生物技术候选药物研究重点实验室,广东 广州 510006; 3.广东药科大学药学院,广东 广州 510006; 4.广东省先导化合物与药物发现工程中心,广东 广州 510006)
丝氨酸/苏氨酸激酶——Aurora蛋白家族,参与有丝分裂检控点调节、中心体成熟分离、纺锤体组装和维持、染色体分离以及胞质分裂等,在细胞周期中起着关键作用[1]。Aurora-A激酶在多数肿瘤细胞(包括神经肿瘤细胞)中高表达,其与肿瘤的发生和发展都有着极其重要的关系。因此,Aurora 激酶成为抗癌药物发展中至关重要的靶点[2]。但是近些年部分研究人员逐渐将Aurora-A激酶聚焦到神经方面的研究,试图去发现其在神经领域的新作用,本文主要对其在神经生物学的方面进行综述。
1 Aurora A激酶的结构
Aurora 激酶属于丝/苏氨酸激酶家族,这个家族有3个高度同源的成员即: Aurora A,Aurora B和Aurora C,这3个成员碳端均具有丝/苏氨酸激酶典型的高度保守催化亚域,但氮端无序列相似性且长度不同。Aurora A激酶是中心体相关激酶,存在于真核细胞内,编码Aurora A 激酶的基因位于染色体20q13区内,该基因表达的Aurora A 激酶蛋白约含有400个氨基酸,其碳端具有此家族保守的催化域和D-box,氮端A-box 可以将Aurora A靶向蛋白酶,再通过与D-box的共同作用介导分裂后期的降解(见图1)。其定位于中心粒,保证中心粒成熟及分离、促进细胞进入有丝分裂和纺锤丝的组装[3-5]。Aurora B是一个染色质伴随蛋白,定位于着丝粒和纺锤丝的中部,主要参与细胞有丝分裂的胞质分离过程。人们对Aurora C了解相对较少,只在睾丸组织中高表达,在分裂后期向分裂末期过渡时定位于中心体。
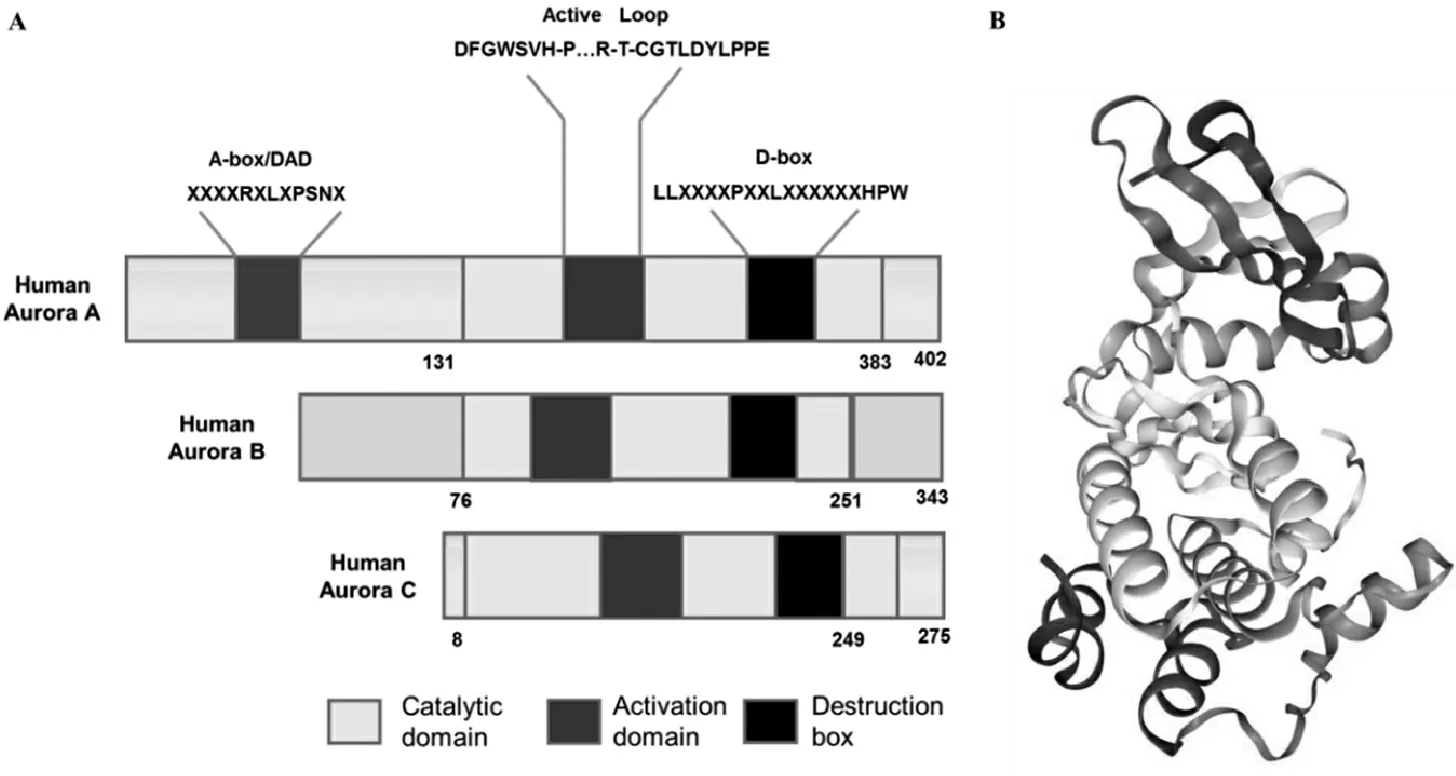
图1 丝/苏氨酸激酶家族基因结构(A)和Aurora-A激酶的晶体结构(B)[6]Figure 1 Gene structures of Aurora family (A) and crystal structure of Aurora A protein kinase (B)
2 Aurora A激酶在神经生物学领域研究
2.1 Aurora-A激酶能够调节多聚腺苷酸化进而调控神经元相关蛋白的合成
多聚腺苷酸化是指多聚腺苷酸与信使RNA(mRNA)分子的共价链结,在蛋白质生物合成的过程中,这是产生准备作翻译的成熟mRNA的方式的一部分。细胞核中绝大多数mRNA的poly A尾巴长150~200个核苷酸,这种结构有利于mRNA输出,也有利于翻译,更有利于它们免受核酸外切酶的降解。在真核生物中,多聚腺苷酸化是一种机制。Huang等[7]研究发现Aurora-A存在神经元的突触小体内,在谷氨酸刺激下,使Aurora-A激酶激活,促使CPEB(cytoplasmic polyadenylation element binding protein 1,CPEB)磷酸化(Ser174)[8-9]和αCaMKII的多聚腺苷酸化,磷酸化CPEB能够与Maskin、一些多聚腺苷酸化特殊因子结合,促进mRNA翻译,进而调控神经元相关蛋白的合成。另外,Tay等[10]研究发现,磷酸化CPEB在突触复合体能够促进SCP1和SCP3蛋白的翻译。
2.2 Aurora-A激酶参与调控神经元细胞的生长、迁移和微管的重塑
Kim等[11]研究表明,在体外培养的大鼠神经前体细胞(neural progenitor cells,NPCs)中,在神经营养因子EGF短期刺激作用下,Aurora-A激酶能够磷酸化CPEB1,进而参与调控神经元的生长,但是这一机制需要在ERK1/2激酶参与下进行。
在大脑皮层发育过程中,神经元细胞的迁移功能对神经细胞的正确定位以及神经网络的形成起着至关重要的作用。日本学者Takitoh等[12]研究发现,Aurora-A激酶通过Aurora-A-NDEL1(Aurora-A的底物)途径,调节神经元微管的重塑进而促进神经元细胞的迁移。如果用siRNA沉默Aurora-A激酶的活性或用Aurora-A激酶的特异性抑制剂处理后,导致神经元细胞的迁移能力受阻。更加有趣的是他们在研究中还发现,如果在神经元细胞迁移过程中抑制CDK5激酶的活性,则降低了Aurora-A的活性并且减少了NDEL1的磷酸化(Ser251),最终影响了神经元细胞的迁移。免疫沉淀结果显示,Aurora-A激酶和CDK5激酶能够分别与RAP2结合,因此提示CDK5RAP2通过相同的机制参与了神经元迁移过程。
Aurora-A激酶能够调控突触的再生和延伸。在突触延伸过程中,神经元细胞骨架快速重组,此时微管动力学在这一过程中起着不可或缺的作用。aPKCζ-Aurora A-NDEL1信号在此过程中起着重要作用。PKCζ能够使Aurora A激酶287位苏氨酸磷酸化(Thr287),使288位苏氨酸自磷酸化(Thr288),活化后的Aurora A激酶与TPX2 结合使NDEL1(Sre251)磷酸化,磷酸化的NDEL1能够与细胞浆的dynein,14-3-3ε 和LIS1相互作用,促进神经元细胞的生长和迁移。当神经元完成迁移以后,NDEL1 与dynein 和 DISC1作用,进而促进突触的再生和延伸[13-14]。
2.3 Aurora-A激酶参与调控神经元细胞的极化
神经细胞是单向传递的,兴奋只能由轴突传递到树突上,虽然受刺激部位的兴奋传导是双向进行的,但是只有树突才有突触小体,所以只有由树突传导出的兴奋能够传递到其他神经细胞中。已有研究表明,Par3(partitioning-defective complex 3)在神经元中具有多方面的功能,它能够调节Par复合物和Smurf2蛋白的转运和激活Rac。另外,在神经元中,aPKC能够通过磷酸化使GSK3 (glycogen synthase kinase 3)和Mark2失活,促进神经元轴突的延伸。Khazaei等[15]研究发现,Aurora A激酶能够与Par3的aPKC结合位点结合,导致Par3(Ser962)磷酸化,磷酸化的Par3(Ser962)参与了神经元细胞的极化,如果抑制Aurora A激酶的活性,Par3不能在Ser962位磷酸化,结果神经元细胞的极化功能丧失。
3 小结
Aurora A是调控细胞周期有序进展的重要丝/苏氨酸激酶,严格依赖细胞周期参与细胞的有丝分裂进程。AURKA基因的单核苷酸多态性(SNP)及其编码产物Aurora A激酶的异常表达与肿瘤的形成、发展密切相关,显示Aurora A已成为肿瘤靶向治疗的理想靶点。但是,随着生命科学研究的不断发展,研究者好奇地发现Aurora A激酶在非分裂细胞(神经元细胞)上表达。近年来研究报导揭示Aurora A激酶能够调节多聚腺苷酸化进而调控神经元相关蛋白的合成;参与调控神经元细胞的生长、迁移和微管的重塑;参与调控神经元细胞的极化等。这些研究将为Aurora A激酶在脑部疾病治疗上提供了重要的理论依据。

