基于网络药理学和分子对接技术预测复方绞股蓝胶囊治疗口腔扁平苔藓的分子机制
李悦悦,章斌,陈慧瑾
(上海交通大学医学院附属第九人民医院药剂科,上海 200011)
口腔扁平苔藓(oral lichen planus,OLP)是一种常见口腔黏膜慢性炎症性疾病,其患病率为0.1%~4%[1]。由于长期糜烂,病损有恶变倾向,癌变率为0.4%~12.5%[2]。目前治疗OLP的一线用药包括肾上腺皮质激素类药物、免疫抑制剂和氯喹等,这些药物虽能缓解OLP急性发作期症状,但病情容易反复,且有明显的毒副作用。复方绞股蓝胶囊是我院的特色制剂,其以绞股蓝为主药,另添加灯盏花素,具有提高机体免疫力、活血化瘀之功效。临床研究表明,其对OLP等斑纹类疾病的损害范围和上皮异常增生改善作用显著[3-6],但目前对复方绞股蓝胶囊治疗OLP、预防恶变的物质基础与作用机制尚不清楚。网络药理学是利用生物学数据库,采用系统生物学方法,通过构建“疾病-基因-靶点-药物”互作网络,观察药物对疾病的干预与影响。分子对接则是根据大分子受体的结构特征,及受体与配体小分子之间的相互作用来预测药物与受体的结合方式及其亲合力的一种理论模拟方法[7]。本文采用以上两种方法对复方绞股蓝胶囊治疗OLP的分子机制进行研究,预测复方绞股蓝胶囊的主要活性成分,为OLP等斑纹类疾病的治疗提供理论依据。
1 材料与方法
1.1 数据库与软件
本研究使用的数据库与软件包括:中药系统药理学数据库与分析平台TCMSP (http://tcmspw.com/tcmsp.php)、有机小分子生物活性数据库Pubchem (https://pubchem.ncbi.nlm.nih.gov)、生物活性小分子靶向预测平台SwissTargetPrediction(http://www.swisstargetprediction.ch)、通用蛋白质数据库 Uniprot (https://www.uniprot.org)、人类基因综合数据库 Genecards (https://www.genecards.org)、在线人类孟德尔遗传数据库OMIM(https://omim.org)、网络拓扑属性分析软件Cytoscape3.6.1、蛋白互作平台STRING version 11.0(https://string-db.org)、三维分子模型软件Pymol 1.8、分子建模和模拟平台Discovery Studio 3.5和分子对接软件AutoDock Vina。
1.2 建立复方绞股蓝胶囊候选化合物库
利用TCMSP数据库,分别以“绞股蓝”和“scutellarin”(灯盏乙素)为关键词检索,根据口服生物利用度(oral bioavailablity,OB)>30%和类药性(drug likeness,DL)>0.18 的原则筛选候选化合物,并获得其作用的靶点信息[8]。对TCMSP数据库无靶点信息的候选化合物,通过PubChem数据库获得其Canonical SMILES,将其导入Swiss Target Predicition数据库补充空缺的成分靶点。
1.3 药物作用靶点筛选
在 Genecards和OMIM数据库中输入关键词“oral lichen planus”,得到OLP相关靶基因。将OLP相关靶基因与药物作用靶点基因映射筛选,找出两者的交集基因,为复方绞股蓝胶囊治疗OLP的靶点。采用Cytoscape 3.6.1软件构建复方绞股蓝胶囊治疗OLP的“疾病-活性成分-靶点”网络图,其中“节点”分别代表活性成分和靶蛋白,“边”代表成分与靶点之间的作用关系。
1.4 靶蛋白相互作用 ( protein-protein interaction,PPI) 网络的构建
在STRING version 11.0平台构建靶蛋白相互作用( protein-protein interaction,PPI) 网络。物种设为“Homo sapiens”(人类) ,最低相互作用阈值设为中等置信度“medium confidence”0.4,其余参数保持默认设置[9]。将得到的基因数据导入Cytoscape 3.6.1,进行Network Analysis分析。
1.5 基因本体论(GO)生物过程和京都基因与基因组百科全书(KEGG)通路富集分析
运用R语言将复方绞股蓝胶囊作用于OLP的靶点转化成entrez ID;使用clusterProfiler包对其进行数据处理和可视化处理,得到GO和KEGG富集分析的柱状图、气泡图、通路图及含有P值的数据。柱状图和气泡图仅显示P值最小的前20个功能或通路;最后用Perl将转化的entrez ID转变为原始的基因靶点。
1.6 分子对接
将复方绞股蓝胶囊的主要活性成分与预测的OLP主要靶点进行分子对接。使用ChemBio3D获得复方绞股蓝胶囊活性成分的3D结构,并使用AutoDock软件进行加氢、加电子等操作,观察可扭转的化学键个数。从RCSB数据库(https://www.rcsb.org/)下载靶蛋白的结构,使用Pymol软件去除溶剂分子与配体,使用AutoDock软件进行加氢、加电子等操作。完成后使用AutoDock Vina进行半柔性分子对接,对对接结果进行分析处理。
2 结果
2.1 复方绞股蓝胶囊治疗 OLP的主要活性成分筛选
利用TCMSP数据库对绞股蓝进行挖掘,共收集到203个化学成分,根据OB>30%, DL>0.18的原则,得到24个活性成分,再加上灯盏花素(scutellarin),共25个活性成分。
2.2 复方绞股蓝胶囊活性成分作用于OLP的靶点预测与筛选
通过Genecards数据库和OMIM数据库挖掘到OLP相关靶基因 365个,将其与TCMSP、Swiss Target Predicition预测得到的204个药物作用靶基因映射,得到54个共同靶基因。将数据导入Cytoscape 3.6.1软件,构建复方绞股蓝胶囊治疗OLP的“疾病-活性成分-靶点”网络图(图1)。共筛选出15个复方绞股蓝胶囊作用于OLP的活性成分,如表1所示,其中11个成分为皂苷类化合物,其作用靶点大致相同,如Gypenoside LXXIV、Gypenoside LXXIX和Gypenoside XXXII均作用于HPSE、FGF2、VEGFA、BCL2L1和IL2 等5个靶点。灯盏乙素、鼠李秦素和槲皮素均为黄酮类成分,其中槲皮素的作用靶点数最多,为49个。从作用靶点的角度分析,白细胞介素-2(IL-2,节点连接度=8)拥有最多相互作用的配体,其次是前列腺素内过氧化物合酶2(PTGS2,节点连接度=8)、血管内皮生长因子A(VEGFA,节点连接度=7)、乙酰肝素酶(HPSE,节点连接度=6),成纤维细胞生长因子2(FGF2,节点连接度=6)和促生存因子(BCL2L1,节点连接度=6)。这表明他们是复方绞股蓝胶囊治疗OLP作用的主要靶点。15个活性成分共作用于54个靶蛋白发挥OLP治疗作用,体现了复方绞股蓝多组分、多靶点的作用机制。
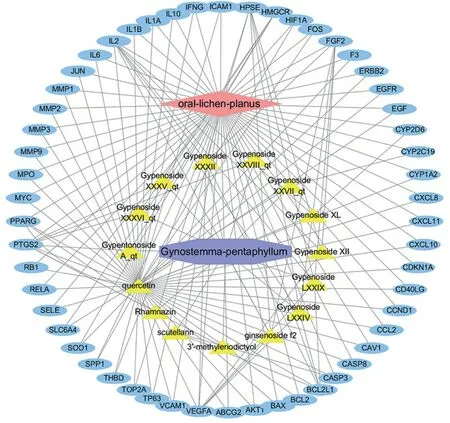
图1 复方绞股蓝胶囊治疗OLP疾病-活性成分-靶点网络图Figure 1 Disease-active component-target network of compound Jiaogulan capsule in the treatment of OLP
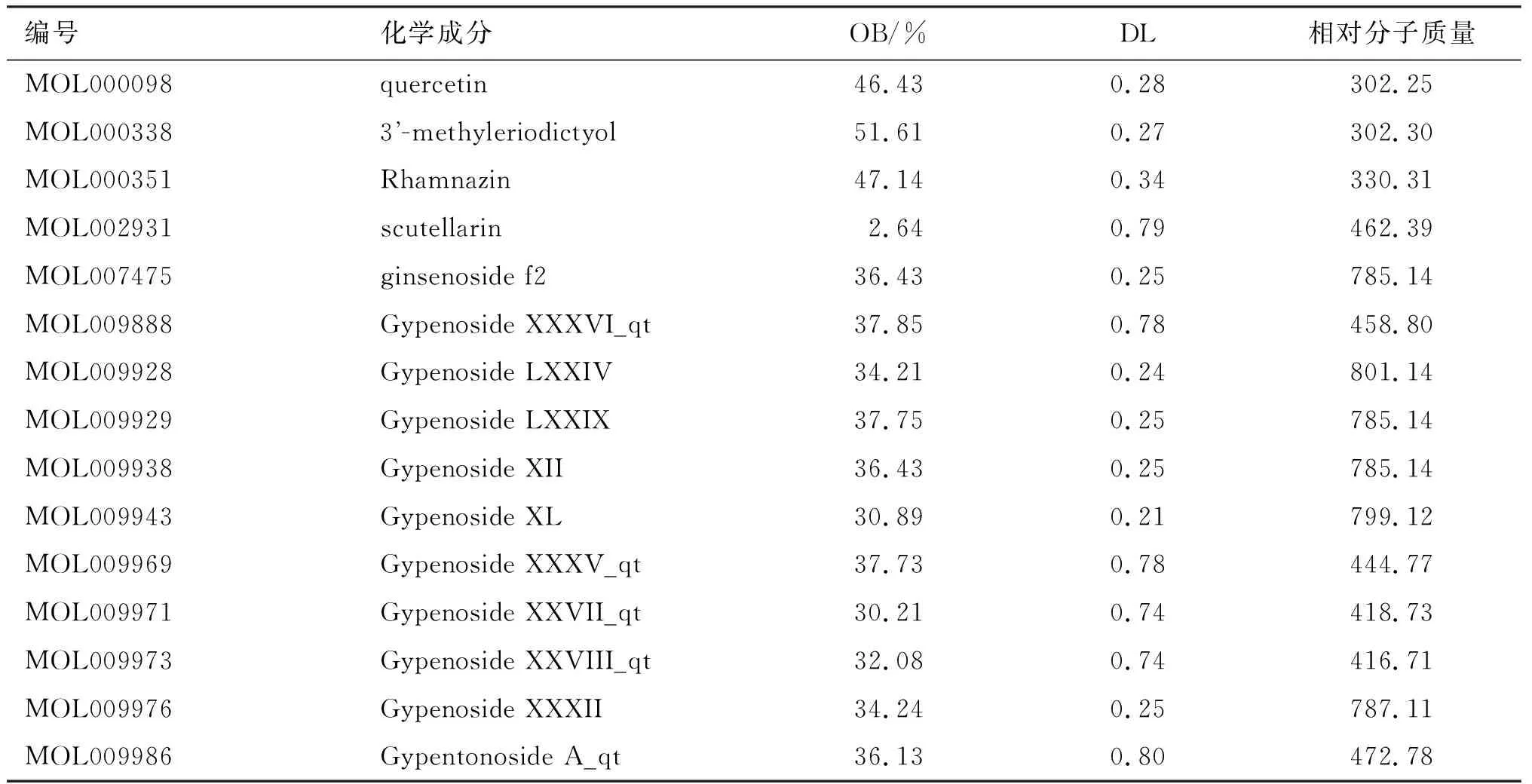
表1 复方绞股蓝胶囊作用于OLP主要活性成分信息Table 1 Information on the main active components of compound Jiaogulan capsule in OLP
2.3 PPI网络分析
采用STRING version 11.0网络平台对筛选出的复方绞股蓝胶囊治疗OLP靶点进行PPI分析,将PPI得分大于0.4的基因数据导入cytoscape 3.6.1 软件进行Network Analysis分析,靶蛋白PPI网络图如图2所示。靶点的度值和介数中心数越大,说明靶点越处于PPI网络中心,越能发挥关键作用。靶点圆越大,表明度值越大;颜色越接近橙色,表明介数中心数越大。度值和介数中心数均较大的排名前10靶点名称、Uniprot ID号、度值和介数中心数见表2所示。
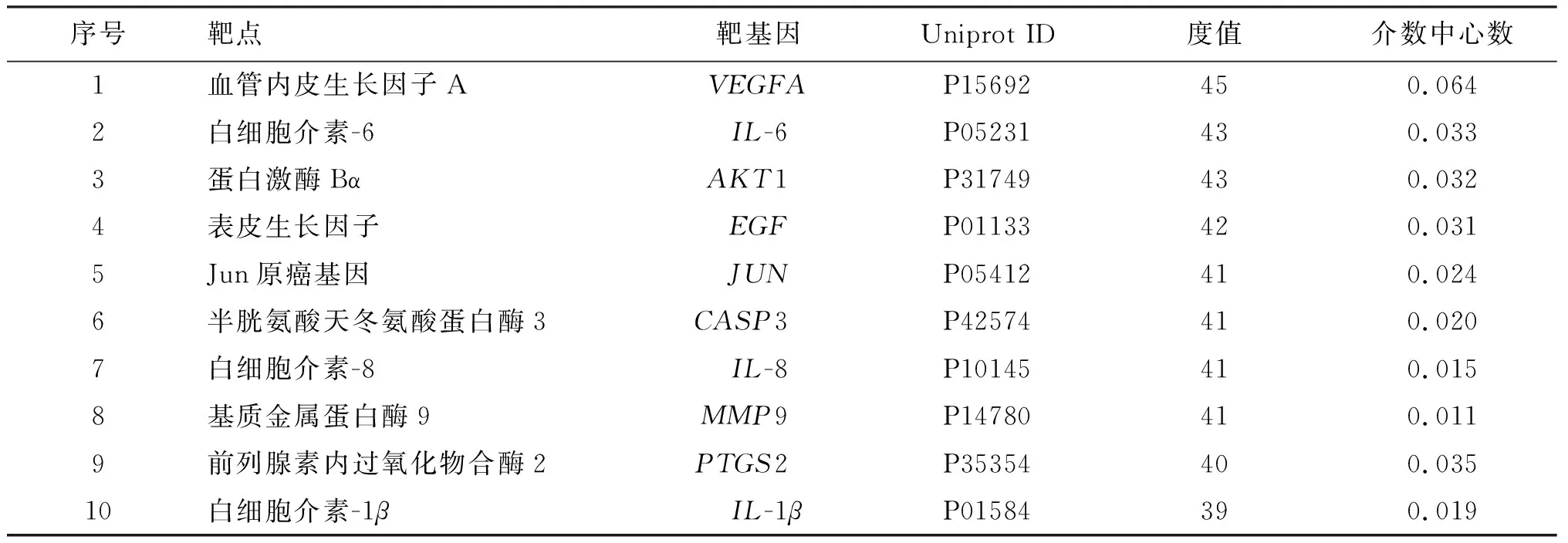
表2 复方绞股蓝胶囊治疗OLP靶蛋白PPI网络中的关键靶点及其拓扑参数Table 2 Key targets and topological parameters in PPI network of target protein of compound Jiaogulan capsule in the treatment of OLP

图2 复方绞股蓝胶囊治疗OLP靶蛋白的PPI网络图Figure 2 PPI network of compound Jiaogulan capsule in the treatment of OLP
2.4 GO功能富集分析
将预测得到的54个作用靶点通过基于R语言的clusterProfiler进行GO富集分析。共获得62个功能,前20个功能的GO功能富集的柱状图,如图3a所示。横坐标表示靶点数,左边表示富集的功能,P值由颜色表示,值越小越偏向红色,反之偏向蓝色。富集靶点较多的功能包括细胞因子活性(cytokine activity)、细胞因子受体结合(cytokine receptor binding)和受体配体活性(receptor ligand activity)等。
2.5 KEGG通路富集分析
通过KEGG分析复方绞股蓝胶囊治疗OLP预测靶点的通路分布,结果共有14条KEGG代谢通路参与其中,如图3b所示,主要涉及内分泌抵抗(endocrine resistance)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)、低氧诱导因子1信号通路(HIF-1 signaling pathway)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction) 和EGFR酪氨酸激酶抑制剂耐药 (EGFR tyrosine kinase inhibitor resistance)等。由此可见,复方绞股蓝胶囊通过调节多条代谢通路共同发挥治疗OLP的作用。
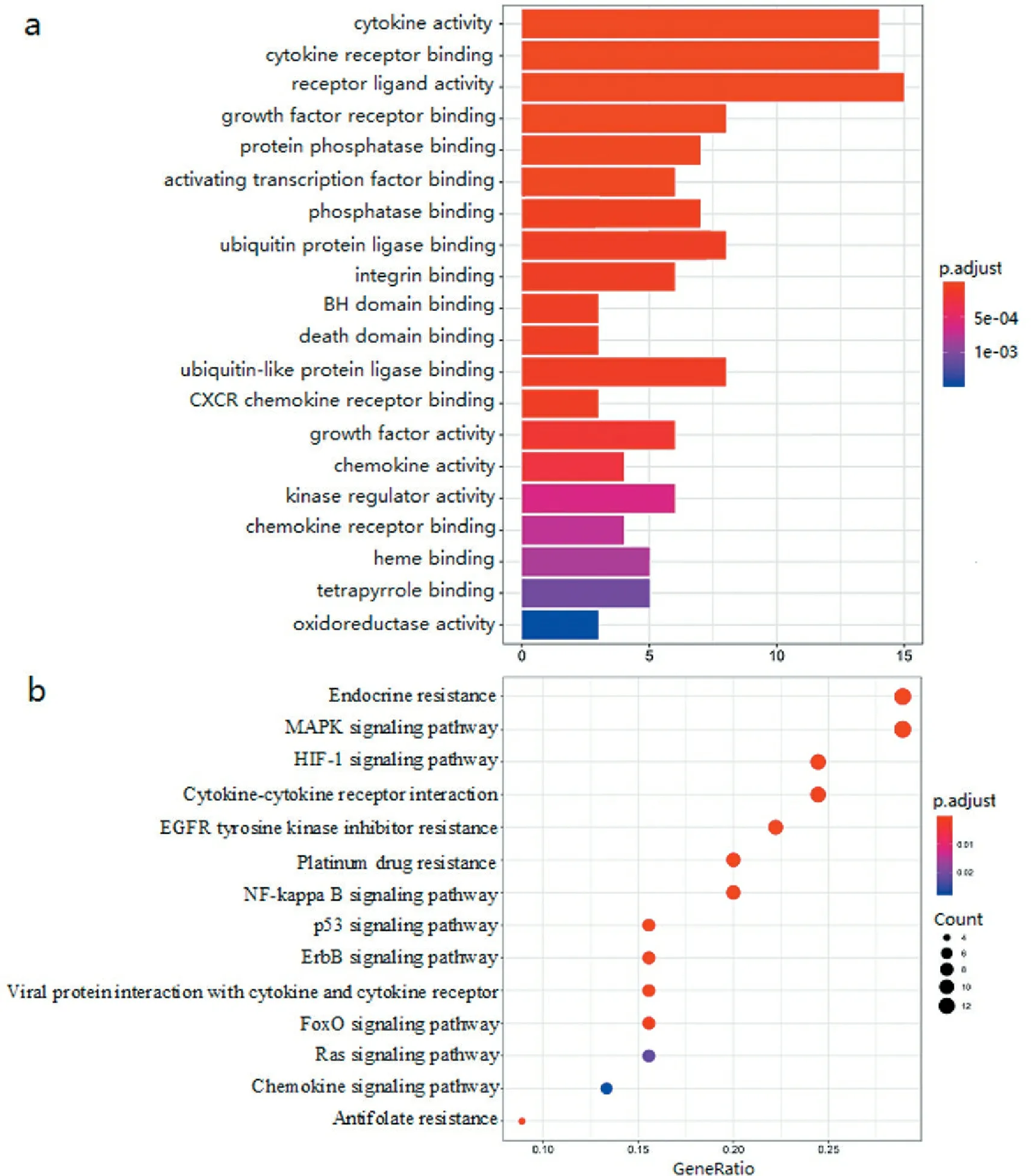
a. GO富集分析; b. KEGG通路富集分析。
2.6 复方绞股蓝胶囊活性成分与靶蛋白分子对接结果
将筛选出的复方绞股蓝胶囊中的15个活性成分与排名前4的靶点VEGFA、IL6、AKT1和EGF进行分子对接,选取打分最高(affinity数值最低)的构象作为对接构象,并利用pymol程序对其进行可视化分析[10]。每种活性成分产生10种对接结果,结合能越小说明受体与配体之间的亲和力越大,因而选取结合能较低且构象较好的结果作为分子对接结果。所有成分与靶点的结合能均小于-5 kcal/mol,如表3所示。Scutellarin、Gypenoside XII、ginsenoside f2和Gypentonoside A_qt与4种靶蛋白对接的平均结合能值最低,其典型对接结果如图4所示。
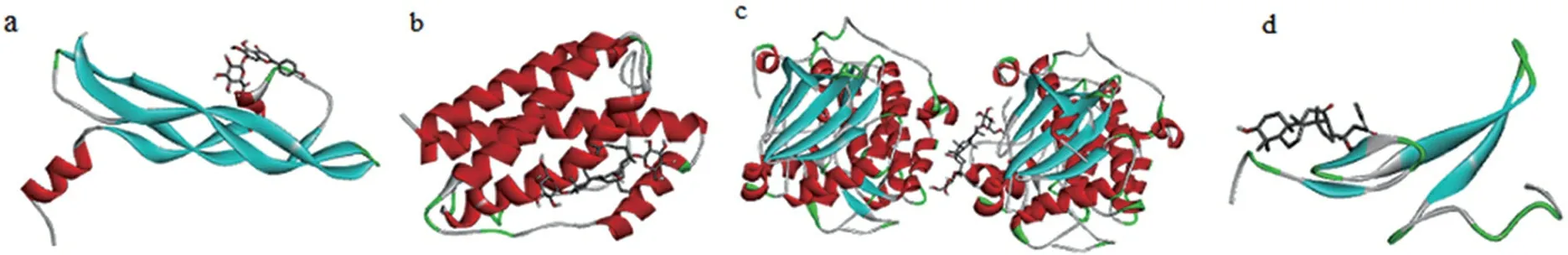
a. scutellarin与VEGFA; b. Gypenoside XII与IL6; c. ginsenoside f2与AKT1;d. Gypentonoside A_qt与EGF。
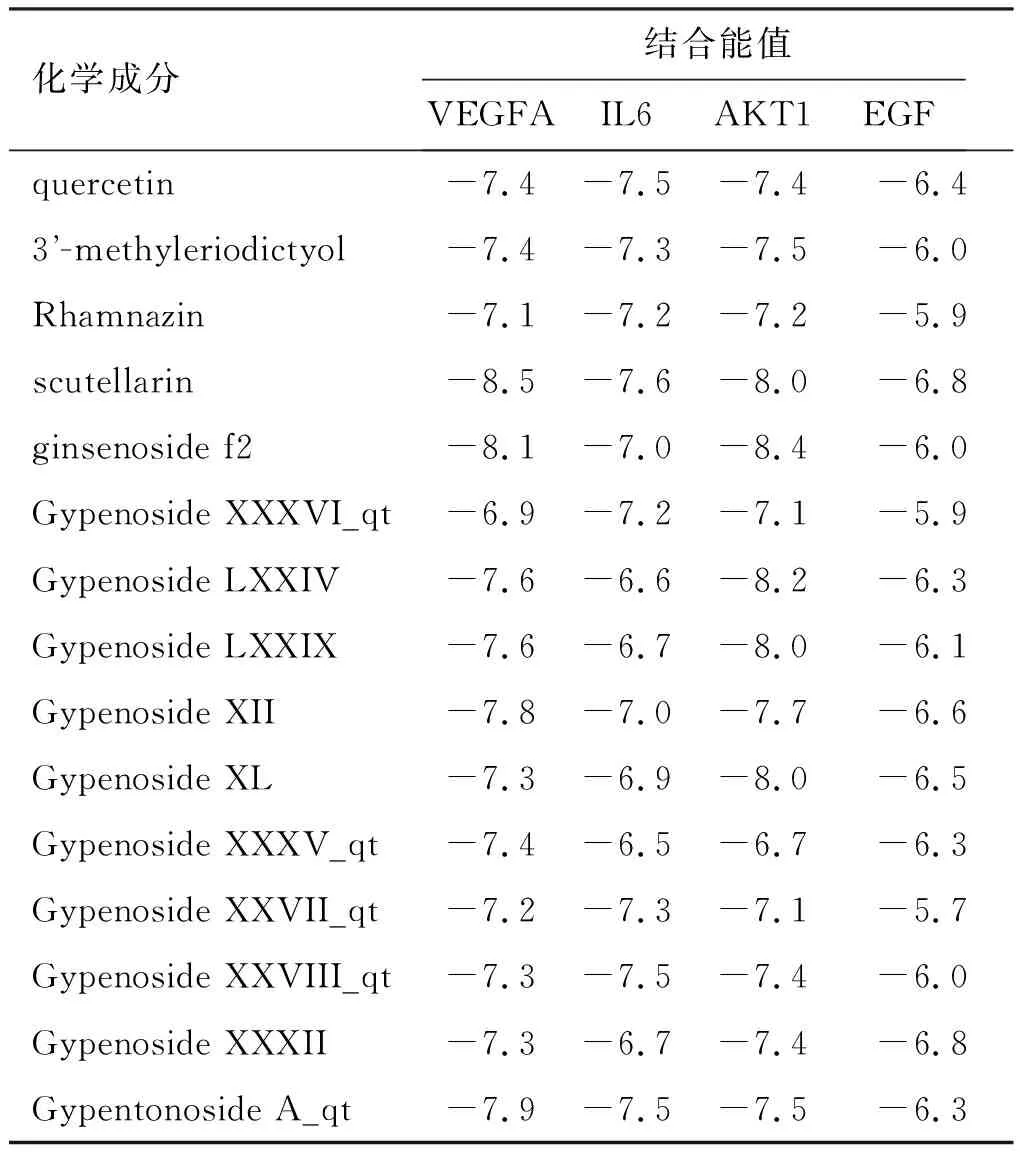
表3 复方绞股蓝胶囊治疗OLP的4个重要靶点的分子对接Table 3 Molecular docking of four important targets of compound Jiaogulan capsule in the treatment of OLP
3 讨论
OLP的病因和发病机制目前仍不明确,目前大多数研究认为该病与免疫反应的异常有关。以往研究证实细胞因子、生长因子、细胞黏附分子、基质金属蛋白酶等均参与了病损局部的炎症和免疫反应,在介导这一异常的免疫反应中起着主要作用[11-14]。通过PPI网络分析,推测出复方绞股蓝胶囊治疗OLP的主要靶点,包括VEGFA、IL6、AKT1、EGF和MMP-9等。VEGFA是目前发现的最有效的血管生成促进因子之一,影响内皮细胞的血管通透性、增殖和活力;基质金属蛋白酶-9 (MMP-9)是明胶酶的一种,能分解某些组织中的结构复合物,还能调节其他蛋白酶及细胞因子的活性,其可通过释放血管内皮生长因子(VEGF)参与血管生成,VEGF和MMP-9在单纯的OLP或者异常增生的OLP中都有相应的增高表达[15-16]。IL-6是一种具有广泛免疫调节活性的细胞因子,已有多项研究表明,其在OLP患者的血清和唾液中具有较健康人升高的表达,在OLP发病机制中可能起到较为关键的作用[17-18]。AKT是PI3K的下游靶标,活化后的AKT蛋白将其底物磷酸化,成为很好的细胞存活因子,进而能使细胞进入分裂周期,促进细胞生长并抑制其凋亡,这大大增加了细胞癌变的几率,AKT因此也被认为是一种原癌基因[19-20]。表皮生长因子(EGF)是一种强有力的角质形成细胞分裂剂,通过表皮生长因子受体(EGFR)介导对多种组织细胞具有促进增殖作用,EGF和EGFR蛋白表达在OLP向口腔鳞状细胞癌(OSCC)的转变中作为OSCC早期诊断的客观指标之一[21]。
GO功能富集结果显示,复方绞股蓝治疗OLP的潜在作用机制多集中在调节细胞因子活性、细胞因子受体结合和受体配体活性等。KEGG通路富集分析排名前5位的信号通路分别为内分泌抵抗、丝裂原活化蛋白激酶信号通路、低氧诱导因子1信号通路、细胞因子-细胞因子受体相互作用和EGFR酪氨酸激酶抑制剂耐药。OLP多发于中老年女性,内分泌及代谢紊乱是OLP发生的独立危险因素[22]。另有研究表明,情绪及社会心理因素导致的神经内分泌紊乱与OLP的发生有关[23]。内分泌抵抗与多条致癌信号通路相关,包括表皮生长因子受体、成纤维细胞生长因子受体PI3K/AKT/mTOR、MAPK/ERK和CDK4/CDK6等[14]。MAPK信号通路是炎症性疾病的关键通路,可将细胞外的信号(如应激、生长因子等)传递至细胞内,影响肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、环氧酶2(COX2)等炎性因子的生成,并参与调控细胞的增殖、分化及凋亡[24]。缺氧微环境在免疫炎性疾病发生发展中的重要性备受关注,HIF-1是缺氧诱导的转录激活因子,是氧稳态和生理反应的调节因子[25]。Westendorf 等[26]在HIF-1α基因缺乏的T淋巴细胞发现促进核心炎症因子NF-κB的过表达;Chang等[27]研究表明MMP-9是HIF-1α的下游因子之一,据此推测缺氧微环境HIF-1α/MMP-9信号通路参与OLP基底细胞液化变性。细胞因子和细胞因子受体相互作用网络被认为是炎症和肿瘤免疫学的关键方面[28],复方绞股蓝活性成分通过IL10、IL6、IL-1β、CCL2和IL-8等多种细胞因子调控细胞因子-受体相互作用,降低炎症反应。
本研究运用网络药理学结合分子对接的方法,发现复方绞股蓝胶囊中的11个皂苷类成分、灯盏乙素、槲皮素及鼠李素可能是其治疗OLP的潜在核心化合物。绞股蓝多个成分可能通过上述多个靶点协同发挥抗OLP效果,具有良好的开发前景。

