基于GEO数据库的DPN相关靶点挖掘及与芍药苷分子对接研究
陈佳,李伟,刘征,江雅琴,邢琪昌
(湘潭市中心医院药学部,湖南 湘潭 411100)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)的发病机制复杂,涉及多个靶点和通路,临床上单一的对症治疗通常难以达到理想效果。随着基因芯片技术和高通量测序技术的快速发展,基因数据大量累积,从中筛选出与DPN发生发展相关的关键基因,或许能够为DPN的后续研究和新药研发提供重要依据。芍药苷为中药白芍、赤芍、牡丹皮等主要活性成分,现代药理学研究表明芍药苷具有改善胰岛素抵抗、抗氧化、减轻神经炎症和疼痛等功效[1]。本研究拟利用基因表达综合数据库(Gene Expression Omnibus,GEO)对DPN发生发展相关的关键基因和相关通路深入挖掘,并通过AutoDock VINA分子对接工具测定芍药苷与关键靶点蛋白的亲和力,从而试图阐明芍药苷在治疗DPN上具有潜在的研究和开发价值。
1 材料与方法
1.1 研究对象
从GEO数据库(https://www.ncbi.nlm.nih.gov/)中查找DPN人群研究的mRNA基因芯片(检索词为diabetic peripheral neuropathy,物种限定为人,标本为外周血),将糖尿病(diabetes mellitus,DM)患者和DPN患者外周血对比芯片GSE95849(12 samples,基于Phalanx Human lncRNA OneArray v1_mRNA,GPL22448平台)纳入分析范围。
1.2 方法
1.2.1 差异基因选取 参考文献[2]方法,在GEO2R平台内(https://www.ncbi.nlm.nih.gov/geo/geo2r /acc=GSE95849),将样本进行分组,对两组数据做差异mRNA基因分析,按自动设计方案选出每个芯片中表达差异明显的基因,剔除|Log2 Fold Chang|<2、P>0.05,以及信息不完整的基因数据。
1.2.2 蛋白相互作用网络构建 将筛选出的差异基因导入STRING在线数据库(https://string-db.org/),获得差异基因所编码的蛋白质之间的相互作用,统计分析各个靶点的edge数,edge数越大越处于网络核心。
1.2.3 基于AutoDock VINA的分子对接 为了预测和验证DPN候选靶点与芍药苷化合物的结合亲和力,采用Autodock Vina 1.0为分子对接引擎,经殷赋云计算平台(http://www.yinfotek.com/platform)完成分子对接,用对接分数(Infinity)来评估结合亲和力。一般认为Infinity<-4.0则化合物与靶点蛋白具有较强亲和力。
1.2.4 体外验证试验 取浓度为2×106cells/mL的WEHI 274.1(小鼠单核细胞系,ATCC)的细胞混悬液1.0 mL于六孔板中,分别加入空白溶液和不同浓度芍药苷溶液作用30 min,随后加入mCCL2(30 nmol/L,R&D Systems)反应,5 min后撤去上清液,用预冷PBS清洗3遍,随后加入预冷含蛋白酶/磷酸酶抑制剂的RIPA溶液,冰上裂解10 min,离心(13 000 r/min,4 ℃,10 min),收集上清液;Western实验中取15 μL上述上清液,加15 μL上样缓冲液(2×),煮沸5 min,配置10% Tris-Glycine分离胶并上样,电泳,转模,封闭膜用TBST清洗后孵一抗(p38-MAPK,pp38-MAPK)(1∶1 000,CST),孵育过夜后洗涤,孵二抗,显影。
2 结果
2.1 差异基因筛选结果
经过对比DM组和DPN组基因表达情况,共筛选出DPN相对于DM高表达基因71个,低表达基因61个,共计132个,其分布见图1。
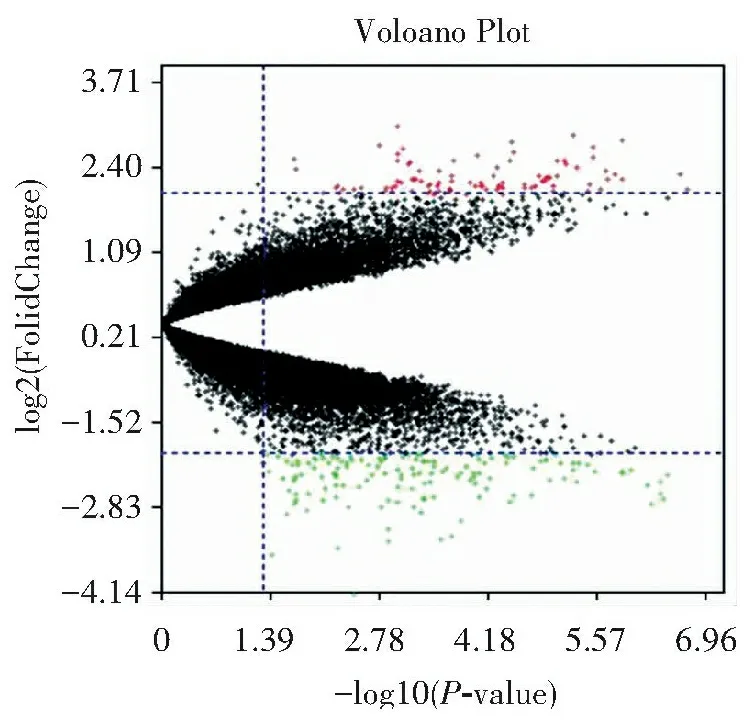
注:红色代表上调,绿色代表下调。
2.2 蛋白相互作用网络
上调差异基因编码蛋白相互作用网络,见图2A,CC趋化因子受体2(CC chemokine receptor 2,CCR2)edge数为5,即与另外5个靶点存在相互作用关系,在该网络中具有更重要的作用,因此将CCR2定为核心靶点;下调差异基因编码蛋白相互作用网络,见图2B,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)edge数为4,肿瘤坏死因子(tumor necrosis factor,TNF)edge数为6,同样定为核心靶点。

注:A.上调差异基因; B.下调差异基因;节点之间连线的粗细代表其互作关系的数据支持程度,连接线越粗代表支持数据越多;不同颜色代表蛋白的不同类别。
2.3 AutoDock VINA分子对接结果
图3是芍药苷与CCR2、TNF和BDNF的对接整体图,Infinity分别为-8.0、-5.2和-5.0,表明芍药苷与该3个靶点蛋白具有较好的亲和性。
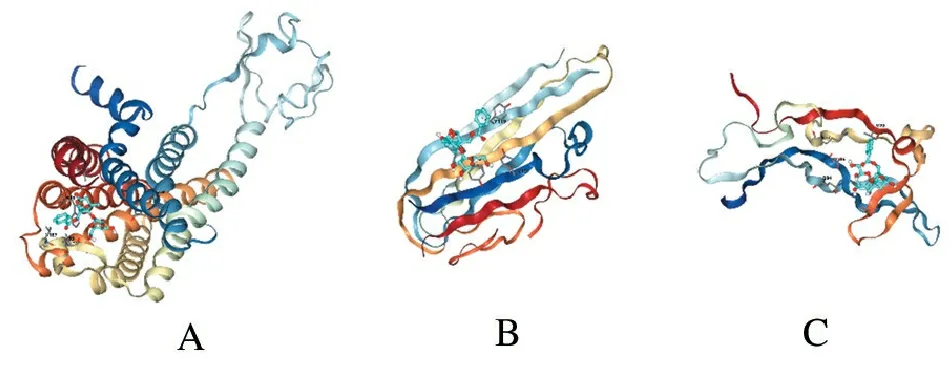
A.芍药苷-CCR2; B.芍药苷-TNF; C.芍药苷-BDNF。
2.4 体外验证试验结果
选取分子对接结果中结合能最低的CCR2靶点为验证对象,MAPK信号通路已被证明在CCR2及其配体相互作用时被激活[3],并且CCL2/CCR2参与了神经病理性疼痛[4],本研究考察不同浓度芍药苷对mCCL2激活的CCR2/MAPK的影响,结果显示mCCL2和芍药苷对p38总表达量无显著影响,而mCCL2能够激活p38磷酸化,推测芍药苷对p38的磷酸化具有抑制作用。见图4。
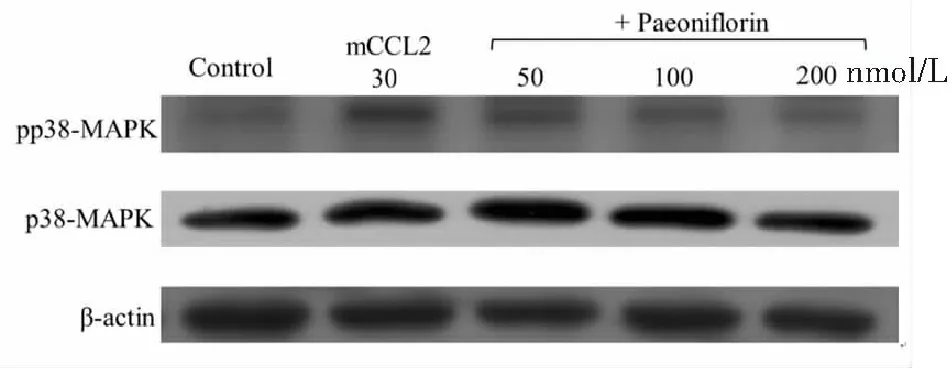
图4 芍药苷抑制WEHI 274.1细胞经mCCL2刺激的p38磷酸化Figure 4 The phosphorylation of p38 inhibited by Paeoniflorin in WEHI 274.1 cells stimulated by mCCL2
3 讨论
DPN是糖尿病常见并发症之一,其发病机制复杂,过去几十年对 DPN发病机制的研究着重于代谢通路,认为由高血糖症引发的代谢通路改变了细胞内代谢及氧化还原反应,包括多元醇通路、己糖胺通路、蛋白激酶 C通路及糖基化终末产物堆积等;近几年,出现了一些新的机制,包括脂代谢、生长因子、胰岛素抵抗及神经营养不足等[5-6]。目前,临床上对 DPN 的治疗仍以控制血糖和对症治疗为主,尚无逆转 DPN 进展的治疗方法。本研究借助于生物信息学方法,在GEO数据库中检索DPN相关基因芯片,获取6名DPN患者和6名糖尿病对照患者基因数据进行对比和分析,发现差异基因132个,其中上调基因71个,下调基因61个,随后通过构建差异基因对应蛋白相互作用网络,分析确定CCR2、BDNF和TNF处于网络核心,这些基因可能成为DPN的诊断和治疗指标。
DPN的发病机制虽尚未阐明,但其病理特征是雪旺细胞和有髓神经纤维的退化以及位于背根神经节的神经元群的丧失[7-8]。雪旺细胞合成分泌功能异常导致的局部神经营养因子不足可能是DPN发生的机制之一。
BDNF属于神经营养因子家族,是一类与神经细胞发育、分化、生长、再生和功能有重要调控作用的蛋白[9]。BDNF对外周神经损伤后神经元的存活及轴突再生有重要意义,失去内源性BDNF的作用可影响轴突生长和髓鞘化,而局部注射BDNF可以促进神经的再生[10-11];同时BDNF也是诱发神经病理性疼痛的重要启动因子之一,在多种疼痛动物模型中都可以见到BDNF在背根神经节和脊髓中表达上调,阻断BDNF的作用能有效抑制多种疼痛模型产生的痛觉过敏现象。
TNF是由活化的单核细胞和(或)巨噬细胞产生的一种细胞因子,具有选择杀伤某些肿瘤细胞功能和多种免疫调节作用,尤其在炎症反应中发挥重大作用。正常情况下,血浆中的TNF-α水平较低,但对于维持内环境稳定具有重要作用[12]。有研究发现继发病理性疼痛的发生与TNF水平具有一定关系,TNF水平升高可能是外周神经损伤患者继发病理性疼痛的一个危险因素[13]。趋化因子受体结构是一个7次跨膜的多肽链,含有具有酸性的N-末端胞外结果域和富含丝氨酸/苏氨酸的胞内C-末端。趋化因子受体激活不同的信号通路,如丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路、磷脂酶C通路(phosphlipase C,PLC)等,导致不同的功能结果,包括黏附、极化和趋化等[14]。
CCR2 是趋化因子单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的高亲和性受体,受体与配体结合后,趋化控制单核细胞,参与单核细胞介导的炎性反应[15]。有研究表明[16],在炎性疼痛模型中,MCP-1及其受体CCR2 在背根神经节中的表达明显升高,应用CCR2阻断剂可以很大程度逆转机械痛觉过敏反应[17]。
芍药苷属于单萜糖苷类化合物,具有独特的桥头氧压葡萄糖和高度氧化的笼状蒎烷(藻烷)骨架,于1963年从芍药中分离得到,目前对于芍药苷抗抑郁、抗炎镇痛、抗肿瘤、调节免疫、保肝、保护神经、抗糖尿病并发症等药理作用的研究较为深入,提示将其开发为有效的药物有一定的可能性[18]。在神经保护方面,芍药苷可能通过作用于腺苷受体、M胆碱受体、阿片受体、Ca2+通道、NF-κB等途径发挥对神经退行性疾病、脑缺血损伤、疼痛、突触可塑性损伤和神经细胞损伤等的保护或治疗作用。有报道称芍药苷缓解炎症的作用与其抑制单核巨噬细胞系统释放TNF等促炎因子有关[19],芍药苷缓解慢性炎症疼痛可通过抑制炎症因子释放,也通过抑制脊髓小胶质细胞的激活,而此过程依赖抑制 Akt-NF-κB 信号的激活[20];也有实验证明芍药苷能够有效促进高糖培养的雪旺细胞的增殖能力、上调神经生长因子基因与蛋白的表达,从而保护雪旺细胞、改善周围神经的形态和功能[21]。本研究表明芍药苷与DPN核心靶点BDNF、TNF、CCR2结合良好,能够抑制WEHI 274.1细胞经趋化因子CCL2激活引起的p38磷酸化,为进一步研究芍药苷修复神经、抗炎止痛等作用机制奠定基础。

