SYNM在大肠癌中的表达及意义
孙伯尧,于铠铭,郑 岩,孙志霞,岳新颜,姜 洋*
(1.吉林大学中日联谊医院,吉林 长春130033;2.长春中医药大学)
大肠癌(CRC)是全球第三大最常见的恶性肿瘤,全世界第二大癌症死因,研究显示,在我国大肠癌的发病人数呈稳步增长趋势,且死亡率逐年增加[1]。因此,研究探索大肠癌发生、发展过程对疾病的诊治十分重要。联丝蛋白(SYNM)是一种中间丝(IF)蛋白质,IF家族蛋白在决定细胞形状及功能、维持细胞骨架及调节细胞运动方面均发挥重要作用。与IF家族其他蛋白相比,SYNM蛋白的C末端结构域较长,具有结合纽蛋白、α-肌动蛋白等参与细胞运动,粘附和收缩功能蛋白的靶位点,是细胞黏附和转移必不可少的成分[2,3]。本文应用二维色谱-质谱联用技术和免疫印迹技术检测大肠癌及配对癌旁组织中SYNM蛋白的表达情况,旨在研究SYNM与大肠癌发生、发展的联系。
1 材料与方法
1.1 标本收集
本实验标本来自吉林大学中日联谊医院结直肠外科手术中切除的20例大肠癌及癌旁组织,经病理学证实均为DukesB期腺癌。所有患者术前均未接受过激素、放化疗治疗,且均经患者同意。标本离体后,立即用生理盐水冲洗干净,液氮速冻,放-80℃冰箱保存备用。
1.2 主要试剂与仪器
美国西格玛公司生产的碳酸氢氨、尿素、DNA 酶及 RNA 酶,美国Bio-Rad公司生产的蛋白质定量试剂盒、2-碘乙酰胺(IAM),DTT、TPCK修饰的测序级胰酶购买于美国Promega公司,1200纳升级液相色谱、LTQXL离子肼质谱仪均购买于美国Agilent公司。
1.3 方法
1.3.1组织总蛋白的提取及浓度测定 取出-80℃保存的组织标本,快速充分研磨,形成粉末状,加入裂解缓冲液,比例为每50 mg组织加入100 μl裂解缓冲液,为去除样本中的DNA、RNA向裂解好的样本中加入DNA酶和RNA酶,低温离心,所得上清液即为总蛋白。考马斯亮蓝染色,使用核酸蛋白分析仪在595 nm处测得吸光度,采用标准曲线法计算出组织总蛋白浓度。
1.3.2样品多肽混合物的制备 向提取出的总蛋白中加入25 mmol/L NH4HCO3,稀释总蛋白,降低尿素浓度。
再加入二硫苏糖1 mol,将样品终浓度调整为20 mmol/L,56℃避光还原1小时。待反应物降至室温后,加入1 mol/L的2-碘乙酰胺(IAM)混匀使其终浓度为50 mmol/L,室温避光反应半小时。向其中加入TPCK修饰的测序级胰酶,比例为混合物:胰酶=50∶1,37℃酶切过夜,第二天真空抽干,分装后置于-80℃保存。
1.3.3二维色谱-质谱联用技术分离鉴定多肽混合物 用0.1%甲酸(Buffer A)溶解多肽混合物,每50 μg样品色谱上样,流速2 μl/min,时间3小时,反向色谱洗脱后用LTQXL离子肼质谱仪分析,质核比范围设定为400-2000 amu,再采用数据依赖的方式进行二级扫描。
1.3.4免疫印迹 提取组织总蛋白并测定浓度,SDS-聚丙烯酰胺凝胶电泳分离蛋白样本,再将分离的组分转移至PVDF膜上,脱脂奶粉封闭2 h,敷一抗4度摇床过夜,第二天洗涤后加二抗反应,显影压片。
1.4 统计学分析使用SPSS11.0软件,依据SEQUEST法,对液质联用图谱进行t检验,当P<0.05时差异具有统计学意义。
2 结果
2.1 二维色谱-质谱联用技术对样本酶解混合物的分析结果
根据大肠癌组织及癌旁组织蛋白质的丰度变化进行判断,判定标准为:两组样品中谱图数的比值≥1,两组样品中谱图数的差值≥72,得出目标蛋白SYNM在大肠癌组织中表达水平明显下调,SYNM质谱结果见图1。
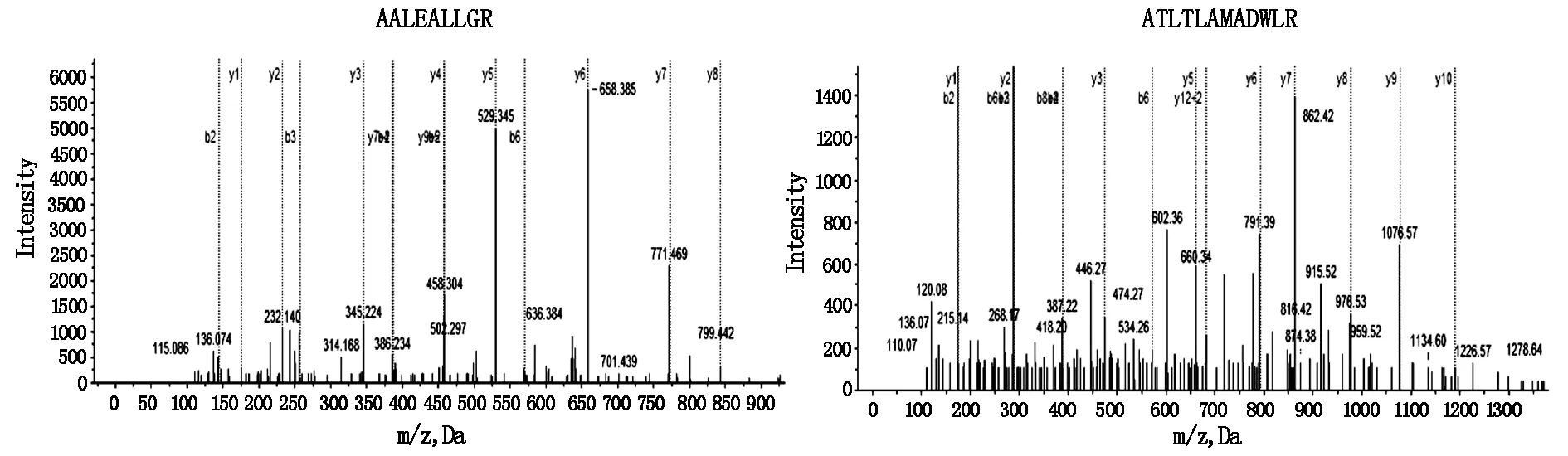
图1 SYNM质谱图
2.2 Western blot验证SYNM蛋白的表达情况
免疫印迹实验结果显示SYNM蛋白在大肠癌组织中低表达,而在配对的癌旁组织中高表达,此结果验证了二维色谱-质谱联用技术实验结果的准确性,结果见图2。
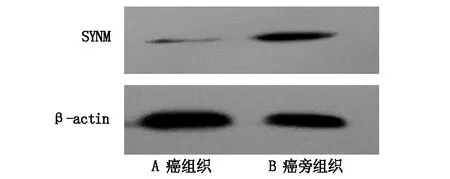
图2 大肠癌中SYNM免疫印迹图
3 讨论
大肠癌是我国最常见的恶性肿瘤之一,其发生发展是一个多基因参与、多步骤协同的渐进性过程,明确其相关基因的表达及作用,筛选出有意义的生物学标志性蛋白是当前研究热点。蛋白质组学(proteomics)技术可用于检测癌及癌旁组织中的差异蛋白,为鉴定与癌症发生发展密切相关的蛋白质提供重要的技术支持。
SYNM是IV型IF蛋白,人类synemin基因位于15q26.3号染色体上,通过选择性剪接生成两种亚型(α,β),广泛表达于大多数哺乳动物收缩型细胞(心脏,骨骼肌等)及某些非收缩性细胞(神经胶质细胞、晶状体等)[4]。由于Synemin头部结构域较短,其无法自我聚合组装成细丝,但可与Ⅲ型波形蛋白、结蛋白共聚发挥作用[5]。有研究表明,SYNM蛋白参与调节细胞的粘附及运动,其机制与LIM域蛋白zyxin相互作用有关[6]。同时,SYNM蛋白也是一种A激酶锚定蛋白(AKAP),通过调节蛋白激酶A在Z盘和肌膜上的蛋白磷酸化影响肌肉的修复和生长[7]。目前,很多学者对SYNM蛋白在肿瘤发生发展中的作用进行研究。E.Noetzel指出,SYNM蛋白在乳腺癌中下调表达,机制与SYNM启动子甲基化有关,且启动子甲基化状态可用于预测乳腺癌患者复发的风险[6]。Sun N研究发现,当用RNA干扰,诱导SYNM表达缺失时,会导致宫颈癌HeLa细胞粘附减少[8]。还有人指出,SYNM是miR-376c(一种抑癌性miRNA)的靶基因,miR-376c下调引起SYNM的异常表达可能是宫颈癌转移的主要原因[9]。A.Pitre研究显示,SYNM蛋白通过隔离PP2A(蛋白磷酸酶2A)促进Akt活化,进而对胶质母细胞瘤细胞的增殖产生正向调节作用[10]。与正常肝脏相比,人肝细胞癌中SYNM蛋白下调表达[11],Schmitt-Graeff A等人还指出,在炎性疾病的门静脉周围成纤维细胞和肝内胆管癌的上皮细胞中SYNM蛋白上调表达,因此,可以通过SYNM的表达水平区分不同形式的纤维化和肝癌[12]。还有研究显示,SYNM可能与卵巢癌的发病机制有关,是铂治疗卵巢癌独立的预后基因[13]。最新研究表明,SYNM可作为胃肠道间质细胞瘤的诊断标准,其与CD117的差异表达有助于区分Cajal的间质细胞和肥大细胞[14]。
本研究通过二维色谱-质谱联用技术证实SYNM在大肠癌组织中表达明显低于配对的癌旁组织,并运用免疫印迹实验验证了结果的准确性。但对于SYNM蛋白在大肠癌发生、发展中的作用机制尚未完全明确,是进一步深入研究的方向。

