烟草低温早花相关基因NtDUF599 的表达及功能分析
徐国云,翟 妞,许亚龙,谢小东,张 慧,郑庆霞,张剑锋,刘萍萍,陈千思,金立锋,周会娜
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
烟草是一种喜温不耐寒的叶用经济作物,在苗期遭受低温后会引起早花现象,严重影响烟叶的质量和产量[1-2]。在农业生产中,烟农主要采用农艺(移栽、打顶留杈等)、栽培(覆膜、调整育苗时间等)等措施来缓解低温引起的早花问题,但这些措施比较耗费人力、物力且只能治表。随着分子生物学的发展,基因工程可为改良烟草抵御低温早花提供理论和技术支持。
在模式植物拟南芥中,一些参与调控低温诱导早花的基因已被鉴定,并且分子作用机制也得到解析。例如HOS1 和FVE 基因缺失后,突变体均表现出耐寒性增强、花期改变等表型[3-5]。除了以上参与控制低温诱导早花的基因,一些受逆境诱导的miRNA 也被发现参与了植物花期的调控[6-8],这为研究逆境介导的早花提供了新视角。例如受低温、干旱和高盐诱导的miRNA169 可将NF-YA2降解,从而抑制FLC 的表达,最终延迟了拟南芥花期[9]。在拟南芥中,过量表达miRNA156 后会引起拟南芥花期推迟,同时耐逆性也得到增强[10]。Zhang 等[11]在栽培烟草中过量表达miRNA156 后同样发现烟草花期推迟现象,进一步说明miRNA156 参与花期调控的功能在不同物种之间存在保守性。
目前,关于烟草低温早花的分子机制研究仍停留在初级阶段,绝大部分的基因及其功能仍未明确。杨静等[12]利用基因芯片分析了K326 和抗早花品系华烟06 茎尖端花芽分化过程中基因的表达情况,对差异表达基因进行了GO 分析,但未成功筛选到抗早花相关基因。林世峰等[13]采用同源克隆的方法从烟草NC82 中克隆到拟南芥开花抑制因子Nup96 的同源基因NtNup96,但只关注了该基因的表达分析,缺乏进一步的功能验证。白戈等[14]利用烟草基因芯片进行了表达模式分析,筛选到NtMYB15 基因可能与烟草低温早花相关。将该基因在烟草中沉默后,沉默植株在低温处理后花期推迟,说明NtMYB15 参与了烟草低温早花的调控。总之,在分子生物学层面,烟草低温早花的研究仍处于起步阶段。筛选并鉴定烟草低温早花相关基因,并利用基因工程手段改良现有烟草主栽品种,对于培育出耐低温抗早花的烟草新品种具有重要的意义。基于前期RNA-Seq 分析结果,采用RNA-interfere(RNAi)技术对一个烟草低温早花相关基因NtDUF599 开展了初步的功能分析,旨在明确该基因的功能并为烟草低温早花改良育种提供理论支持。
1 材料与方法
1.1 材料、试剂和仪器
材料:栽培烟草品种K326(Nicotiana tabacum L.)和NC82 种植在国家烟草基因研究中心人工气候室,温度为26~28 ℃,相对湿度60%,光周期为16 h 光 照/8 h 黑 暗。NC82 材 料 用于RNA-Seq 筛 选低温早花候选基因,K326 材料用于遗传转化创制RNAi 转基因材料。用于基因沉默的RNAi 干扰载体pBWA(V)HS-RNAi 来源于武汉伯远生物科技公司。大肠杆菌感受态细胞DH5α和农杆菌感受态细胞EHA105 均购于北京天根生化科技有限公司。
试剂:TriZol 试剂购买自Invitrogen 公司;高保真DNA 聚合酶PrimeSTAR GXL DNA Polymerase、DNA 凝胶回收试剂盒、质粒DNA 小量纯化试剂盒、限制性内切酶购于大连宝生物工程有限公司;In-Fusion HD Cloning Plus 试剂盒购于日本宝日公司;cDNA 合成试剂盒Transcriptor First Strand cDNA Synthesis Kit 购自瑞士罗氏公司。
仪器:PCR 仪、移液器、离心机(德国Eppendorf公司);实时定量PCR 仪(美国罗氏公司);分析天平(感量0.01 mg,瑞士梅德勒公司);凝胶电泳仪器及成像系统(美国普诺森公司);Nanodrop 2000分光光度计(美国赛默飞世尔公司);NanoPhotometer spectrophotometer(德国爱普科公司);Agilent 2100 bioanalyzer(美国安捷伦公司)。
1.2 方法
1.2.1 低温处理及转录组分析
NC82 在植物生长室生长至4 叶期,随后将幼苗转移至人工气候箱进行低温处理(12 ℃,10 d)。处理结束后,采集的部分烟株叶片样品经液氮速冻后,置于-80 ℃超低温冰箱保存,其余烟株转移到植物生长室(正常条件)生长至现蕾期,采集叶片样品,其采集方法与4 叶期叶片样品采集方法相同。苗期和现蕾期叶片样品采集完成后,干冰运输至北京诺禾致源公司进行RNA 提取及后续RNA-seq 测序。未遭受低温处理且一直保持在正常条件下生长的烟株为对照(CK1)。
RNA 提取后分别使用 NanoPhotometer spectrophotometer 和bioanalyzer 检测纯度和完整性,符合转录组测序标准的RNA 交由北京诺禾致源生物信息科技有限公司进行文库构建和Illumina Hiseq 2500 平台RNA-seq 测序。原始reads经FastQC 质量评估后获得clean reads,随后使用Bowtie2 软件将clean reads 比对到烟草参考基因组(ftp:// ftp. solgenomics. net/ genomes/ Nicotiana_tabacum/)。采用Subread 软件中的FeatureCounts工具对基因表达水平进行定量,使用DESeq2 软件筛选不同状态下表达水平差异显著的基因。
1.2.2 低温诱导表达模式分析
低温诱导表达模式分析:K326 在植物生长室生长至4 叶期,将幼苗转移至人工气候箱进行低温处理,温度设置为12 ℃,分时间段取材(0、1、6、12、24、48 和96 h),样品采集后迅速在液氮中研磨,粉末装入1.5 mL 离心管后加入1 mL TriZol,上下颠倒混匀,保存于-80 ℃备用。
1.2.3 RNA 提取及cDNA 合成
RNA 提取采用TriZol 法,步骤如下:-80 ℃保存的样品在冰上冻融,加入200 μL 氯仿,振荡混匀,离心后小心取出上层水相,转入另一离心管中,加入500 μL 异丙醇,沉淀、离心分离出RNA,再经75%酒精洗涤,室温微干后,加入适当体积的RNase free 的水,充分溶解。提取后的RNA 使用NanoDrop 2000 检 测RNA 浓 度 和 纯 度。cDNA 第一链合成步骤参照Transcriptor First Strand cDNA Synthesis Kit 试剂盒说明书。
1.2.4 实时定量PCR
引物合成由上海生工生物工程有限公司完成。 NtDUF599 的 实 时 定 量 PCR 引 物 为qNtDUF599-F:5'-CTCACAGACAAATCTGATG-3',qNtDUF599-R: 5'-CCTTTCAGATATGGATCA-3'。烟 草 26S rRNA 为 内 参 基 因 ,Nt26S-F:5'-GAAGAAGGTCCCAAGGGTTC-3', Nt26S-R:5'-TCTCCCTTTAACACCAACGG-3'。反应体系为:10 μL 2×SYBR I Master,上下游引物各0.5 μL,50 ng cDNA,ddH2O 补至20 μL。反应程序:94 ℃预变性30 s;94 ℃变性5 s,58 ℃退火10 s,72 ℃延伸10 s,40 个循环。根据循环阈值(Ct 值),用2-ΔΔCT方法[15]计算相对表达量。每个反应进行3 个技术重复和3 个生物学重复。
(1)肖像描写:①第一次出场:写他“身材很高大”,说明他尚有劳动能力;“青白脸色”说明他穷困潦倒。营养不良又不肯劳动的结果;脸上“时常夹些伤痕”,是他穷困而偶然偷窃被人打伤的标志,也是他走向没落的重要标志。“一部乱蓬蓬的花白胡子”既表明他年龄较大而又精神委顿颓唐。他那件长衫“又脏又破,似乎十多年没有补,也没有洗”说明他穷酸潦倒,懒得出奇的经济状况和性格特征。②第二次出场:“他脸上黑而且瘦,已经不成样子,穿着一件破夹袄”说明他衣食无着,穷途末路。“盘着两腿,下面垫着一个蒲包,用草绳在肩上挂住”“满手是泥”说明他被打折了腿,丧失生活能力。
1.2.5 NtDUF599基因沉默载体构建
根据中国烟草基因组数据库中NtDUF599 基因序列,利用Primer 5.0 软件设计特异性扩增NtDUF599 基因片段的引物,并在引物的5'端添加载体接头序列,以方便利用In-Fusion 连接酶构建RNAi 干扰载体。正向序列引物fNtDUF599-F:5'-AGAAGGTTGGTGACCTGCAGAATTCCATTAATC GTCAC-3',fNtDUF599-R:5'-GAGAAAAACTAGA CCTGCAGAGAACGACCTTTGCTTCC-3'(下 划 线为载体接头序列);反向序列引物rNtDUF599-F:5'-GATAGTTACAGAGCCCGGGAGAACGACCTTT GCTTCC-3',rNtDUF599-R:5'-AGAAGGTTGGTG AGCCCGGGAATTCCATTAATCGTCAC-3'(下划线为载体接头序列)。PCR 扩增体系如下所示:5×PrimerSTAR GXL Buffer 10 μL,dNTP Misture(2.5 mM)4 μ L,上 下 游 引 物(10 μ M)各4 μ L,PrimerSTAR GXL DNA Polymerase 2 μL,cDNA 模板(100 ng/μL)1 μL,补充ddH2O 至50 μL。PCR 反应程序:95 ℃预变性5 min;98 ℃10 s,55 ℃15 s,68 ℃30 s,35 个循环;72 ℃延伸10 min。PCR 产物经琼脂糖凝胶电泳分离后,切取目的条带进行DNA 片段回收待用。
首先利用限制性内切酶Pst I 将pBWA(V)HS-RNAi 空载体切开,回收、纯化线状载体片段。随后将载体片段、In-Fusion 酶以及正向NtDUF599基因片段按比例混匀,55 ℃反应15 min。反应体系如下:pBWA(V)HS-RNAi 空载体2 μL,基因片段6 μL,5×In-Fusion 酶2 μL。将连接产物转化DH5α大肠杆菌感受态细胞,37 ℃培养12~16 h,挑取单克隆并进行菌落PCR 鉴定。阳性单克隆送上海生工生物工程有限公司测序。利用Sma I 限制性内切酶酶切连接有正向NtDUF599 基因片段的pBWA(V)HS-RNAi 中间载体,将反向NtDUF599 基因片段连接到中间载体,连接方法参照上文所述,最终获得pBWA(V)HS-NtDUF599-RNAi 干扰载体。
1.2.6 烟草遗传转化
将pBWA(V)HS-NtDUF599-RNAi 载体利用电转法转化农杆菌EHA105 感受态细胞,在添加有卡那霉素(Kan)和利福平(Rif)的筛选培养基上进行抗性筛选,28 ℃黑暗生长2~3 d,挑取单克隆并通过菌落PCR 进行验证。烟草遗传转化采用叶盘法,受体植物为栽培烟草品种K326,遗传转化流程具体参照王珊珊等[16]的方法。
1.2.7 NtDUF599 基因沉默效率分析
参照1.2.3 所述方法,提取不同NtDUF599-RNAi 转基因株系的RNA 并合成第一链cDNA,利用实时定量PCR 仪检测不同NtDUF599-RNAi 转基因株系中NtDUF599 基因的表达水平,所使用的引物及反应步骤如1.2.4 所示。
1.2.8 低温诱导开花时间及叶片数目分析
2 结果与分析
2.1 NtDUF599 的低温诱导表达模式分析
为了筛选烟草低温早花相关基因,在前期研究中我们对苗期NC82(低温早花敏感材料)进行了低温处理,并对苗期和现蕾期样品开展了转录组分析,筛选到一批与烟草低温早花可能相关的候选基因。NtDUF599 即为其中一个受低温诱导表达且在现蕾期也保持较高表达水平的候选基因(图1A)。该基因完整ORF 长度为711 bp,预测的编码蛋白包含236 个氨基酸残基,编码区包含一个未知功能的结构域,目前未发现该基因功能研究的报道。为了进一步详细验证NtDUF599 在低温条件下的表达模式,利用实时定量PCR 验证了NtDUF599 在苗期低温条件下的表达情况。结果表明,NtDUF599 受低温诱导表达,随着处理时间延长,表达水平呈上升趋势,处理后12 h 达到最高水平。随后该基因表达水平逐渐降低,48 h 后趋于稳定,但仍为处理前表达水平的4.5 倍(图1B)。
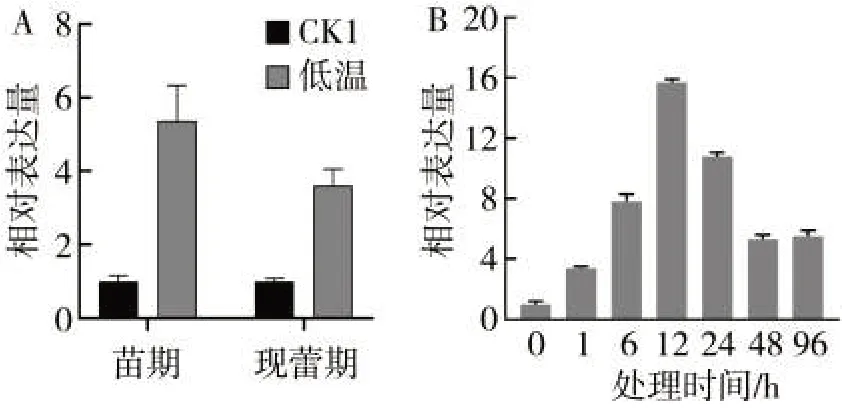
图1 NtDUF599 在低温条件下的表达模式Fig.1 Expression pattern of NtDUF599 under chilling treatment
2.2 烟草NtDUF599 基因RNAi 载体构建
以K326 的cDNA 为模板,利用NtDUF599 基因特异引物进行PCR 扩增。1.2%琼脂糖凝胶电泳检测结果显示,扩增产物在靠近200 bp 位置(图2),与目的片段大小相符。将正向和反向靶序列利用In-Fusion 连接酶依次连接到pBWA(V)HS-RNAi 干扰载体,重组质粒送交上海生工进行测序。结果表明,所测得序列与NtDUF599 基因序列100%一致,说明靶序列已成功插入到pBWA(V)HS-RNAi载体中,即RNAi 干扰载体构建成功。
图2 NtDUF599 基因片段电泳结果Fig.2 Electrophoretogram of NtDUF599 gene fragment
2.3 NtDUF599 沉默效果分析
利用烟草遗传转化,共获得 10 个NtDUF599-RNAi 转基因株系,这些株系在正常条件下的生长发育表型与K326 相似,如株高、叶片数、花期等。实时定量PCR 结果(图3)表明,不同NtDUF599-RNAi 转基因株系中NtDUF599 的表达水平均降低,说明已成功获得NtDUF599-RNAi 转基因烟草。各株系下降幅度存在差异,其中,RNAi-4 和RNAi-9 这两个株系NtDUF599 的表达量下降80%左右,说明基因沉默效果良好。因此,在后续实验中我们选取以上两个株系开展低温早花表型鉴定。

图3 NtDUF599 在RNAi 转基因株系中的相对表达量Fig.3 Relative expression level of NtDUF599 in NtDUF599-RNAi transgenic lines
2.4 NtDUF599 沉默对烟草低温早花表型的影响
K326 及NtDUF599-RNAi 转基因株系(RNAi-4和RNAi-9)苗期遭受低温处理(12 ℃,10 d),随后恢复正常生长至现蕾期。结果发现,正常条件下生长的K326 与NtDUF599-RNAi 转基因株系开花时间和现蕾期叶片数目均没有显著差异。然而,苗期遭受低温的NtDUF599-RNAi 转基因烟株与K326 花期均提前,但NtDUF599-RNAi 转基因烟株比K326 提前10 d 左右(图4A)。低温诱导烟株提前开花的同时还会导致叶片数目减少,叶片数目也是衡量低温早花敏感性的一项重要指标。结果显示,现蕾时NtDUF599-RNAi 转基因烟株的叶片数目显著小于K326(图4B),进一步说明NtDUF599-RNAi转基因烟株遭受低温后更易早花。
3 讨论
在前期RNA-Seq 分析的基础上,本研究中利用RNAi 干扰技术鉴定了一个烟草低温早花相关基因NtDUF599,首次揭示植物DUF 基因家族成员参与了烟草低温开花过程。

图4 NtDUF599-RNAi 烟株的低温早花表型分析Fig.4 Phenotypic analysis of chilling-induced early flowering in NtDUF599-RNAi transgenic plants
DUFs(Domain of unknown functions)是一类数目庞大的基因家族,广泛存在于动物、植物和微生物中[17]。已有研究表明,植物DUFs基因家族参与了诸多生物学过程,如生长发育[18-20]、病虫害防御反应等[21-23],以上研究大多数在拟南芥、水稻、玉米等植物中完成,在烟草中DUFs 的研究较少。近年来,DUFs 参与调控植物对非生物胁迫响应的研究报道渐多[24-25],显示出其在植物抗逆性过程中的重要功能。水稻DUF1645 家族基因OsSGL 受低温、干旱、高温等多逆境诱导表达,其过量表达转基因水稻的耐旱性显著增强[26]。 沙冬青(Ammopiptanthus mongolicus) DUF1517 家族基因AmDUF1517 是一个与冷胁迫相关的基因,其在拟南芥atduf1517 缺失突变体中超量表达,能够恢复拟南芥突变体的抗低温能力[27]。烟草Nt92 基因属于DUF868 基因家族,表达数据显示其可能与逆境胁迫应答以及细胞内物质的转运相关[28]。NtDUF599 不仅受低温诱导表达(图1),而且还参与了对烟草低温早花的调控(图4)。与K326 相比,苗期低温会导致NtDUF599-RNAi 转基因烟草的花期提前,说明该基因在调控低温早花过程中发挥正向功能。在模式植物拟南芥中,至少存在4条与花期相关的调控途径:春化作用、光周期、赤霉素和自主开花途径[29-32]。 Li 等[33]研究发现DUF 家族成员DUF1313 参与了植物光周期调控,可能与植物的花期控制有关,目前仍缺乏直接的实验证据。鉴于NtDUF599 受低温诱导表达且与低温诱导早花有关,而春化途径也与低温和开花途径联系紧密,推测NtDUF599 参与低温诱导早花过程可能与春化途径有关。下一步,将利用实时定量PCR 或RNA-seq 方法检测NtDUF599-RNAi 转基因烟草中春化信号途径各基因的表达水平,创制NtDUF599 过量表达转基因烟草,从正、反向遗传学角度探究NtDUF599 参与低温诱导早花过程的分子机制。
4 结论
(1)NtDUF599 基因受低温诱导表达;(2)苗期遭受低温后,NtDUF599 基因沉默烟株花期提前,说明该基因在低温诱导早花过程中发挥正向功能;(3)首次发现植物DUFs 参与了低温诱导早花过程。

