不同裂解温度稻壳生物炭对阿特拉津的吸附行为及机制
黄玉芬,魏 岚,李 翔,黄连喜,许桂芝,黄 庆,刘忠珍
广东省农业科学院农业资源与环境研究所,农业部南方植物营养与肥料重点实验室,广东省农业资源循环利用与耕地保育重点实验室,广东 广州 510640
阿特拉津(AT)是世界范围内长期大面积使用的一种均三氮苯类除草剂农药. 由于AT具有较强的滞留性和蓄积性,尽管近年来不断有替代品出现,但其仍是我国土壤和水生环境中重要的有机污染物之一[1]. AT进入环境后将经历一系列过程,如被土壤或沉积物等吸附、降解、挥发、扩散、作物吸收、发生地表径流和淋溶等,其中,吸附是控制AT在环境中迁移转化、归趋和生物有效性的关键因素,直接影响AT污染的防治和修复效率[2].
稻壳是稻谷生产过程中一种重要的副产品,我国是世界上最大的稻谷生产国之一,每年生产量约占世界总产量的29%[3-4]. 因此,若随意堆放或丢弃稻壳,不仅会造成资源的浪费,还会对环境造成一定的危害. 目前,对稻壳的资源化利用主要以原稻壳(粉)、稻壳生物炭和稻壳灰这3种类型的颗粒为主. 其中,稻壳生物炭因具有制备方法简单、成本低廉以及比表面积大、孔隙度好、吸附能力强等特殊的结构特点,被作为一种新型的吸附剂,广泛应用于水体、土壤中重金属和有机污染物的污染控制及修复[5-6]. 如王淑娟等[6]研究了氨基修饰稻壳生物炭对水溶液中铀的吸附动力学特性;史月月等[7]研究了改性稻壳生物炭对甲基橙的吸附;DONG等[8]研究了稻壳基生物炭对海洋沉积物中邻苯二甲酸酯(PAEs)的吸附和降解过程. 当前对稻壳生物炭吸附重金属和有机污染物的研究主要集中于稻壳生物炭的添加量、吸附时间、初始污染物浓度等,然而,由于生物炭的裂解温度不同,导致其结构和功能存在较大差异,从而影响其对重金属和有机污染物的吸附性能和吸附机制[9-10]. 因此,研究不同裂解温度下稻壳生物炭的结构特性及其对污染物的吸附性能差异,将有助于深入剖析稻壳生物炭对污染物的吸附作用机制,以及全面、准确地评价其作为工程吸附剂的应用价值.
已有研究[3]证明,生物炭最适合的裂解温度范围为300~700 ℃,若裂解温度太低(<300 ℃),生物炭的结构变化不明显,而裂解温度太高(>700 ℃)则微孔结构容易发生溶融. 鉴于此,该研究以低温(300 ℃)、中温(500 ℃)、高温(700 ℃)这3种裂解温度的稻壳生物炭作为研究对象,分析其在组成与结构上的差异;然后,以AT作为目标污染物,研究各稻壳生物炭对AT的吸附特性,并探究其潜在的吸附机制及构-效关系,筛选出对AT具有优质吸附效果的稻壳生物炭裂解温度,以期为充分利用废弃稻壳资源制备廉价高效的生物炭吸附材料提供数据支持,同时为稻壳生物炭在AT污染水体和土壤控制与修复中的利用提供理论依据.
1 材料与方法
1.1 试剂和仪器
AT标准品,纯度≥99.5%,购自国家标准物质标准样品信息中心,其基本理化性质如表1所示;乙腈和甲醇(色谱纯);氯化钾(优级纯);叠氮化钠(分析纯);Milli-Q超纯水. 主要仪器包括气氛箱式炉(KBF13Q,南京大学仪器厂),恒温摇床(TS-200B,上海天呈实验仪器制造有限公司),元素分析仪(vario EL Ⅲ,Elementar,德国),比表面积及孔径分析仪(BK100A,北京精微高博科学技术有限公司),傅里叶变换红外光谱仪(Vertex70,Bruker,德国),钨灯丝扫描电子显微镜(S-3400N,Hitachi,日本),高效液相色谱仪(2695型,Waters,美国)等.
1.2 生物炭制备
稻壳取自广东金稻米业有限公司,稻壳经去离子水洗涤,洗去灰尘和泥土,然后60 ℃下烘干至恒质量. 稻壳生物炭采用笔者所在课题组研发的专利设备(授权发明专利号:ZL201410120785.6)进行限氧控温炭化法裂解制备. 具体步骤:称取25 g已烘干稻壳于坩埚中,加盖密封后放入气氛箱式炉中,通过抽真空和通入保护气体氮气使气氛炉内腔形成绝氧状态;启动升温程序,以8 ℃/min快速升至250 ℃,停留30 min,然后以3 ℃/min缓慢升至300~700 ℃中某个设定温度(该试验分别设定为300、500、700 ℃),继续隔氧闷烧高温裂解1~3 h,产生的废气由抽风系统抽走防止污染环境,热解过程产生的蒸汽部分冷凝得到生物焦油回收利用;热解结束后,在保护气体和冷凝循环水保护下继续冷却至室温,依次经过研磨过筛(0.15 mm)备用,并分别标记为RH300、RH500、RH700(RH代表水稻壳,数字代表炭化温度).
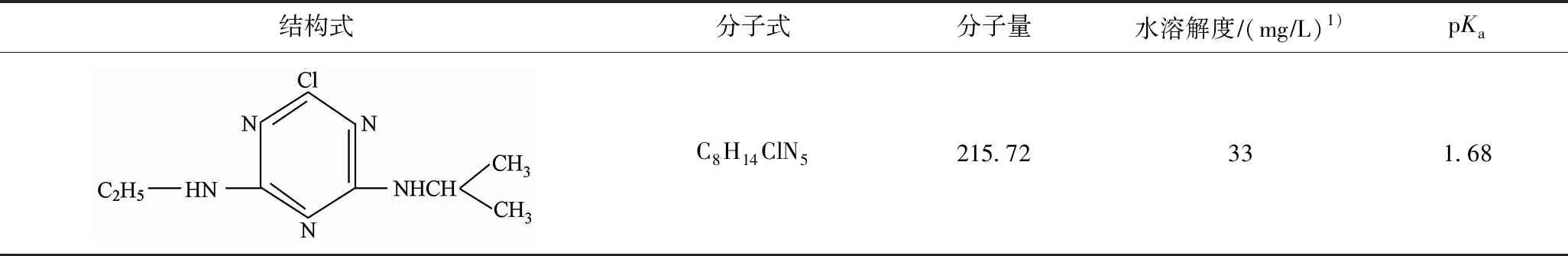
表1 阿特拉津的基本理化性质
1.3 生物炭性质和结构分析
称量炭化前后稻壳的干质量,前后质量比即为3种制备温度稻壳生物炭的产率. 生物炭的pH按固液比为1∶10加入去离子水,振荡混匀后,静置,用pH计测定. 采用钨灯丝扫描电子显微镜观察生物炭的表面形貌;采用元素分析仪测定生物炭中w(C)、w(H)、w(N),通过差减法计算w(O);采用比表面积及孔径分析仪测定生物炭的比表面积、孔体积和平均孔径;采用傅里叶变换红外光谱仪测定吸附试验前后生物炭的红外光谱特征.
1.4 吸附试验
通过预试验确定适合AT吸附的最佳炭水比、起始浓度梯度、吸附平衡时间和温度,然后采用批量恒温振荡吸附法进行吸附试验. 具体方法:称取0.05~0.20 g生物炭置于棕色具塞离心管中,加入系列浓度(0.5、1.0、2.0、4.0、8.0、10.0、16.0、20.0、32.0 mg/L)的AT各10 mL,以0.02 mol/L的KCl溶液为背景电解质(0.02%的NaN3为抑菌剂),避光振荡〔250 r/min,(25±1)℃〕24 h后,于 4 000 r/min下离心分离20 min后吸取上清液,经0.45 μm滤膜过滤后,进行高效液相色谱仪(HPLC)测定,通过吸附前后的浓度变化计算吸附量. 以不加生物炭的AT浓度系列作为空白对照,每个处理设3个重复.
稻壳生物炭对AT吸附量的计算方法:
Qe=V×(C0-Ce)/m
(1)
式中:Qe为达到表观吸附平衡后稻壳生物炭对AT的吸附量,mg/kg;C0为溶液中AT的初始浓度,mg/L;Ce为达到表观吸附平衡后溶液中AT的平衡浓度,mg/L;V为吸附试验中平衡溶液的体积,mL;m为吸附试验称取的生物炭质量,g.
1.5 AT测定条件
AT的高效液相色谱测定条件:Waters2489紫外可见光可变波长检测器和色谱工作站;色谱柱为Waters SunFireTMC18,5 μm,4.6 mm×250 mm;保护预柱为SunFireTMC18,5 μm,3.0 mm×20 mm;流动相,乙腈与水的体积比为60∶40,流速为1 mL/min;柱温30 ℃;检测波长221 nm;进样量10 μL. 前期预试验表明该检测方法的加标回收率为93%~103%,相对标准偏差为1.5%~3.5%.
1.6 吸附等温线方程
采用Frundlich和Langmuir等温吸附模型对吸附曲线进行拟合:
Frundlich等温吸附模型:
Qe=Kf×CeN
(2)
Langmuir等温吸附模型:
(3)
式中:Kf为Freundlich等温吸附模型常数,表示吸附作用强度,(mg/kg)/(mg/L)n;N为Freundlich等温吸附模型指数,表征吸附等温线的非线性程度;Q0为AT浓度升高后趋于饱和时的吸附量,mg/kg;A为吸附量达到Q0/2时溶液的平衡浓度,mg/L.
1.7 吸附贡献量分析
采用等温曲线分解法定量描述分配作用和表面吸附作用的贡献量[11]:
QT=Qp+Qa
(4)
式中:QT为总吸附量,mg/kg;Qp和Qa分别为分配作用和表面吸附作用贡献的吸附量,mg/kg. 高浓度范围内,等温吸附曲线可用式(5)[11]表示:
QT=Qp+Qa-max=Kd×Ce+Qa-max
(5)
式中:Kd为分配作用系数,即为对高浓度范围内等温线进行线性拟合所得到的斜率,L/kg;Qa-max为表面吸附的饱和吸附量,mg/kg. 因此,分配作用和表面吸附作用对总吸附的贡献可由式(6)(7)表示:
分配作用贡献量:
Qp=Kd×Ce
(6)
表面吸附贡献量:
Qa=QT-Qp=QT-Kd×Ce
(7)
同时,为探明吸附机制与生物炭结构之间的构-效关系,计算了单位面积生物炭对AT的饱和表面吸附摩尔数(Qa-max,SSA),即:
(8)
式中:Qa-max为AT在稻壳生物炭上的饱和表面吸附量,mg/kg;SSA为稻壳生物炭的比表面积,m2/g,M为AT分子的摩尔质量,g/mol.
1.8 数据分析
试验所得数据均使用Microsoft Excel 2010、DPS及Origin 8.0软件进行数据处理和作图.
2 结果与讨论
2.1 稻壳生物炭的理化性质与结构特征
不同裂解温度下稻壳生物炭的基本理化性质及元素组成如表2所示. 由表2可见,随着裂解温度的升高,3种稻壳生物炭的产率均逐渐减小,当裂解温度从300 ℃升至700 ℃时,产率从57.1%降至27.7%. 其中,在300~500 ℃区间内,生物炭质量损失较大,产率降幅达45.5%;500~700 ℃时产率下降变缓,降幅只有10.9%. 生物炭产率变化先快后慢,可能是因为稻壳主要由纤维素、半纤维素、木质素等有机组分构成,纤维素和半纤维素在300~500 ℃区间内大量分解,生物炭质量急剧减小,产率变化较大,随着裂解温度的升高,纤维素等成分热解趋于完全,产率变化逐渐趋于平缓[12-13]. pH随制备温度的升高而升高,由300 ℃时的6.03升至700 ℃时的10.36,这可能是因为稻壳生物炭的灰分中原本与有机物结合或络合的矿质元素(如K、Na、Ca、Mg等)在裂解过程中逐渐向氧化态和碳酸盐形态转变,裂解温度越高,这种转变越彻底,而这些氧化态矿物质和碳酸盐溶于水后呈碱性[13].
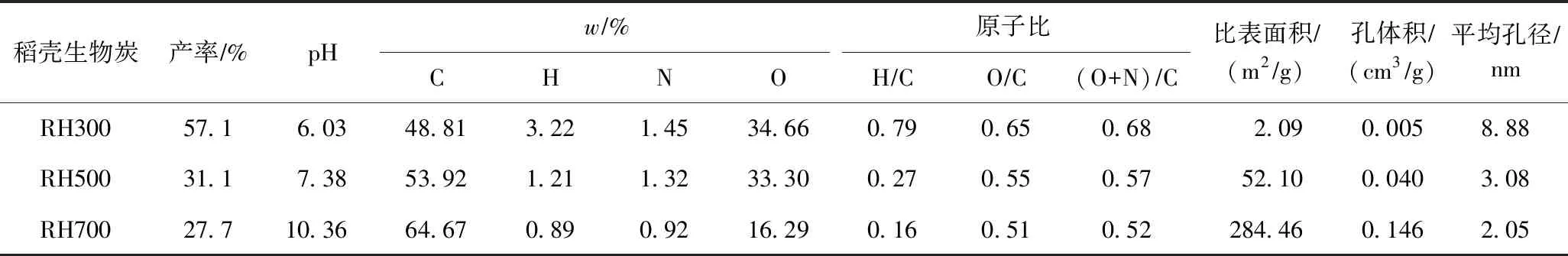
表2 稻壳生物炭的基本理化性质及元素组成
稻壳生物炭的元素组成变化也受到裂解温度的影响,由表2可见,随着裂解温度的升高,w(C)由48.81%增至64.67%,w(H)、w(N)和w(O)则下降,分别由3.22%、1.45%和34.66%降至0.89%、0.92%和16.29%. 原子比H/C、O/C和(O+N)/C分别表征生物炭的芳香性、亲水性和极性,其中,H/C值越小表示芳香性越高,生物炭结构越稳定;O/C和(O+N)/C值越大,表示亲水性和极性越大[14]. 由表2可见,随着裂解温度逐渐升高,H/C由0.79降至0.16,O/C、(O+N)/C则分别由0.65、0.68降至0.51、0.52. 可见,裂解温度是影响生物炭组成和结构特性的关键因素,生物炭的碳化程度和芳香结构随着裂解温度的升高而增加,而含氧官能团、亲水性和极性则随着裂解温度的升高而减小,这与其他一些生物质制备生物炭的研究结果[15-17]一致.
为进一步了解稻壳生物炭的结构和表面形态特征,该研究利用钨灯丝扫描电子显微镜和比表面积及孔径分析仪进行分析测定,结果如图1和表2所示. 由图1可见:RH300表面相对光滑,没有明显的纹理;RH500表面纹理明显,并出现鱼鳞片状,孔洞增多;RH700生物炭的鱼鳞片状逐渐消失,表面微孔数量明显增多,特别是细小孔径已打开. 结合表2可知,随着裂解温度升高,生物炭的比表面积和孔体积分别由300 ℃时的2.09 m2/g和0.005 cm3/g分别升至700 ℃时的284.46 m2/g和0.146 cm3/g,平均孔径则由8.88 nm降至2.05 nm. 这说明裂解温度的升高有利于生物炭孔隙结构的发育和微孔的形成,比表面积也显著增大,这与扫描电镜观察到的孔结构变化结果吻合(见图1). 刘杰等[18]研究也发现,随着裂解温度升高,稻壳生物炭多孔结构逐渐形成,比表面积和微孔体积也越大. 可见,稻壳生物炭的结构和性质受到裂解温度的调控,适当调节裂解温度可改良生物炭的表面特性,从而影响其对有机污染物的吸附特征和吸附机理[19].

图1 不同裂解温度下稻壳生物炭的SEM图像Fig.1 Scanning electron microscope images of rice husk biochar obtained under different pyrolysis temperatures
2.2 傅里叶转换红外光谱
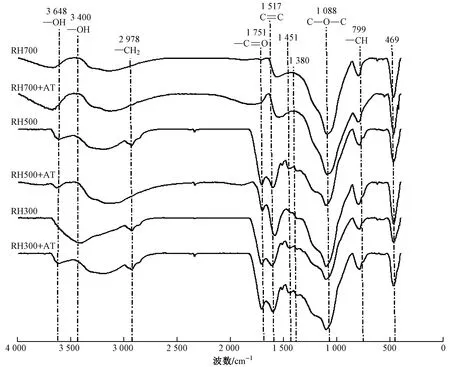
图2 水稻壳生物炭吸附阿特拉津(AT)前后的红外光谱图Fig.2 FTIR spectra of rice husk biochar before and after the absorption of atrazine

2.3 稻壳生物炭对AT的等温吸附特性
不同温度裂解的稻壳生物炭对AT的等温吸附曲线如图3所示. 由图3可见,随着AT平衡浓度(Ce)的增加,3种稻壳生物炭对AT的平衡吸附量(Qe)逐渐增加,其中以RH700的增加趋势最为明显,且其对AT的平衡吸附量最大,而RH300对AT的平衡吸附量最小. 这可能是因为高温裂解的稻壳生物炭的碳含量增加,芳香性和疏水性增强,孔隙细小密集(见图1、图2和表2),使得其吸附容量增大,对AT的吸附作用增强[25-26].
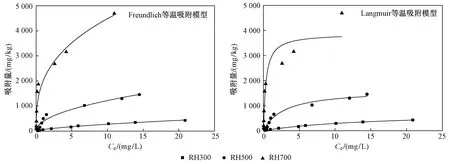
图3 稻壳生物炭对阿特拉津吸附的Frundlich和Langmuir等温吸附模型Fig.3 Frundlich and Langmuir sorption isotherms for the removal of atrazine by rice husk biochars
利用Freundlich和Langmuir等温吸附模型对稻壳生物炭的等温吸附过程进行拟合,结果见图3和表3. 由表3可见,Freundlich等温吸附模型(R≥0.972,P<0.01)和Langmuir等温吸附模型(R≥0.948,P<0.01)均能较好地拟合3种稻壳生物炭对AT的吸附作用,且Freundlich等温吸附模型的拟合效果更好. 图3也显示,Freundlich等温吸附模型曲线与试验数据的拟合度更高,能够更好地描述3种稻壳生物炭对AT的吸附行为. 由于Freundlich等温吸附模型是一种经验模型,适用于描述多分子层吸附[27],可见,稻壳生物炭对AT的吸附过程是多分子层吸附. 随着裂解温度的升高,稻壳生物炭的吸附能力显著增强,Kf值由RH300的61.23 (mg/kg)/(mg/L)n升至RH700的 2 009.77 (mg/kg)/(mg/L)n,升高了31.8倍(见表3).
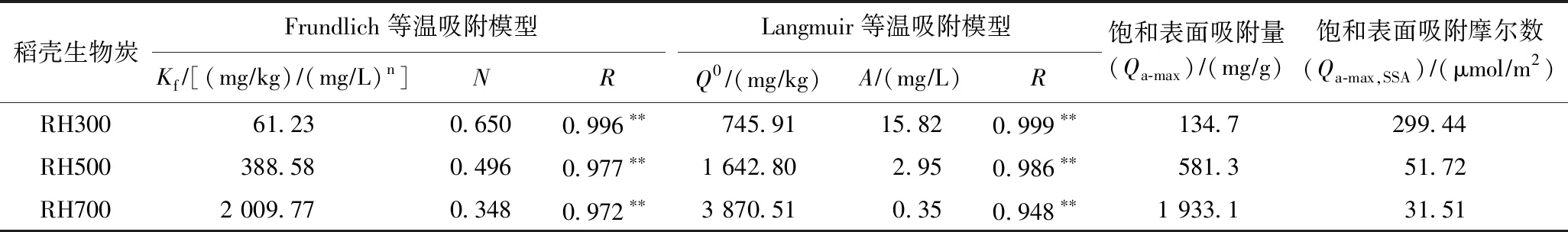
表3 稻壳生物炭对AT的等温吸附模型参数
Freundlich等温吸附模型参数N值的大小决定了吸附等温线的形状:当N<1时,吸附等温线呈L型;当N>1时,吸附等温线呈S型;当N=1时,Freundlich等温吸附模型可以简化为Linear线性模型[28]. 由表3可见,3种稻壳生物炭对AT的吸附等温线均呈L型(N<1),表明在低平衡浓度下,AT与稻壳生物炭间存在较高的亲和力,产生较多的吸附,吸附呈非线性;而随着平衡浓度的增大,由于稻壳生物炭中吸附位点逐渐被AT占据而减少,AT在其上的吸附作用也逐渐趋于恒定,吸附呈线性[29-30]. 由表3还可知,N值由RH300的0.650降至RH700的0.348,表明AT在3种稻壳生物炭上的吸附非线性程度随着裂解温度的升高逐渐增强[29].
已有研究[10,31]证明,生物炭对有机污染物的吸附能力及非线性程度受到生物炭的极性、芳香性、比表面积和微孔体积等物理化学性质的综合影响. 该研究将稻壳生物炭对AT的Freundlich等温吸附模型吸附参数(Kf和N)与生物炭的比表面积(SSA)、芳香性(H/C)、亲水性(O/C)和极性指数〔(O+N)/C〕进行相关性分析,结果(见表4)显示,Kf(R≥0.925)、N(R≥0.906)均与H/C、O/C、(O+N)/C呈良好的指数关系,Kf随H/C、O/C和(O+N)/C的增加而减小,但随SSA的增加而增大;N则随H/C、O/C和(O+N)/C的增加而增大,随SSA的增加而减小,表明生物炭中有机组分对其吸附AT起到重要影响,生物炭的芳香性越高,比表面积越大,亲水性和极性越小,稻壳生物炭对AT的吸附能力越强,吸附非线性程度越高. 可见,通过指数回归方程可以预测不同裂解温度下生物炭的吸附性能,反之,也可以通过吸附参数推测生物炭的结构特征,进而估计其制备过程的裂解温度[29,32].
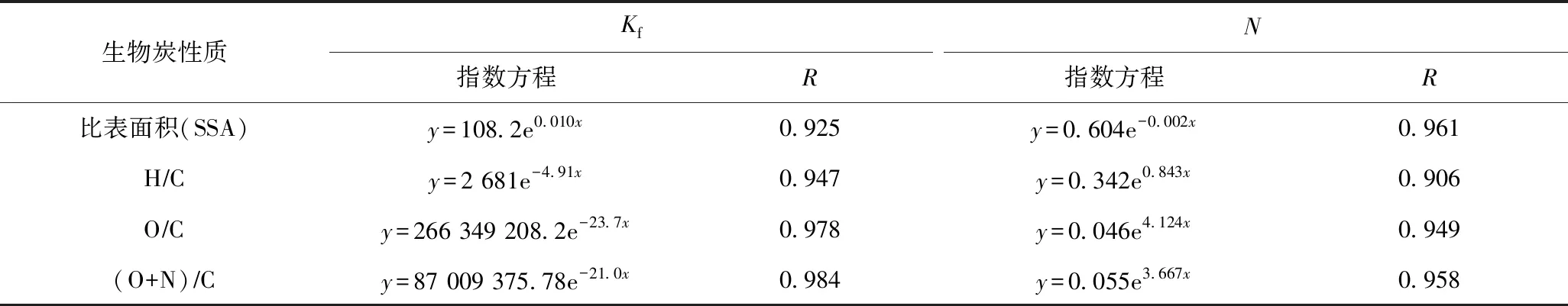
表4 Freundlich等温吸附模型参数(Kf和N)与稻壳生物炭性质的指数关系
2.4 稻壳生物炭对AT的吸附机制及构-效关系
已有研究[33]表明,生物炭对有机污染物的吸附主要包括分配作用和表面吸附作用,其中分配作用表现为等温吸附曲线呈线性、弱的溶质吸附和非竞争吸附;表面吸附则表现为非线性、强的溶质吸附和竞争吸附. 为探讨稻壳生物炭对AT的吸附机制,采用式(6)(7)定量描述分配作用和表面吸附作用对总吸附量的贡献(见表5),并根据表5的计算公式得出总吸附量(QT)、分配作用贡献量(Qp)和表面吸附作用贡献量(Qa)随Ce的变化曲线(见图4). 由表5和图4可见,3种稻壳生物炭对AT的吸附包括表面吸附和分配作用两个过程,在Ce较低时,RH300和RH500对AT的表面吸附作用大于分配作用,但随着Ce的升高,逐渐变化为以分配作用为主;而RH700对AT的吸附则一直以表面吸附作用为主,但Ce较高时,分配作用的贡献逐步提高. 这可能是由于Ce较低时,有机物被吸附于生物炭的表面吸附位点,随着Ce的升高,表面吸附达到饱和,表面吸附位点被完全占据后,分配作用在随后的吸附过程中占主导作用[34-35]. 由图4还可知,裂解温度是影响稻壳生物炭对AT吸附的重要因素,低温裂解的生物炭主要以分配作用为主,但随着裂解温度的升高,逐渐发展为以表面吸附作用为主. CHEN等[29,36]的研究也证明,提高生物炭的裂解温度,会使生物炭中比较灵活的脂肪相向比较紧凑的芳香相过渡,使吸附过程由线性的分配作用向非线性的表面吸附转变.
为进一步探讨稻壳生物炭对AT的吸附作用与生物炭结构特征之间的构-效关系,该研究对3种稻壳生物炭高浓度的分配系数(Kd)与生物炭的极性指数〔(O+N)/C〕进行相关性分析. 由表5可见,稻壳生物炭的Kd随着裂解温度的升高而逐渐增大,并于RH700达到最大值(188.29 mL/g),分别为RH300(14.42 mL/g)和RH500(60.49 mL/g)的13.1和3.1倍. 相关性分析结果表明,各稻壳生物炭的Kd与(O+N)/C均呈良好的线性负相关关系(R≥0.998,P<0.01),说明稻壳生物炭的分配作用与其极性指数间的关系取决于生物炭的炭化程度,不同的炭化程度决定了其与AT的匹配性和有效性. 低温裂解的稻壳生物炭未完全炭化,含有大量的无定型组分(如聚酯类物质),极性较高,不利于AT的吸附;随着裂解温度的升高,无定形的物质转换为极性低的芳香碳,促进了生物炭的分配相和AT的匹配性,进而增加AT在生物炭上的吸附容量[32]. 同时,该研究计算了高浓度线性吸附时的饱和表面吸附量(Qa-max),并利用式(8)计算单位面积生物炭对AT的饱和表面吸附摩尔数(Qa-max,SSA)(见表3). 由表3可见,Qa-max随稻壳生物炭SSA的增大而逐渐增加,表明AT在稻壳生物炭上的表面吸附主要由表面覆盖机制控制. 3种稻壳生物炭对AT的Qa-max,SSA分别为299.44 μmol/m2(RH300)、51.72 μmol/m2(RH500)和31.51 μmol/m2(RH700),根据AT有机分子的范德华面积(0.975 nm×0.783 nm),计算得到AT单分子层排布时的理论最大表面吸附量(Qa-max,mn)为2.18 μmol/m,可见AT在RH300、RH500和RH700上的Qa-max,SSA均显著大于Qa-max,mn,分别是Qa-max,mn的137.4、23.7和14.5倍. 这可能是由于稻壳生物炭的极性组分与AT分子发生特殊作用(如氢键作用),进而除表面覆盖以外,还存在其他类型的表面吸附机制,如多层平铺、毛细管现象或孔填充作用等[37].

表5 分配作用和表面吸附作用对生物炭吸附AT的贡献
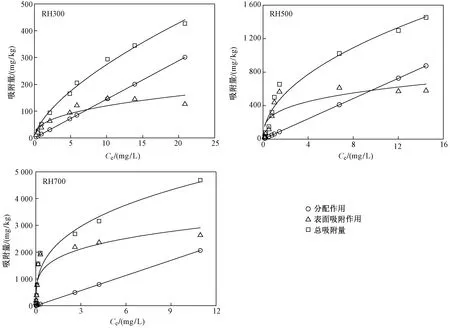
图4 不同平衡浓度下稻壳生物炭对AT吸附的分配作用、表面吸附作用与总吸附量的关系Fig.4 The relationship among the partition, surface adsorption and total adsorption of atrazine on rice husk biochars at different equilibrium concentrations
3 结论
a) 稻壳生物炭的裂解温度对其理化性质、元素组成和结构特征有重要影响,随着裂解温度升高,生物炭的产率降低,pH升高;元素组成中w(C)增大,w(H)、w(N)和w(O)降低,炭化程度增加. 与RH300比较,RH700的芳香性增强,比表面积增大,孔结构发育更加完全,但亲水性、极性和脂肪度减弱.
b) 3种稻壳生物炭对AT的吸附能力及吸附非线性程度大小顺序均表现为RH700>RH500>RH300,其Freundlich等温吸附模型常数Kf、N与稻壳生物炭的比表面积、芳香性、亲水性和极性间的指数回归分析可预测不同制备温度下稻壳生物炭对AT的吸附性能.
c) 低温裂解的稻壳生物炭对AT的吸附主要以分配作用为主,但随着裂解温度的升高,吸附机制由分配作用向表面吸附作用转变. 3种稻壳生物炭的炭化程度越大,极性越小,其对AT的分配作用越强;而对AT的表面吸附作用则除了表面覆盖以外,还存在多层平铺、毛细管现象和孔隙填充等,且低温裂解稻壳生物炭表现得更为显著.

