莜麦淀粉的提取工艺技术研究
游新勇,李琼
(安阳工学院生物与食品工程学院,河南安阳455000)
莜麦在我国的种植面积较大,内蒙古是我国主要种植莜麦的地区之一,有着非常悠久的种植历史,且莜麦营养丰富[1-2],具有很多保健功能[3-6],尤其是赖氨酸和色氨酸含量特别高[7],可以补充及改善我国的“赖氨酸缺乏症”[8]。目前有关莜麦淀粉的研究国内外报道较少,本试验选取莜麦粉提取淀粉,以促进莜麦资源的开发与利用,提高莜麦的附加值。
国内外关于淀粉提取方法的研究主要有碱提法[9-10]、酶提取法[11-12]、微波辅助法[13-14]、超声波辅助法[15-16]等,本试验在碱提取法的基础上采用酶提取法制备莜麦淀粉,结合了碱法和酶法的优点,目前应用此法提取莜麦中淀粉的研究尚未见报道。本文以莜麦为原料,采用响应面法对提取莜麦淀粉工艺进行优化,确定最佳工艺条件,并在此基础上研究莜麦淀粉的性质,为扩大莜麦淀粉在食品行业及其它行业的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
莜麦:市售;碱性蛋白酶(200 000 U/g,最适pH值:7~12,最适温度:35℃~55℃):无锡市博立生物制品有限公司;葡萄糖、酒石酸钾钠、亚铁氰化钾(分析纯):天津市化学试剂三厂;无水乙醚、无水乙醇、氢氧化钠、盐酸、硫酸铜、次甲基蓝(分析纯):天津市风船化学试剂科技有限公司。
DFT-200提式高速万能粉碎机:温岭市林大机械有限公司;JA5003电子分析天平:上海越平科学仪器有限公司;DHG-9023A电热鼓风干燥箱:上海一恒科学仪器有限公司;L-550台式低速大容量离心机:长沙湘仪离心机仪器有限公司;DL-1电子万用炉:北京市永光明医疗仪器厂;SYC-15B超级恒温水浴箱:南京桑力电子设备厂;NDJ-1旋转粘度计:上海森地科学仪器设备有限公司;UV-7504TC紫外可见分光光度计:上海欣茂仪器有限公司。
1.2 试验方法
1.2.1 莜麦淀粉酶法及碱法提取工艺流程
莜麦→除杂→洗净自然晾干→粉碎→过筛(80目)→莜麦粉→乙醚脱脂(30℃,4 h)→脱脂莜麦粉→调浆→调节pH值、温度→加入碱性蛋白酶→搅拌酶解→过滤(80目)→离心分离(3 500 r/min,15 min)→沉淀(弃上清液)→水洗→离心分离(3 500 r/min,15 min)→沉淀(弃上清液)→干燥(40℃,24h)→粉碎→过筛(80目)→莜麦淀粉
1.2.2 总淀粉含量的测定
参照GB 5009.9-2016《食品安全国家标准食品中淀粉的测定》第一法。
1.3 单因素试验设计
1.3.1 酶添加量对莜麦淀粉总淀粉含量的影响
称取一定量的脱脂莜麦粉,按料液比1∶6.3(g/mL)调浆,在pH10、酶解温度55℃、酶解时间2 h条件下,考察酶添加量分别为1.0%、1.2%、1.4%、1.6%、1.8%时对莜麦淀粉中总淀粉含量的影响。
1.3.2 酶解温度对莜麦淀粉总淀粉含量的影响
称取一定量的脱脂莜麦粉,按料液比1∶6.3(g/mL)调浆,在pH10、酶添加量1.4%、酶解时间2 h条件下,考察酶解温度分别为 35、40、45、50、55 ℃时对莜麦淀粉中总淀粉含量的影响。
1.3.3 酶解时间对莜麦淀粉总淀粉含量的影响
称取一定量的脱脂莜麦粉,按料液比1∶6.3(g/mL)调浆,在pH10、酶添加量1.4%、酶解温度50℃条件下,考察酶解时间分别为1、2、3、4、5 h时对莜麦淀粉中总淀粉含量的影响。
1.3.4 pH值对莜麦淀粉总淀粉含量的影响
称取一定量的脱脂莜麦粉,按料液比1∶6.3(g/mL)调浆,在酶添加量1.4%、酶解温度50℃、酶解时间3 h条件下,考察 pH 值分别为 7、8、9、10、11、12 时对莜麦淀粉中总淀粉含量的影响。
1.4 响应面优化试验设计
在单因素试验的基础上,选取酶添加量(A)、pH值(B)、酶解温度(C)、酶解时间(D)为影响因素,莜麦总淀粉含量为响应值,进行响应面优化试验。试验因素和水平表见表1。
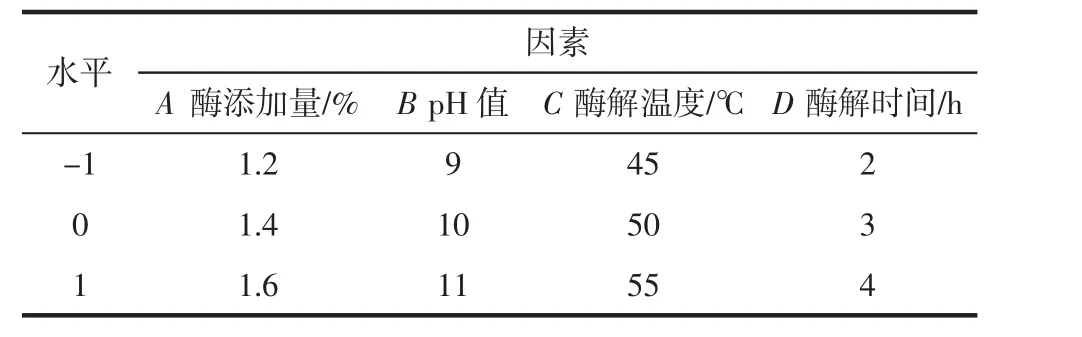
表1 因素和水平表Table 1 Factors and levels table
1.5 莜麦淀粉性质测定方法
1.5.1 溶解度与膨润力测定
50 mL质量分数2.0%的淀粉乳,于25℃下搅拌30 min后,以3 000 r/min的速度离心20 min,将上清液倾入烘干至恒重的铝盒中,将铝盒置于90℃的水浴上蒸干后移入干燥箱中,在105℃下烘干称重,得到被溶解的淀粉质量A,离心管中沉淀物的质量P,按下列公式计算溶解度和膨润力[17]。
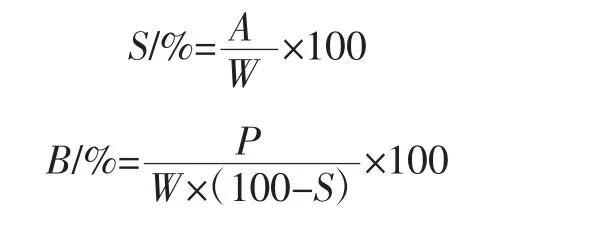
式中:A为被溶解的淀粉质量,g;W为样品干基质量,g;P为离心管中沉淀物质量,g。
1.5.2 黏度的测定
参照GB/T22427.7-2008《淀粉粘度测定》,称取6.0 g莜麦淀粉,配制成5%的淀粉乳液,在沸水中加热搅拌1 h,淀粉完全糊化后冷却至室温(25℃),用NDJ-1旋转粘度计测定黏度值,仪器设定参数为3号转子,转子转速30 r/min。
1.5.3 冻融稳定性的测定
称取定量的莜麦淀粉配制成质量分数为6%的淀粉乳,沸水浴中加热搅拌15 min,冷却至室温(25℃)。称取一定量的淀粉乳置于离心管中,在-20℃至-18℃的冰箱中冷冻24 h后取出,自然解冻。以3 000 r/min的速度离心15 min,弃去上清液,称取沉淀物的质量,计算冻融析水率[18]。

1.5.4 淀粉透明度的测定
称取1 g莜麦淀粉配制成1%淀粉乳,取50 mL置于100 mL烧杯中,在沸水浴中加热搅拌15 min,冷却至25℃,在620 nm波长处测透光率,即得到透明度[19]。
1.5.5 淀粉热稳定性的测定
称取6 g莜麦淀粉配制成5%淀粉乳,沸水浴中加热完全糊化1 h后,保温测定黏度,继续糊化1 h后再保温测定黏度,记录并比较,两次测定值之间的差值越小,热稳定性越高。
1.6 统计处理
采用Excel 2007软件进行单因素的数据分析,并用Designer-Expert 8.0软件进行响应面的数据分析。
2 结果与分析
2.1 单因素试验分析
2.1.1 酶添加量对莜麦淀粉总淀粉含量的影响
酶添加量对莜麦淀粉总淀粉含量的影响见图1。
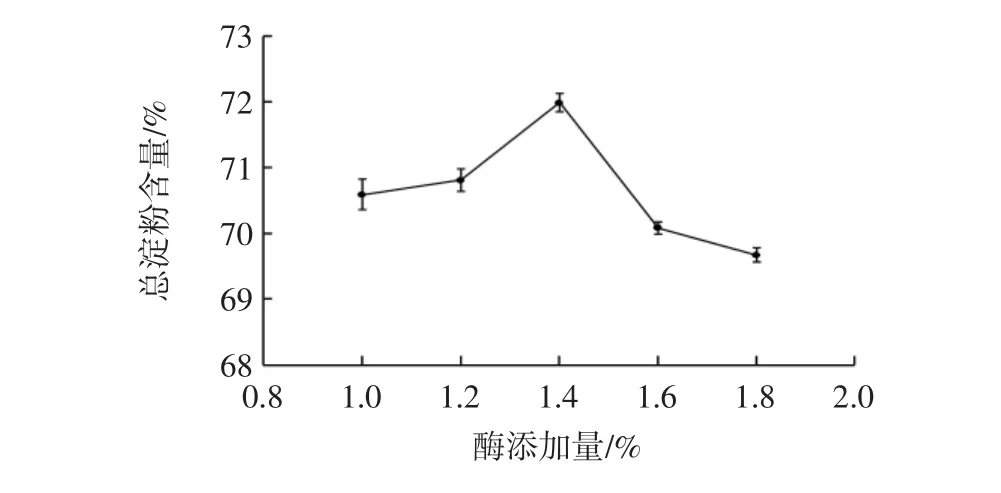
图1 酶添加量对莜麦淀粉总淀粉含量的影响Fig.1 Effect of enzyme addition amount on total starch content of oat starch
由图1可知,随着碱性蛋白酶的增加,莜麦淀粉中总淀粉的含量呈现先上升后下降的变化趋势,当酶添加量为1.4%时,总淀粉含量达最大值,随后下降。分析原因可能是随着碱性蛋白酶酶添加量的增加,对莜麦粉中的蛋白成分的分解能力相应地增加,增强了淀粉与蛋白质的分离,莜麦粉中总淀粉的含量增加;但继续增加酶的用量会导致蛋白质过度水解,暴露更多的疏水性基团,蛋白质发生疏水水合作用发生相互聚集,蛋白质溶解度下降,使得蛋白与淀粉分离困难[20],淀粉总含量下降。因此,酶添加量选取1.4%为宜。
2.1.2 pH值对莜麦淀粉总淀粉含量的影响
pH值对莜麦淀粉总淀粉含量的影响见图2。
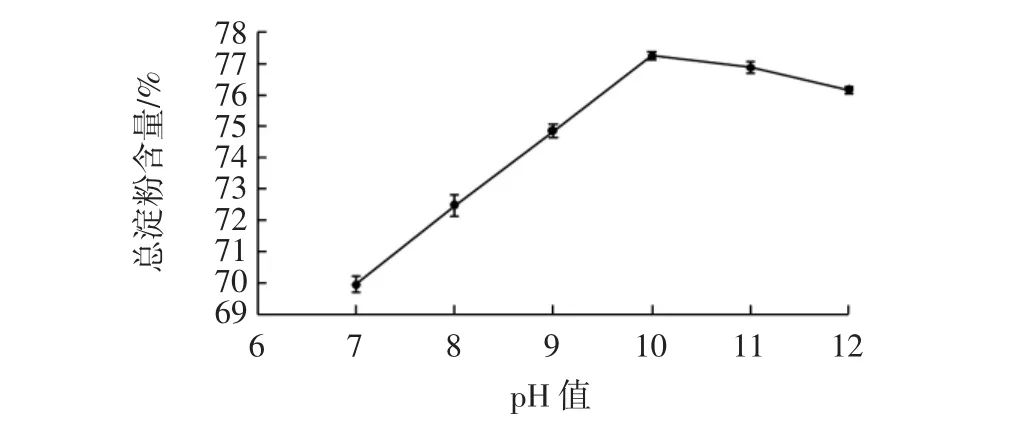
图2 pH值对莜麦淀粉总淀粉含量的影响Fig.2 Effect of pH on total starch content of oat starch
由图2可知,随着碱量的增加,pH值在7~10范围内,总淀粉含量增加明显,在pH10~12范围内呈下降趋势。分析原因可能是氢氧化钠溶液对蛋白质分子的次级键特别是氢键有破坏作用,并使部分极性基团发生解离,使得蛋白质分子表面带有相同电荷,从而对蛋白质分子有增溶作用,随着碱量的增加,增溶作用增加,促进了淀粉和蛋白质的分离[21-22],总淀粉含量持续增加,但加碱量过大时,导致溶液变稠,莜麦粉和水的糊状物过于黏滞,不利于淀粉颗粒的扩散,影响莜麦淀粉与蛋白的分离效果,使得总淀粉含量下降。因此,pH值选取10为宜。
2.1.3 酶解温度莜麦淀粉总淀粉含量的影响
酶解温度对莜麦淀粉总淀粉含量的影响见图3。
由图3可知,酶解温度在35℃~50℃范围内,总淀粉含量持续升高,当酶解温度高于50℃时,总淀粉含量缓慢下降。分析原因可能是随着温度的升高,淀粉的糊化作用加强,淀粉糊黏度增加,使得莜麦淀粉和蛋白的分离更加困难。因此,酶解温度选取50℃为宜。
2.1.4 酶解时间对莜麦淀粉总淀粉含量的影响
酶解时间对莜麦淀粉总淀粉含量的影响见图4。
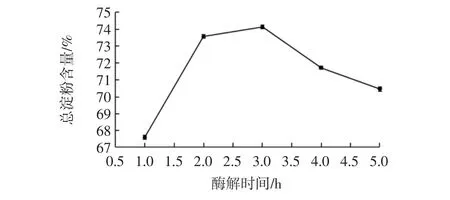
图4 酶解时间对莜麦淀粉总淀粉含量的影响Fig.4 Effect of enzymatic hydrolysis time on total starch content of oat starch
由图4可知,酶解时间在1 h~2 h范围内,总淀粉含量快速增加;当提取时间在2 h~3 h范围内,总淀粉含量增加缓慢;而当酶解时间大于3 h时,总淀粉含量呈下降趋势。分析原因可能是随着酶解时间的增加,淀粉中蛋白的含量在不断减少,莜麦淀粉的纯度越来越高,总淀粉含量增加,但是酶解时间超过3 h后,莜麦粉中可能存在的微生物在适宜的温度和湿度条件下进行繁殖,酶解了一部分淀粉等碳源[23],使总淀粉含量呈下降趋势。因此,酶解时间选取3 h为宜。
2.2 响应面法优化莜麦淀粉提取和纯化工艺条件
2.2.1 回归方程的建立及显著性分析
响应曲面法优化试验结果见表2。
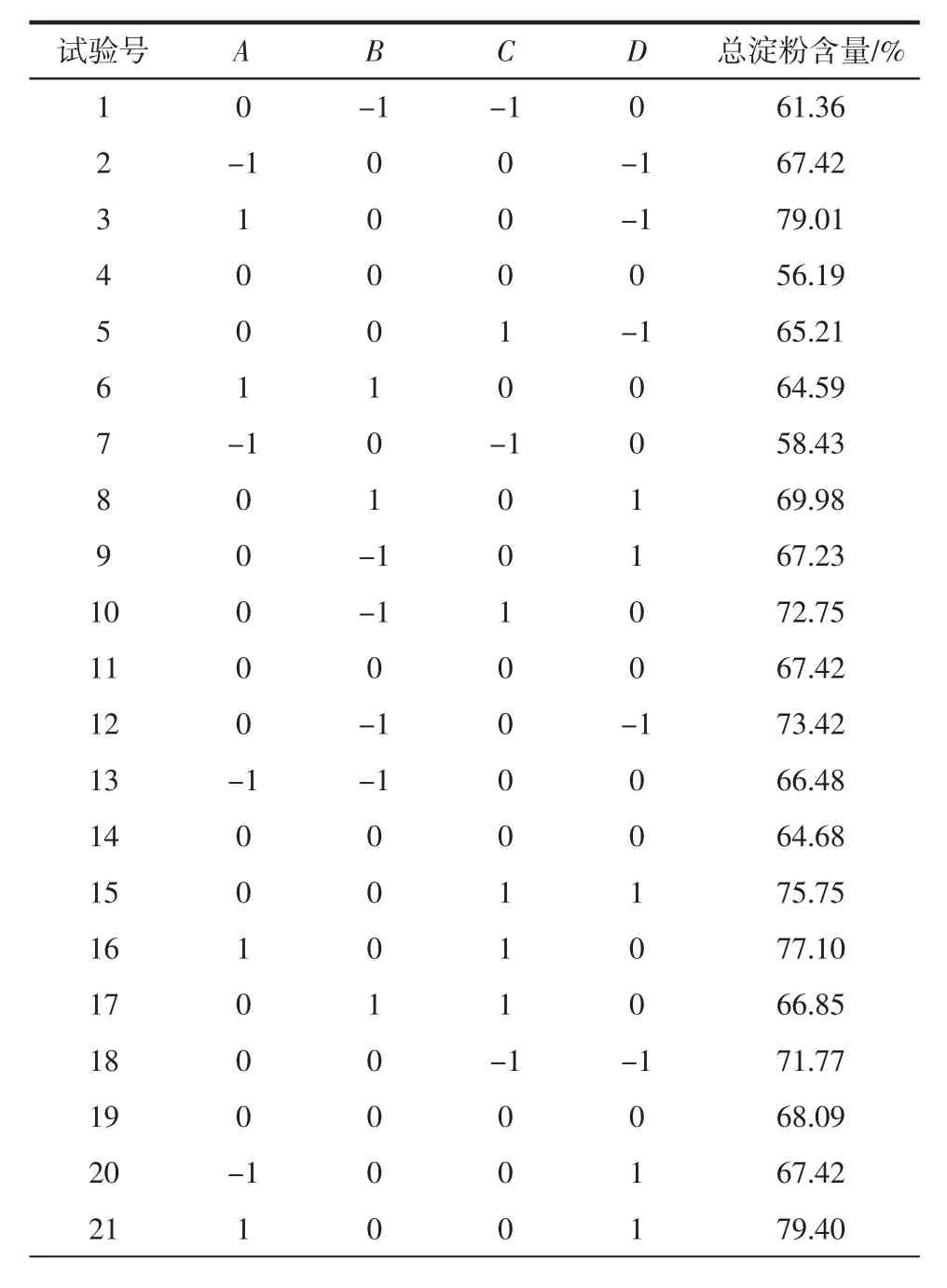
表2 Box-Behnken试验设计及结果Table 2 Design and results for Box-Behnken test
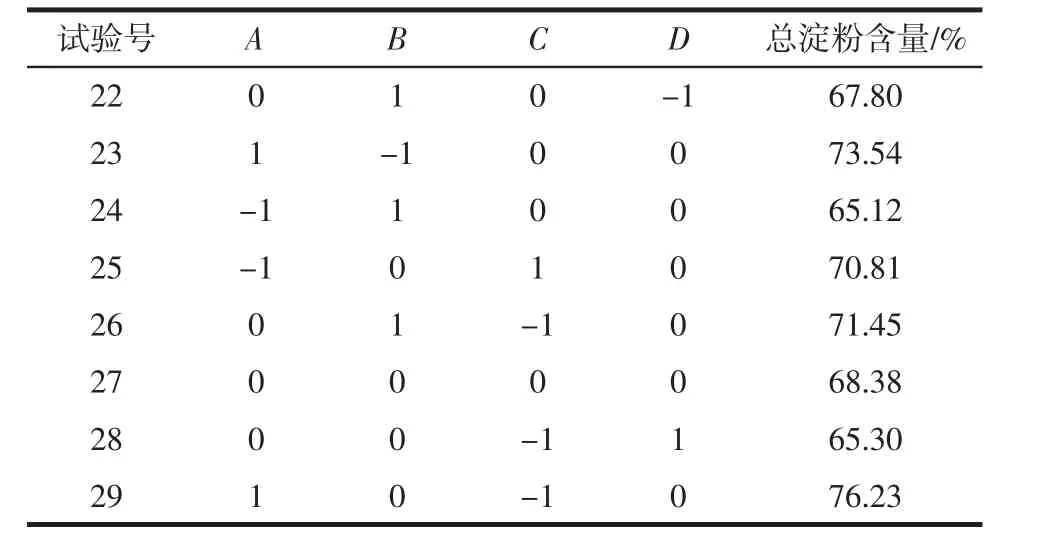
续表2 Box-Behnken试验设计及结果Continue table 2 Design and results for Box-Behnken test
通过Design-Expert 8.0软件对表2中的试验数据进行多元回归拟合,得到莜麦淀粉总淀粉含量对酶添加量(A)、pH 值(B)、酶解温度(C)、酶解时间(D)的回归方程为:
Y=64.95+4.52A-0.75B+1.99C+0.038D-1.90AB-2.88AC+0.098AD-4.00BC+2.09BD+4.25CD+3.45A2+0.33B2+1.88C2+3.97D2
回归方程中各项系数绝对值的大小直接反映了各因素对响应值的影响程度,系数的正负反映了影响的方向[24],根据回归方程的各项系数可知各因素对莜麦淀粉提取和纯化的主次关系为:A>C>B>D,即酶添加量>酶解温度>pH值>酶解时间。
对回归模型进行方差分析,结果见表3。
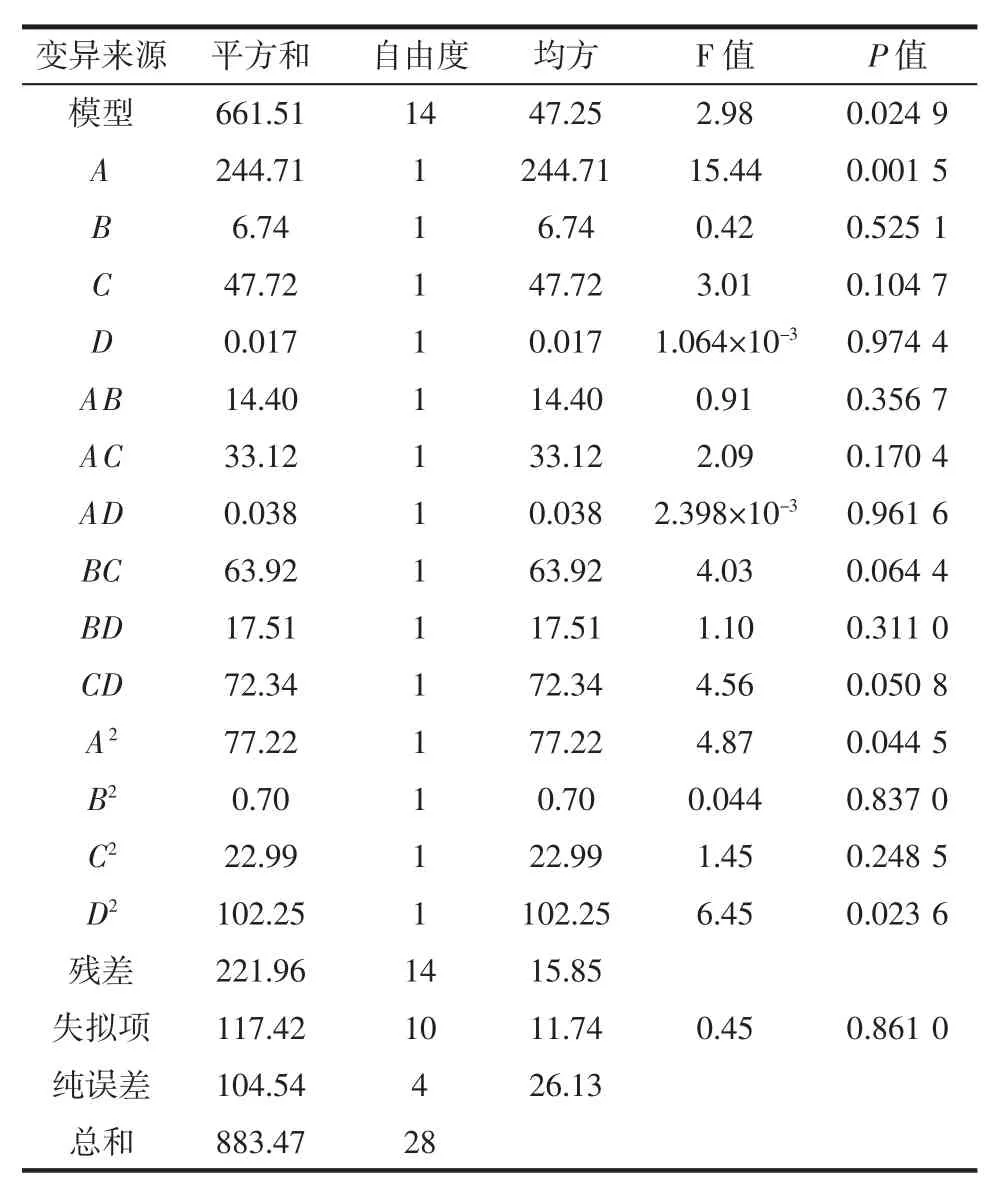
表3 回归模型的方差分析Table 3 Variance analysis of regression modle
由表3可知,该模型的P=0.024 9<0.05,说明试验所选用的二次多项模型具有显著性,决定系数R2=0.748 8,失拟项P=0.861 0>0.05不显著,说明本试验模型与试验值拟合程度良好,试验误差较小,可以作为分析和预测莜麦淀粉提取与纯化工艺中总淀粉含量的模型。模型中一次项A极显著(P<0.01),二次项A2和 D2显著(P<0.05),其余不显著(P>0.05)。
2.2.2 因素交互作用
酶添加量(A)与 pH 值(B)、酶添加量(A)与酶解温度(C)、酶添加量(A)与酶解时间(D)、pH 值(B)与酶解温度(C)、pH 值(B)与酶解时间(D)、酶解温度(C)与酶解时间(D)的交互作用对总淀粉含量的影响结果如图5~图10所示。
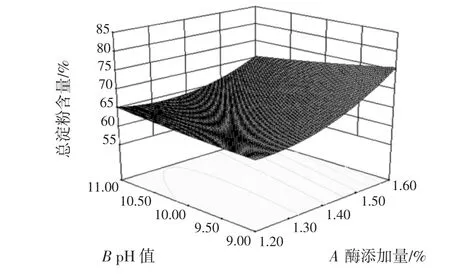
图5 酶添加量与pH值的交互作用对总淀粉含量的影响Fig.5 Effect of enzyme dosage and pH value on total starch content
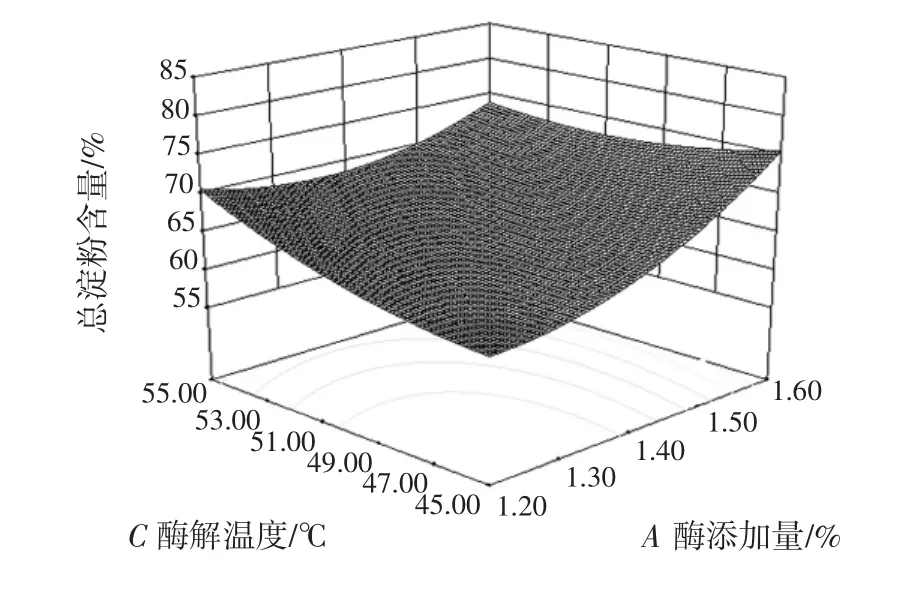
图6 酶添加量与酶解温度的交互作用对总淀粉含量的影响Fig.6 Effect of enzyme dosage and enzymolysis temperature on total starch content
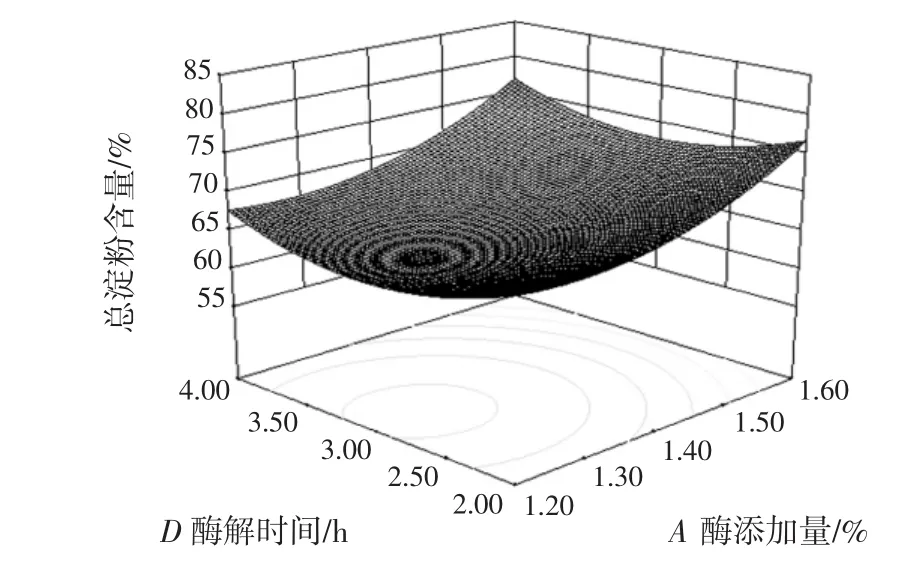
图7 酶添加量与酶解时间的交互作用对总淀粉含量的影响Fig.7 Effect of enzyme dosage and enzymolysis time on total starch content
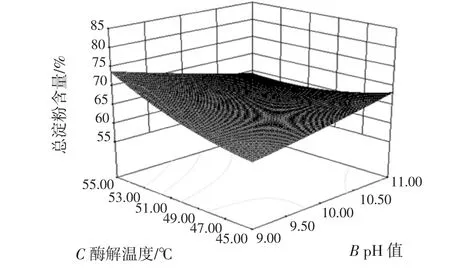
图8 pH值与酶解温度的交互作用对总淀粉含量的影响Fig.8 Effect of pH value and enzymolysis temperature on total starch content

图9 pH值与酶解时间的交互作用对总淀粉含量的影响Fig.9 Effect of pH value and enzymolysis time on total starch content
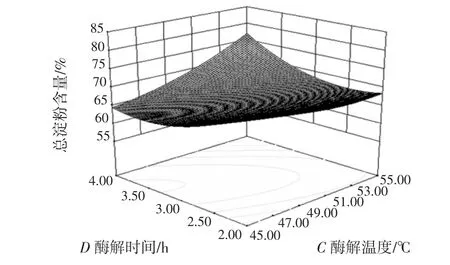
图10 酶解温度与酶解时间的交互作用对总淀粉含量的影响Fig.10 Effect of enzymolysis temperature and enzymolysis time on total starch content
等高线是椭圆形,则表示两因素交互作用较大,越趋近于圆形则表示交互作用越弱,同时沿因素轴向等高线变化越密集,该因素对响应值影响越大,反之越小[25]。比较图5~图10可知,4个因素对莜麦淀粉总淀粉含量影响大小顺序依次为:A>C>B>D,结果与表3一致。酶添加量对莜麦淀粉总淀粉含量的影响最大,酶解温度和酶解时间交互作用较其他因素间作用明显。
2.2.3 回归模型的验证
通过Design-Expert8.0软件分析得出,莜麦淀粉的最佳提取与纯化工艺参数为:酶添加量1.6%、pH 9、酶解温度55℃、酶解时间3.99 h,此条件下莜麦淀粉总淀粉含量为87.06%。考虑实际操作,将上述最佳参数中的酶解时间调整为4 h,其余不变,在此条件下重复3次试验,莜麦淀粉总淀粉含量分别为86.82%、86.58%、86.73%,平均值为86.71%,与理论预测值相比,其相对误差约为0.40%,该值在可接受的范围之内。因此,本试验设计所得的最佳工艺参数准确可靠,具有一定的实用价值。
2.3 莜麦淀粉性质分析
莜麦淀粉品质分析见表4。

表4 莜麦淀粉品质分析Table 4 Quality analysis of oat starch
由表4可知,在25℃条件下,莜麦淀粉的溶解度为10%,膨润力为14.32%,冻融析水率为38.12%,透明度为1.853%,与赵全等[19]研究的4种淀粉性质相比,莜麦淀粉溶解度较小,膨润力较低,透明度和冻融稳定性较差,易发生凝沉现象。因此,莜麦淀粉需要进行一定改性之后才能更好的应用于食品及化学工业。
3 结论
莜麦淀粉总淀粉含量的影响因素按影响主次顺序依次为:酶添加量>酶解温度>pH值>酶解时间。响应面法最终确定莜麦淀粉提取和纯化的最佳工艺条件为:酶添加量1.6%、酶解温度55℃、pH 9、酶解时间4 h,在此条件下莜麦淀粉总淀粉含量为86.71%。莜麦淀粉溶解度较小,膨润力较低,透明度和冻融稳定性较差,更好的应用于食品及化学领域仍需进一步研究。

