‘塔罗科’血橙成熟过程中花色苷积累及其与糖酸含量相关性
喻最新,王日葵,贺明阳,洪 敏,袁小淞,王 晶,冯 雨,吴志刚
(西南大学柑桔研究所,重庆 400712)
血橙(Citrus sinensisL.Osbeck)属于甜橙类,滋味浓郁、酸甜可口、肉质细嫩,散发独特的玫瑰香气[1]。常见的血橙品种主要是‘塔罗科’(Tarocco)、‘摩洛’(Moro)和‘桑吉耐洛’(Sanguinello),其中我国主要引进并广泛种植的血橙品种为‘塔罗科’[2]。血橙中因含有丰富的抗坏血酸、多酚、类黄酮以及羟基肉桂酸等活性化合物而具有极高的营养价值,广受消费者的喜爱[3]。血橙是唯一含花色苷的柑橘品种[3],花色苷是一类广泛存在于植物中的色素,属于黄酮类化合物[4]。花色苷赋予植物丰富多彩的颜色,从而有助于植物授粉、抵抗病虫害、抵御紫外线损伤[5],同时还对人体有多种生理保健功能,如预防肥胖症、糖尿病[6]、抗炎症、抗氧化[7]等。
花色苷赋予血橙果肉鲜艳的颜色,血橙果实中花色苷的含量是血橙商业价值的重要评价指标[8]。本实验研究了血橙成熟过程中(开花后200~324 d)果实花色苷质量浓度、花色苷合成相关基因的表达量的动态变化,并通过皮尔逊相关系数和多元逐步回归分析花色苷积累与糖酸含量之间的相关性,以期为探索血橙花色苷积累规律提供参考。
1 材料与方法
1.1 材料与试剂
‘塔罗科’血橙采自重庆市璧山区绿跃血橙种植园,选择长势一致的‘塔罗科’血橙树体,树龄为30 年。开花时间为2017年4月23日,采样日期为2017年11月9日至2018年3月13日。每隔15 d左右采一次样,每个处理3 个重复,每个重复15 个果实。选择大小正常、无机械损伤、无病虫害的果实,采后当天运回实验室,每个果实取一半用液氮速冻后混合均匀,保存于-80 ℃超低温冰箱备用,另一半榨汁测定色差以及花色苷质量浓度。
KCl(分析纯)、CH3COONa(分析纯) 重庆川东化工试剂厂;乙腈、甲醇(均为色谱统) 西格玛奥德里奇(上海)有限公司;葡萄糖、果糖、蔗糖、苹果酸、柠檬酸、柠檬酸(均为色谱纯) 上海源叶生物科技有限公司。
1.2 仪器与设备
1260 高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦公司;CFX96实时荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)仪 美国伯乐公司;TU-1901紫外分光光度计 北京普析通用仪器有限公司;H1850R台式高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 总花色苷质量浓度分析
参照Crifò等[9]的方法并略作修改。血橙榨汁后10 000 r/min离心10 min,取2 mL上清液用缓冲液A(0.05 mol/L KCl、0.15 mol/L HCl,pH 1.0)稀释至10 mL,另取2 mL上清液用缓冲液B(0.4 mol/L CH3COONa、0.24 mol/L HCl,pH 4.5)稀释至10 mL,于510 nm和700 nm波长处测定吸光度。按下式计算总花色苷质量浓度。
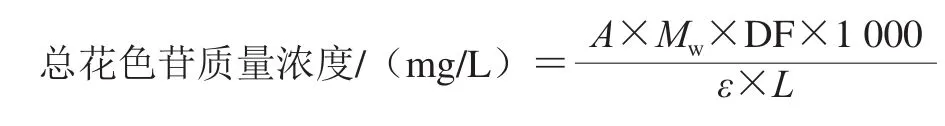
式中:A=(A510nm-A700nm)pH1.0-(A510nm-A700nm)pH4.5;ε为矢车菊素-3-葡萄糖苷在pH 1.0缓冲液中510 nm波长处的摩尔吸光系数(24 825 L/(mol·cm));Mw为矢车菊素-3-葡萄糖苷相对分子质量(484.82);DF为稀释倍数;L为光程/cm。
1.3.2 可溶性糖含量分析
参照Albertini等[10]的方法并略作修改。准确称取1 g血橙果肉于研钵中,加入5 mL超纯水研磨成匀浆后倒入15 mL离心管中,用1 mL超纯水润洗研钵后一并移入离心管中,在4 ℃下,15 000 r/min离心10 min,取上清液定容于10 mL容量瓶,过0.22 μm滤膜,滤液即为HPLC供试样品。
HPLC条件:APS-2 HYPERSIL色谱柱(260 mm×4.6 mm,5 μm);进样量为10 μL;流动相为乙腈和水(体积比70∶30);流速1.0 mL/min;柱温35 ℃;示差折光检测器。
1.3.3 有机酸含量分析
1.3.3.1 抗坏血酸含量分析
参照江海等[11]的方法并略作修改。准确称取1 g果肉于研钵中,加入5 mL超纯水研磨成匀浆后倒入15 mL离心管中,用1 mL超纯水刷洗研钵后一并移入离心管中,在4 ℃下,15 000 r/min离心10 min,取上清液定容于10 mL容量瓶,过0.22 μm滤膜备用。
HPLC条件:UMISILC18(2)色谱柱(260 mm×4.6 mm,5 μm);进样量为10 μL;流动相为甲醇和体积分数0.1%磷酸(体积比1∶99);流速0.8 mL/min;柱温25 ℃;检测波长为245 nm。
1.3.3.2 柠檬酸、苹果酸含量分析
参照李云康[12]的方法并略作修改。准确称取1 g血橙果肉于研钵中,加入5 mL 0.05 mol/L的KH2PO4溶液(pH 2.5)研磨成匀浆后倒入15 mL离心管中,在4 ℃下15 000 r/min离心10 min,取上清液用0.05 mol/L KH2PO4溶液定容于10 mL容量瓶,过0.22 μm滤膜备用。
HPLC条件:Venusil MP C18柱(260 mm×4.6 mm,5 μm);进样量为20 μL;流动相为甲醇和0.05 mol/L KH2PO4溶液(体积比97∶3),0.05 mol/L KH2PO4溶液用磷酸调pH值至2.5;流速1 mL/min;柱温40 ℃;检测波长为210 nm。
1.3.4 RNA提取、cDNA第一链的合成及qPCR
1.3.4.1 RNA提取和cDNA第一链的合成
严格按照植物多糖多酚总RNA提取试剂盒操作说明书进行血橙果肉RNA的提取。以提取的RNA为模板,利用FastKing RT Kit反转录试剂盒合成cDNA。
1.3.4.2 qPCR条件

表1 qPCR引物序列Table 1 Nucleotide sequences of primers used for real-time PCR
内参基因选用EF-1α,内参基因和CHS基因引物序列参考喻最新等[13]的研究,基因PAL、C4H、4CL、CHI、F3H、F3’5’H、DFR、ANS、UFGT、GST、Ruby的引物参考Carmona等[14]的研究。AI、SS1、SS2、SPS1、SPS2、SPS3、CS、AC、IDH的引物根据美国国家生物信息中心(National Center for Biotechnology Information,NCBI)数据库内相应EST序列用Primer Premier 5.0软件设计。具体的引物序列见表1。
qPCR使用TB Green™ Premix ExTaq™ II(Tli RNaseH Plus)试剂盒。在96 孔PCR板上加入如下反应体系:TBGreen Premix ExTaqTMII(2×)10 μL,上、下游引物(10 μmol/L)各1 μL,1.5 μL DNA模板,去离子水补足至20 μL。
使用CFX96TMReal-Time Systerm进行qPCR,反应程序为:95 ℃预变性30 s;95 ℃变性5 s,58 ℃复性30 s,经过40 个循环反应。扩增反应结束后进行65~95 ℃的溶解曲线分析,其中每5 s温度增加0.5 ℃,以鉴别引物二聚体和非特异性扩增。每个模板做3 次重复。采用2-ΔΔCt法计算基因相对表达量。
1.4 数据处理与分析
采用Excel软件结合SPSS 17.0软件对实验数据进行Pearson相关性分析,并用Origin 9软件绘图。
2 结果与分析
2.1 血橙成熟过程中果肉、果汁颜色及总花色苷质量浓度的变化

图1 血橙成熟过程中果肉、果汁颜色变化Fig.1 Changes in pulp and juice color of blood oranges during the ripening period
由图1可知,在开花后200~243 d,血橙果肉以及果汁肉眼几乎看不到红色,开花后261 d可以看到果肉微弱的红色,果汁颜色加深。随着果实进一步成熟,红色越来越深。至开花后324 d,果肉中可以看到一些红血丝,果汁呈红色,但着色并不深。

图2 血橙成熟过程中总花色苷质量浓度的变化Fig.2 Changes in total anthocyanin content of blood oranges juice during the ripening period
由图2可知,开花后200~243 d血橙果实中不含花色苷。开花后261 d在血橙果汁中开始检测到微量花色苷,且质量浓度随着果实成熟逐渐升高。开花后243~276 d,果汁中的花色苷质量浓度从0上升至2.84 mg/L,日均约提高0.09 mg/L;开花后276~293 d,果汁中的花色苷质量浓度从2.84 mg/L上升至12.25 mg/L,日均提高约0.55 mg/L;开花后293~324 d,果汁中的花色苷质量浓度从12.25 mg/L上升至19.28 mg/L,日均提高约0.23 mg/L。由此可知在整个成熟过程中,血橙果实中的花色苷在开花后276~293 d积累的速率最快。花色苷质量浓度的变化与果肉、果汁颜色的变化进程基本一致。
2.2 血橙成熟过程中花色苷合成相关结构基因相对表达量的变化

图3 血橙花色苷的生物合成途径[14]Fig.3 Biosynthesis pathway of anthocyanins in blood oranges[14]
血橙花色苷的生物合成途径已经研究得较为成熟[14]:如图3所示,苯丙氨酸在苯丙氨酸裂解酶(phenylalanine ammonialyase,PAL)、肉桂酸羟化酶(cinnamate 4-hydroxylase,C4H)、4-香豆酰辅酶A连接酶(4-coumarate CoA ligase,4CL)、查耳酮合成酶(chalcone synthase,CHS)、查耳酮异构酶(chalcone isomerize,CHI)、黄烷酮-3-羟化酶(flavonone 3-hydroxylase,F3H)、类黄酮-3-羟化酶(flavonoid 3'-hydroxylase,F3'H)和类黄酮-3,5-羟化酶(flavonoid 3'5'-hydroxylase,F3'5'H)的作用下经过一系列的反应转化为二氢黄酮醇。二氢黄酮醇是类黄酮代谢途径的一个重要节点,二氢黄酮醇既可以在黄酮醇合成酶(flavonol synthase,FLS)的作用下生成黄酮醇,又可以在二氢黄酮醇-4-还原酶(dihydroflavonol 4-reductase,DFR)作用下生成无色花青素,无色花青素经花青素合成酶(anthocyanin synthase,ANS)、类黄酮-3,5-糖苷转移酶(UDP-glucose-flavonoid 3-O-glucosyltransferase,UFGT)催化转化为花色苷,花色苷在谷胱甘肽转移酶(glutathione-S-transferases,GST)的作用下贮藏至液泡中。PAL、C4H、4CL、CHS、CHI、F3H、F3’5’H、DFR、FLS、ANS、UFGT、GST是血橙花色苷生物合成途径中的主要结构基因,这些基因的表达量与血橙中花色苷的积累密切相关,因此了解这些基因在血橙成熟过程中的表达情况可以从分子水平上初步了解血橙花色苷的积累机制。
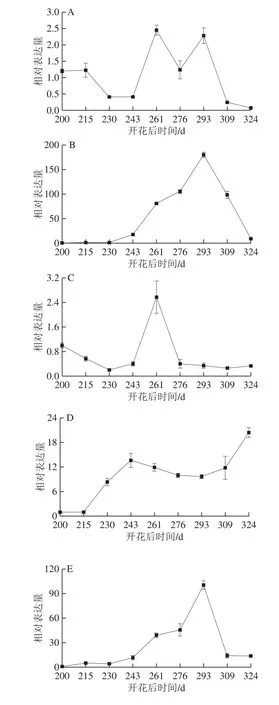


图4 血橙成熟过程中花色苷合成相关结构基因相对表达量的变化Fig.4 Changes in transcription levels of anthocyanin biosynthesis-related structural genes in the pulp of blood oranges during the ripening period
由图4可知,在血橙成熟过程中,果实中FLS基因的相对表达量在开花后200~243 d急剧上升,在开花后261~324 d相对表达量变化不大,因此推测开花后200~243 d是黄酮醇的迅速积累期。C4H、4CL、CHS、CHI、F3H、F3’5’H、DFR、ANS、UFGT、GST基因的相对表达量总体均呈先上升后下降的正态分布规律,开花后261~293 d为高效表达时期,其中4CL、CHS、F3’5’H、DFR、GST基因相对表达量的上调100 倍以上,F3H、ANS、UFGT基因相对表达量上调10 倍以上,而PAL、C4H、CHI基因相对表达量上调不明显。开花后261~293 d也是血橙果实中花色苷开始合成并快速积累的时期,结构基因高效表达的时期与血橙果实花色苷含量开始合成并快速积累的时期是一致的,因此可以推测4CL、CHS、F3H、F3’5’H、DFR、ANS、UFGT、GST基因在血橙果实花色苷合成的过程中起关键作用[14]。
2.3 血橙成熟过程中花色苷合成相关调节基因相对表达量的变化
Butelli等[15]从血橙中分离得到R2R3MYB转录因子并命名为Ruby。血橙和普通甜橙中均有Ruby基因,但在普通甜橙中Ruby转录因子相对表达量极低。将血橙和‘克里曼丁’杂交,后代果实中Ruby转录因子的表达量同果肉中的花色苷含量具有显著的相关性。由图5可知,在血橙果实成熟的过程中,Ruby转录因子的相对表达量呈现出先上升后下降的正态分布趋势,其中开花后261~293 d为高效表达时期,在开花后293 d达到表达高峰,上调表达19.57 倍。Ruby转录因子是影响‘塔罗科’血橙着色的关键转录因子。

图5 血橙成熟过程中Ruby转录因子相对表达量的变化Fig.5 Changes in transcription levels of Ruby in the pulp of blood oranges during the ripening period
2.4 血橙成熟过程中可溶性糖含量的变化
2.4.1 果糖、葡萄糖、蔗糖含量

图6 血橙成熟过程中不同种类糖含量的变化Fig.6 Changes in contents of various sugars in the pulp of blood oranges during the ripening period
柑橘中含有的可溶性糖主要是果糖、葡萄糖、蔗糖[16]。由图6可知,在开花后200~324 d血橙果实中的果糖含量整体呈持续上升的趋势,从13.68 mg/g上升至18.14 mg/g。血橙果实中果糖的积累速率在果实成熟前期(开花后200~261 d)较快,日均提高0.049 7 mg/g,后期(开花后261~324 d)积累速率明显下降,日均提高0.004 7 mg/g。
在开花后200~324 d血橙果实中的葡萄糖含量呈持续上升的趋势,从13.68 mg/g增加至17.66 mg/g,其中在开花后276 d略有下降。与果糖类似,血橙果实中葡萄糖的积累速率在果实成熟前期(开花后200~261 d)较快,日均提高0.048 4 mg/g,后期(开花后261~324 d)积累速率显著下降,日均提高0.016 3 mg/g。
在开花后200~324 d血橙果实中的蔗糖含量呈波动变化的趋势,在开花后215 d达到高峰,含量为35.32 mg/g。在开花后200~324 d,果实中的蔗糖增幅很小,仅增长了1.56 mg/g,远远小于果糖和葡萄糖的增幅。
在开花后200~324 d血橙果实中积累的可溶性糖主要为果糖和葡萄糖,蔗糖含量仅在开花后200~215 d有少量积累,在开花后215~324 d变化很小。王贵元等[17]研究发现红肉脐橙果肉中蔗糖主要在果实着色前积累,而葡萄糖和果糖主要于果实成熟过程中积累,成熟时果肉中葡萄糖、果糖和蔗糖含量比约为1∶1∶2,研究结果与本实验结果具有一致性。
2.4.2 总糖含量
由图6可知,血橙果实中果糖、葡萄糖、蔗糖含量比接近于1∶1∶2,因此蔗糖是影响果实总糖含量的主要因素。由图7可知,在开花后261~324 d血橙果实中的总糖含量基本呈波动上升的趋势,从57.92 mg/g上升至68.36 mg/g,日均提高0.084 2 mg/g。

图7 血橙成熟过程中总糖含量的变化Fig.7 Changes in total sugar content in the pulp of blood oranges during the ripening period
2.5 血橙成熟过程中糖代谢相关酶基因表达量的变化


图8 血橙成熟过程中蔗糖代谢相关酶基因相对表达量的变化Fig.8 Changes in transcription levels of sucrose metabolism-related genes in the pulp of blood oranges during the ripening period
与柑橘糖代谢相关的基因主要有酸性转移酶(acid invertase,AI)基因、蔗糖合成酶(sucrose synthase,SS)基因以及蔗糖磷酸合成酶(sucrose phosphate,SPS)基因[16]。由图8可知,在血橙成熟过程中,AI、SS1、SS2(蔗糖合成酶两个异构形式的基因)、SPS1、SPS2、SPS3(蔗糖磷酸合成酶基因3 个异构形式的基因)的表达量均呈波动变化。酸性转化酶催化蔗糖转化为葡萄糖和果糖,一般来说,AI基因表达量越高,蔗糖积累量越低[18]。但在本实验中并没有出现这样的现象,推测血橙果实中AI基因的表达量对果实糖分积累的调控作用比较小。蔗糖合成酶既可以分解蔗糖,又可以合成蔗糖[18]。SS1、SS2基因在大部分时间均上调表达,由此推测果实中的蔗糖处于不断被分解、合成的动态变化之中,造成了蔗糖含量的持续波动。血橙成熟过程中,SPS1基因在大部分时间下调表达,SPS2、SPS3基因在大部分时间均上调表达,因此推测,SPS2、SPS3基因在调控‘塔罗科’血橙糖分积累中具有重要作用。
2.6 血橙成熟过程中有机酸含量的变化
2.6.1 抗坏血酸、苹果酸、柠檬酸含量
由图9可知,血橙果实中的抗坏血酸含量在开花后200~215 d由0.72 mg/g上升到0.87 mg/g,随后波动下降,至开花后324 d,血橙果实中的抗坏血酸含量为0.61 mg/g。血橙果实中的苹果酸含量在开花后200~276 d持续下降,开花后276~309 d出现上升的趋势,接着继续下降。至开花后324 d,血橙果实中的苹果酸含量为0.43 mg/g。在开花后200~276 d,血橙果实中的柠檬酸含量缓慢下降,在开花后276~309 d柠檬酸含量出现上升的趋势,在开花后309~324 d开始急剧下降,由11.37 mg/g下降到6.52 mg/g。

图9 血橙成熟过程中不同种类有机酸含量的变化Fig.9 Changes in contents of various organic acids in the pulp of blood oranges during the ripening period
有机酸在果实发育过程中的一般规律为:在果实发育前期迅速积累升高,后期持续降低。果实成熟后期有机酸含量下降有很多原因,如果实体积增加、水分大量进入、有机酸的分解速率大于合成速率、有机酸作为基质参与呼吸和糖异生作用等[19]。但在开花后276~309 d,血橙果实中的柠檬酸和苹果酸含量均出现了升高的趋势,可见果实中有机酸的积累是一个复杂的过程,其含量受到有机酸合成、降解、贮藏、利用等多个方面的影响[20]。
2.6.2 总酸含量
血橙果实中的有机酸主要是柠檬酸,相对含量达到80%以上,总酸的变化曲线与柠檬酸的变化曲线基本一致。如图10所示,在开花后200~276 d,总酸含量缓慢下降,在开花后276~309 d出现了短暂上升的现象,在开花后309~324 d,果实中的总酸含量急剧下降。

图10 血橙成熟过程中总酸含量的变化Fig.10 Changes in total acid content in the pulp of blood oranges during the ripening period
2.7 血橙成熟过程中有机酸代谢相关酶基因表达量的变化
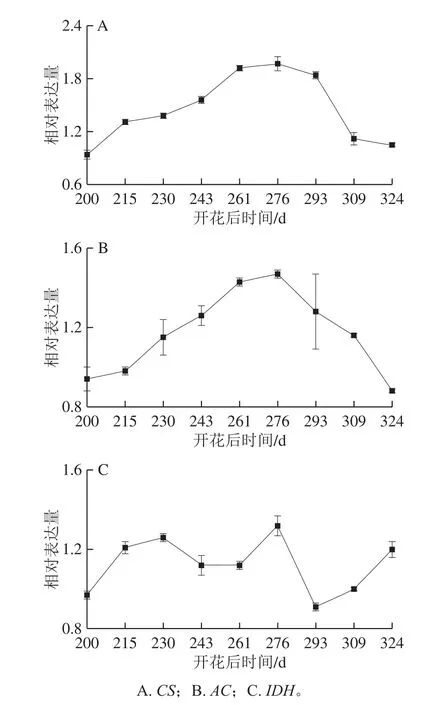
图11 血橙成熟过程中有机酸代谢相关酶基因相对表达量的变化Fig.11 Changes in transcription levels of citric acid metabolismrelated genes in the pulp of blood oranges during the ripening period
与柑橘有机酸代谢相关的基因主要是线粒体柠檬酸合成酶(citrate synthase,CS)基因、质体顺乌头酸酶(aconitase,AC)基因以及质体异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因。线粒体柠檬酸合成酶催化草酰乙酸和乙酰辅酶A合成柠檬酸,质体顺乌头酸酶催化柠檬酸转变为异柠檬酸,在质体异柠檬酸脱氢酶的作用下转变为α-酮戊二酸[21]。由图11可知,在果实成熟过程中,CS基因和AC基因相对表达量呈先升高后降低的正态分布规律,IDH基因相对表达量呈波动变化。同时,CS、AD、IDH基因在血橙果实成熟过程中均上调表达,由此推测果实中的柠檬酸一直在合成,同时不断被分解。在开花后309~324 d,果实中的CS基因和AC基因相对表达量均下降,但IDH基因相对表达量上升,造成果实中柠檬酸合成的速率较慢,但分解的速率比较快,引起柠檬酸含量的急剧下降。
2.8 血橙成熟过程中花色苷与可溶性糖、有机酸含量的相关性分析结果
糖是合成花色苷的原料,不仅可以通过糖酵解途径影响花色苷代谢,还作为信号分子[22],通过己糖激酶、Ca2+/钙调蛋白(calmodulin,CaM)、蛋白激酶/蛋白磷酸酶信号转导途径调控花色苷合成相关基因的表达进而调控花色苷的积累[23-24]。己糖激酶能够感知细胞间的糖信号引发糖信号传递[23]。Neta-Sharir等[24]研究发现糖作为信号分子通过己糖激酶信号转导途径调控花色苷的生物合成。甘露糖和D-2-脱氧葡萄糖均能被己糖激酶磷酸化,甘露糖、D-2-脱氧葡萄糖、果糖、葡萄糖、蔗糖均能够有效促进矮牵牛花积累花色苷。而3-O-甲基葡萄糖不能被己糖激酶磷酸化,研究发现它不具有调控花色苷合成的效果[23]。甘露庚酮糖是一种己糖激酶的抑制剂,它可以与己糖激酶竞争性结合从而抑制葡萄糖的磷酸化。研究发现甘露庚酮糖可以完全消除蔗糖[23]、葡萄糖[24]对花色苷合成的促进作用。植物中的Ca2+在很多生理和代谢活动中作为信号分子,Ca2+与它在细胞内的感受器CaM结合能够调节植物的生长发育,具有广泛的生物学功能[23]。维拉帕米和LaCl3都是钙通道阻滞剂,乙二醇-双-(2-氨基乙基)四乙酸是一种Ca2+螯合剂,三者均可以消除蔗糖对花色苷积累的诱导作用,而外源添加Ca2+可部分恢复蔗糖对花色苷积累的诱导作用,使用钙调蛋白拮抗剂W7和氯丙嗪处理同样会削弱蔗糖对花色苷积累的诱导作用。钙调蛋白也参与糖对花色苷调控的信号转导[23]。蛋白质磷酸化是细胞之间信号传递的重要途径,蛋白激酶和蛋白磷酸酶活性的平衡决定了蛋白质磷酸化的水平[25]。研究证实蛋白激酶抑制剂和蛋白磷酸酶抑制剂都可以削弱蔗糖对花色苷积累的调控[23]。由表2可知,血橙在成熟过程中果实中的花色苷质量浓度与果糖、葡萄糖含量正相关性极显著,相关系数分别为0.810和0.799,但与蔗糖、总糖的相关性不显著。由此推测,成熟过程中血橙果实中果糖、葡萄糖的快速积累可能是促进花色苷合成以及果实着色的重要原因。Weiss等[26]报道高等植物中糖的积累是促进花瓣着色的重要原因,本研究的结果与其报道具有一致性。
迄今为止,植物中有机酸和花色苷相关性的报道不是很多,很多研究都是关于pH值对花色苷稳定性的影响方面,有机酸可以改变液泡的酸碱环境从而影响花色苷的呈色以及稳定性;同时,花色苷合成相关酶均需要在一个合适的pH值范围内才能很好地发挥催化功能[27]。由表2可知花色苷质量浓度与抗坏血酸含量呈显著负相关,相关系数-0.715,与苹果酸含量呈极显著负相关关系,相关系数为-0.798,与柠檬酸和总酸呈负相关,但相关性不显著。这一研究结果与Liu Yulian等[28]的报道具有一致性,果实中的有机酸可以通过取代花色苷的糖苷配基从而影响花色苷的呈色,降低花色苷的含量。因此推测有机酸尤其是抗坏血酸、苹果酸含量的下降可能也是促进果实花色苷含量上升的原因。但血橙中含有的抗坏血酸与苹果酸都是微量的,成熟过程中血橙果实中抗坏血酸与苹果酸含量的下降与花色苷的积累是否存在直接的关联还有待进一步验证。
3 结 论
在‘塔罗科’血橙成熟过程中(开花后200~324 d),果实中的花色苷质量浓度呈逐渐上升的趋势。在开花后261 d开始在血橙汁中检测到花色苷,开花后276~293 d是血橙果实花色苷的快速积累时期,在此期间血橙汁中的花色苷质量浓度日均提高0.55 mg/L。至开花后324 d,血橙汁中的花色苷质量浓度为19.28 mg/L。4CL、CHS、F3H、F3’5’H、DFR、ANS、UFGT、GST基因是调控血橙果实花色苷积累的核心结构基因,Ruby转录因子是调控血橙果实花色苷合成的关键转录因子。血橙成熟过程中,花色苷质量浓度与果糖、葡萄糖含量达到极显著正相关,相关系数分别为0.810和0.799。成熟过程中血橙果实中果糖、葡萄糖的积累可能是促进花色苷积累的重要原因。血橙成熟过程中花色苷含量与抗坏血酸含量呈显著负相关,相关系数为-0.715,与苹果酸含量呈极显著负相关,相关系数为-0.798。血橙成熟过程中抗坏血酸、苹果酸含量的下降可能也会促进血橙果实中花色苷的积累。但血橙果实中抗坏血酸与苹果酸的含量都很少,成熟过程中血橙果实中抗坏血酸与苹果酸含量的下降与花色苷的积累是否具有因果关系还有待进一步验证。

