急性纤维素性机化性肺炎2例报告并文献复习
梁裕积 宾雁飞 梁 毅 何志义
(1 钦州市第一人民医院重症医学科,广西钦州市 535000,电子邮箱:247546153@qq.com;2 广西医科大学第一附属医院呼吸与危重症医学科,南宁市 530021)
急性纤维素性机化性肺炎(acute fibrinous and organizing pneumonia,AFOP)的概念由Beasley等[1]于2002年首次提出,其组织学特征主要表现为以“球型纤维蛋白”形式不均匀分布在肺泡腔的纤维蛋白。目前,未能明确此病变是已有特发性间质性肺炎(idiopathic interstitial pneumonia,IIP) 亚型的变异型还是仅仅出现于某些疾病中,因此在2013年美国胸科学会欧洲呼吸学会特发性间质性肺炎的国际多学科分类中[2],AFOP尚不能作为IIP的独立新亚型。但鉴于其在组织学表现上有其自身特征,在多学科确定其为独立的IIP亚型前,将这些病理类型作为临时的病理诊断仍有一定的临床意义。AFOP的诊断需根据临床及影像学表现、实验室检查及组织病理学结果,并排除其他可能伴随的肺部疾病。在临床中,AFOP极易被误诊。本文分析广西医科大学第一附属医院近年来收治的2例AFOP患者的临床表现、影像学及病理资料,以期提高对该病的认识。
1 临床资料
1.1 病例1 患者,男性,57岁,因“发热伴右胸痛13 d”于2014年1月25日入院。患者入院前13 d无明显诱因下出现发热,伴右胸阵发性钝痛。 2014年1月16日在当地医院住院行胸部CT检查提示右肺炎症、右侧胸膜轻度增厚,诊断为“肺炎”,给予头孢哌酮舒巴坦联合左氧氟沙星抗感染治疗;发热、胸痛症状无改善,并出现咳嗽、咳黄色浓痰,复查胸部CT提示两肺炎症、右侧胸腔积液,病情加重,遂改为亚胺培南/西司他丁抗感染。患者症状仍无好转,于1月25日到我院就诊,拟“肺炎”收住我科。
入院查体:体温37.0℃,脉搏99次/min,呼吸27次/min,血压119/72 mmHg;皮肤黏膜无黄染,淋巴结无肿大,叩诊双肺清音,听诊双肺呼吸音粗,可闻及少量湿啰音;心率99次/min,心律齐,未闻及病理性杂音;腹部平坦,腹肌软,肠鸣音正常,无杵状指(趾)。入院后行相关实验室检查:血常规提示白细胞计数 11.1×109/L,中性粒细胞比例0.82;C反应蛋白 105.4 mg/L;动脉血气分析提示吸入氧浓度为0.29,pH 7.46,PaCO235 mmHg,PaO269 mmHg,SaO293%。完善肺功能检查,结果见表1。诊断:社区获得性肺炎。入院后先后使用五水头孢唑林+左氧氟沙星、头孢哌酮舒巴坦+万古霉素、亚胺培南西司他丁钠3种方案抗感染治疗,患者仍有发热、胸痛等症状。复查胸部CT可见右肺大片状实变影及左肺斑片状影(见图1),多次痰、血培养结果阴性。行纤维支气管镜检查,支气管黏膜咬检病理检查结果提示肺组织病变轻重不一,分布不一致,大部分肺组织可见间隔增宽,结缔组织增生,肺泡腔内可见纤维素样渗出,呈球状(见图2)。肺泡灌洗液培养结果提示曲霉菌属生长。根据病理检查结果,诊断考虑为AFOP,合并肺部曲霉菌感染。2月26日开始给予伏立康唑(0.2 g/次,静脉滴注,2次/d)及甲强龙(40 mg/次,静脉滴注,1次/d)治疗,患者发热、咳嗽、咳痰症状明显减轻。3月2日复查胸部CT提示两肺病灶及右侧胸腔积液较前明显吸收减少;3月6日复查肺功能较前改善。患者病情好转,于3月9日出院。出院后停用伏立康唑及甲强龙,并改用醋酸泼尼松(20 mg/次,口服,1次/d)治疗,症状无再发。3月26返院复查胸部CT提示两肺病灶较前稍吸收,住院期间给予伊曲康唑(0.2 g/次,口服,2次/d)及甲强龙(30 mg/次,静脉滴注,1次/d)治疗。3月31日出院时继续原方案伊曲康唑抗真菌,糖皮质激素改用醋酸泼尼松片(30 mg/次,口服,1次/d),5月8日剂量减至为20 mg(口服,1次/d),6月1日剂量减至为15 mg(口服,1次/d),以后每周减量5 mg直至停用。随访至今患者症状未再发。
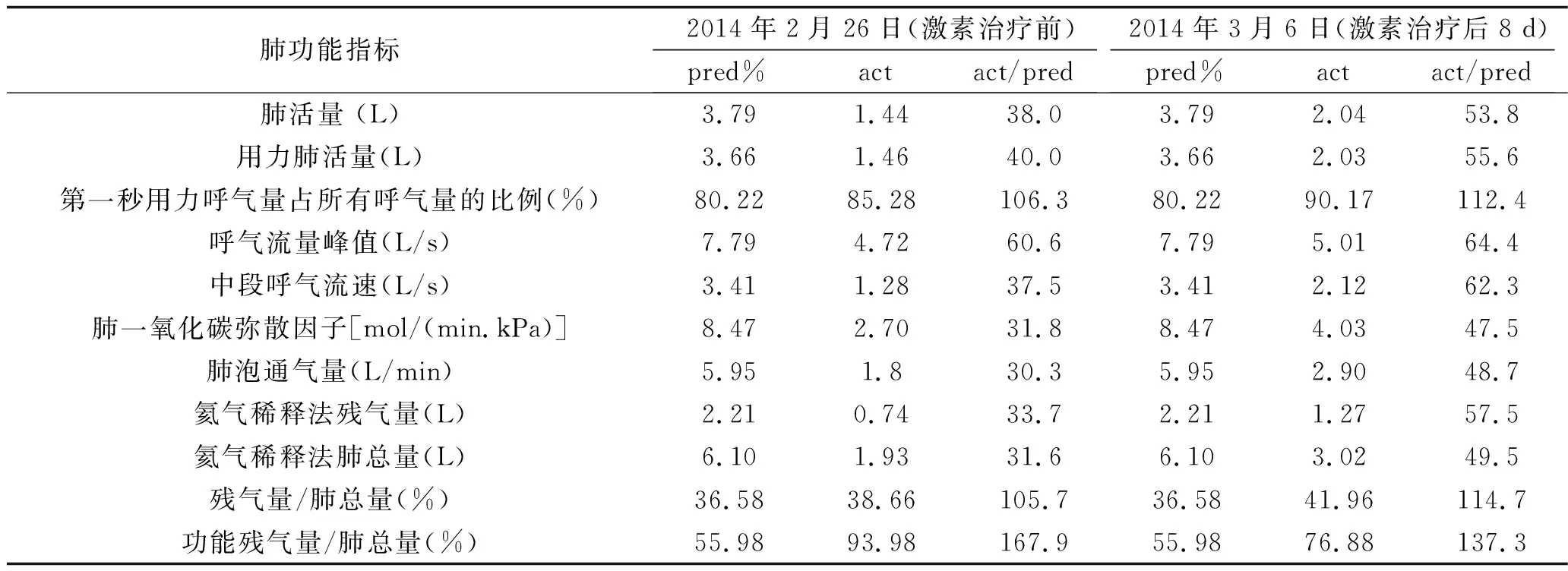
表1 病例1入院时肺功能检查结果
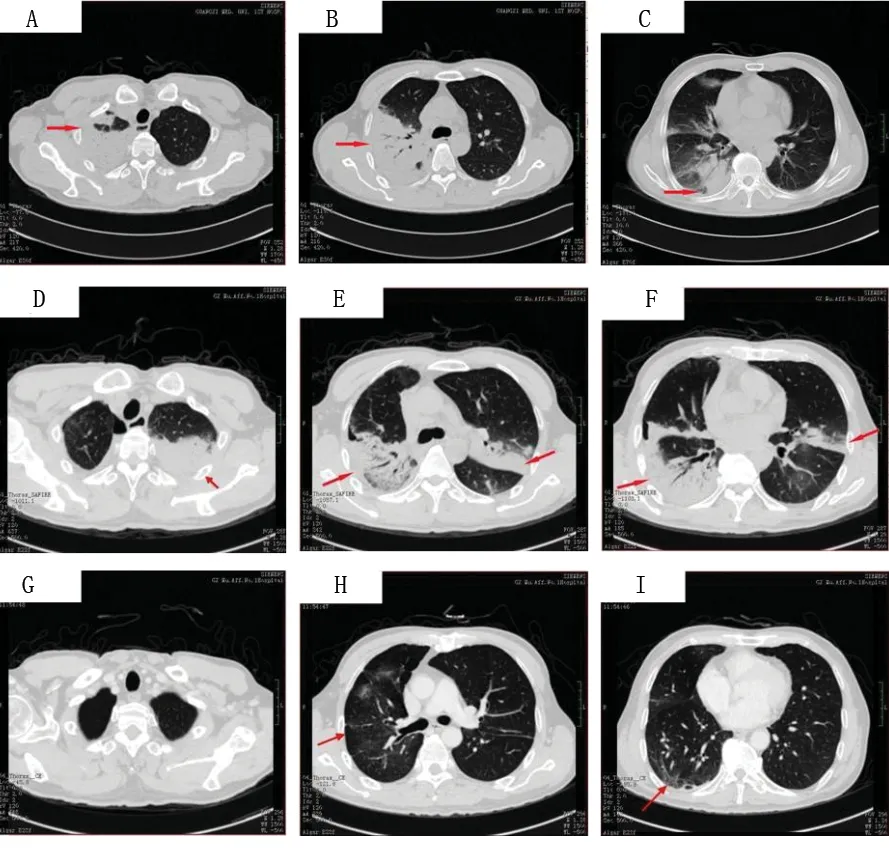
图1 病例1肺部CT
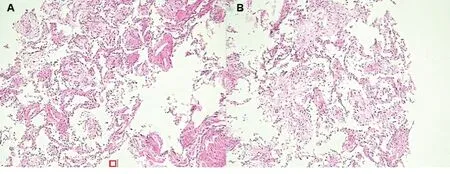
图2 病例1支气管黏膜咬检病理检查结果(苏木精-伊红染色,×200)
1.2 病例2 患者,女性,28岁,因“反复发热伴胸痛1月余、咳嗽咳痰25 d”于2017年12月28日入院。患者于2017年11月20日开始出现发热,伴左后侧胸壁刺痛,于2017年11月28日至12月18日在当地医院就诊,查血常规提示白细胞计数23.68×109/L,中性粒细胞比值0.709,胸部X线检查提示胸膜炎,诊断为“胸膜炎”。先后给予头孢他啶、左氧氟沙星+多西环素等方案抗感染治疗,但患者胸痛症状加重,出现咳嗽、咳痰,体温最高39.0℃,且出现呼吸困难。12月9日查血常规提示白细胞计数29.88×109/L,中性粒细胞百分比0.863,胸部CT(图3)提示两肺炎症、两侧胸腔积液并两下肺膨胀不全。给予美罗培南(12月9~14日)、莫西沙星+多西环素(12月16~17日)抗感染,同时给予甲泼尼龙(12月12日起40 mg/次,静脉滴注,1次/d; 12月15日开始改用80 mg/次,静脉滴注,1次/d)抗炎,患者呼吸困难稍缓解,仍咳嗽,反复发热,体温最高达39.4℃。于2017年12月18日至我院急诊就诊,拟“肺炎”收入留观病房。
入院查体:体温37.7℃,脉搏95次/min,呼吸22次/min,血压111/71 mmHg;神志清楚,急性病容,皮肤巩膜轻度黄染;双肺呼吸音粗,两肺可闻及湿啰音,未闻及胸膜摩擦音;心界不大,心率95次/min,心律齐,各瓣膜区未闻及杂音;全腹柔软,无压痛及反跳痛,腹部未触及包块。入院后查血常规白细胞计数25.90×109/L,中性粒细胞百分比0.879。复查胸部CT(图3)提示两肺炎症、两侧胸腔积液,心包少量积液。入院诊断:发热查因(肺部感染?结缔组织病?血液系统疾病?);肺炎。给予哌拉西林/他唑巴坦+左氧氟沙星(12月19~22日)+氟康唑(12月20~22日)抗感染,甲泼尼龙(12月22~26日为80 mg/次,静脉滴注,2次/d;12月27日改为40 mg/次,静脉滴注,2次/d)改善肺部纤维化等治疗。患者于12月25日出现呼吸急促、指脉氧下降,给予气管插管呼吸机辅助呼吸后症状好转。于12月26日行超声引导下经皮肺穿刺活检术,病理结果(图4)提示符合肺组织急性渗出性炎改变,抗酸及过碘酸雪夫氏染色均阴性。12月28日转入重症医学科,查体:体温37.6℃,脉搏103次/min,呼吸22次/min,血压132/79 mmHg;神志镇静,贫血面容,皮肤巩膜轻度黄染;右肺叩诊呈浊音,左肺叩诊呈清音,两肺可闻及湿啰音;心率103次/min,心律齐;双下肢中度凹陷性水肿。相关辅助检查:12月28日查血常规提示白细胞计数20.58×109/L,中性粒细胞百分比0.942;C反应蛋白59.05 mg/L;动脉血气分析提示吸入氧浓度为0.42,pH 7.45,PaCO237 mmHg,PaO288 mmHg,SaO296%;补体C30.553 g/L,补体C40.059 g/L。12月29日骨髓穿刺结果提示为反应性骨髓象,活检未见明确肿瘤细胞,骨髓培养出人葡萄球菌。2017年12月31日、2018年1月5日两次痰培养均提示鲍曼不动杆菌感染。2018年1月1日CT(图3)提示两肺炎症,两侧胸腔积液,心包少量积液。1月8日血培养提示鲍曼不动杆菌感染。给予呼吸机辅助呼吸,抗感染(2017年12月28日至2018年1月3日使用替加环素+亚胺培南/西司他丁+伏立康唑,1月3~17日改用亚胺培南/西司他丁+万古霉素+伏立康唑,1月18~21日改用头孢哌酮舒巴坦+盐酸米诺环素+万古霉素+伏立康唑),甲泼尼龙(40 mg/次,静脉滴注,2次/d)抗炎等治疗。1月12日、1月19日(图3)复查肺部CT提示两肺病灶逐渐吸收、好转,1月22日转呼吸内科继续治疗。1月25日行肺功能检查(见表2):中重度限制性通气功能障碍,舒张试验阴性,弥散量、校准弥散量中度减少,弥散率、校准弥散率轻度减少。当日停用伏立康唑及米诺环素,糖皮质激素调整为醋酸泼尼松(20 mg,口服,每日1次),1月29日复查CT(图3)提示肺部病灶明显吸收好转,病情稳定于1月30日出院。出院后遵嘱服用醋酸泼尼松(20 mg/次,口服,1次/d;3月1日改为15 mg/次,口服,1次/d)。患者3月5日回院复诊,无发热、胸痛、气促等症状,复查CT(图3)提示两肺病灶基本吸收,左肺下叶内基底段炎性结节。随访至2018年3月15日,患者无不适症状,仍服用醋酸泼尼松(15 mg/次,口服,1次/d)治疗。
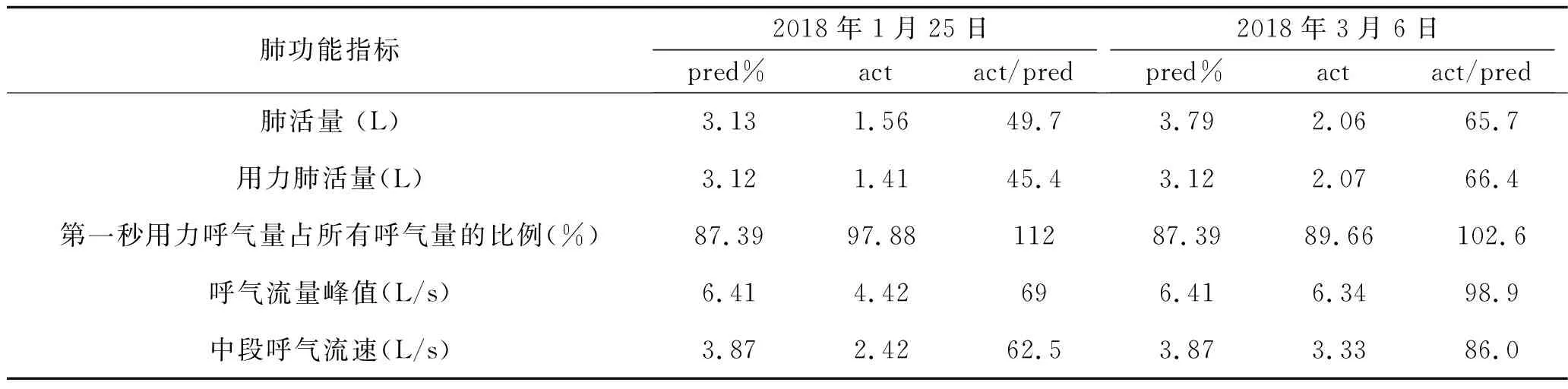
表2 病例2肺功能检查结果
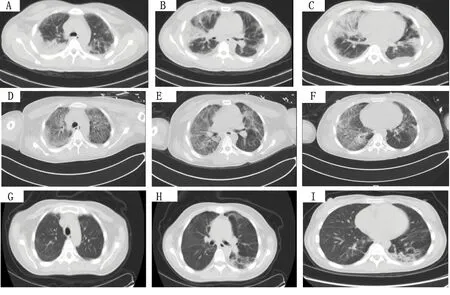
图3 病例2肺部CT

图4 病例2经皮肺穿刺病理结果(苏木精-伊红染色,×400)
2 讨 论
2002年,Beasley等[1]对17例急性/亚急性肺损伤患者进行研究后发现,这些患者的病理表现为肺泡间隔可见淋巴细胞与浆细胞浸润,肺泡腔内大量纤维蛋白沉积,形成均质嗜酸性的纤维蛋白球,部分纤维素球内或周边有新生的纤维组织,呈片状分布,类似于机化性肺炎的组织结构,但在病理改变上又与传统的间质性肺疾病(如弥漫性肺泡损伤、机化性肺炎及嗜酸性细胞肺炎等)有所不同,即无透明膜形成、无明显的嗜酸性粒细胞浸润、不形成肉芽肿,故命名为AFOP。AFOP既可以是特发性,也可以继发于其他疾病,如感染(包括细菌、真菌、病毒等)、免疫性相关疾病(如系统性红斑狼疮[3])、造血干细胞或其他器官移植术后[4]、肿瘤[5]、药物(如胺碘酮[6]、地西他滨[7]等)及职业暴露等。AFOP中纤维蛋白球形成的机制目前尚未完全明确,可能与弥漫性肺泡损伤中透明膜的形成类似[8]。纤维蛋白球及透明膜均源自肺泡毛细血管血浆中的纤维蛋白,肺泡损伤后,纤维蛋白由毛细血管内渗进肺泡腔,随着水分的呼出与吸收、干燥,纤维蛋白在肺泡内壁贴附、沉着,形成均质的透明膜。纤维蛋白球的形成与此相似,考虑AFOP的发病机制为各种原因(原发或继发)导致肺泡损伤、肺泡壁毛细血管通透性增加、纤维蛋白渗出后附壁沉着形成纤维蛋白球。国内外研究发现,此病理形态既可存在于各类型的肺损伤中,也可与其他组织学改变混合存在,临床过程差异较大[9-12]。因此目前对于是否将其作为独立的一类疾病,或者归为可与多种病变并存的组织学改变,仍存在较大争议。
AFOP可急性或亚急性起病,急性起病通常在1周内,亚急性起病病程1周至3个月,主要临床表现为发热、咳嗽咳痰、胸痛及呼吸困难等呼吸道症状,但缺乏特异性。实验室检查结果常有外周血常规白细胞计数、C反应蛋白升高,动脉血气分析表现为低氧血症。本文两例患者均为特发性起病,未找到相关病因,临床表现均以发热、胸痛为主要症状,均出现低氧血症,且病例2的白细胞计数、C反应蛋白明显升高。AFOP的胸部X线表现为以双下肺为主的浸润影[1],而胸部CT初期表现为双肺弥漫性磨玻璃影、斑片状密度增高影,若病情加重则进展为大片状实变影伴支气管充气征,以双肺基底部多见,而少部分患者可表现为孤立结节影、网格状阴影[13-14]。本文两例患者肺部CT均可见大片状渗出性病灶以及支气管含气征,表现与大叶性肺炎相似,但抗感染治疗之后患者症状无缓解,而经糖皮质激素治疗后肺部病灶吸收。
由于AFOP的临床表现及胸部影像学无特异性,目前尚无统一的诊断标准,需将临床表现、影像学特点及病理相结合进行诊断,其中病理结果是诊断的关键。其病理学诊断标准:大块肺组织中见肺泡内纤维素沉积并形成纤维蛋白球,同时纤维蛋白沉积在肺泡相连或邻近的肺泡管和细支气管内,形成机化的疏松结缔组织。2010年以前获取病理组织的方法主要是开胸肺活检,虽然获得的组织病理结果更可靠,但因创伤及风险较大,现在已较少应用于临床。2010年开始多采用经皮肺穿刺、经胸腔镜下肺活检和经支气管肺活检的方法[15]。本文2例患者分别采用纤维支气管镜以及经皮肺活检取样行病理诊断,均可见肺泡内有大量纤维组织,符合AFOP的病理表现,临床治疗与转归进一步证实了本研究的两例患者均为AFOP。
糖皮质激素是治疗AFOP的主要方案,但目前尚无统一的治疗剂量与疗程,不同文献报道的剂量与疗程各不相同[16]。多数临床工作者根据患者的肺部病变范围、进展,以及呼吸等情况调整糖皮质激素用量和疗程。急性起病的AFOP患者对糖皮质激素疗效差,容易进展为呼吸衰竭,死亡率高[17-19],需呼吸机辅助通气治疗,而亚急性起病者的糖皮质激素疗效、预后相对较好[20-22],但在激素减量的过程中容易复发[23]。本文2例患者均为亚急性起病,经糖皮质激素治疗后预后均相对较好。
总之,AFOP在临床中不常见,临床表现无特异性,影像学与社区获得性肺炎、隐源性机化性肺炎等较为相似,极易被误诊,急性起病对糖皮质激素效果欠佳,而亚急性起病对糖皮质激素治疗反应良好。AFOP具有独特的病理特征,目前对于其是否为独立的疾病实体仍然有争议,临床报道也相对较少,尚未引起临床医师的重视。对于发热和影像学表现为肺部实变影的疑诊社区活动性肺炎患者,常规抗生素无效时,临床医师在鉴别诊断时需要考虑AFOP的可能;明确诊断需依据临床-影像-病理学结果,选择合适的肺活检及组织病理学检查是明确诊断的关键。

