温中祛寒三方对急性胰腺炎模型小鼠TRPV1表达的影响
郭蓉 高蔚 殷茵 韩雪珍 陈香云 刘甜甜 吴丹桐 安致君 杨桢 刘珍洪
摘要 目的:探讨温中祛寒的小建中汤、吴茱萸汤和理中丸减轻急性胰腺炎炎性反应和疼痛的作用机制。方法:选取30只雄性小鼠并随机分为正常组、模型组、小建中汤组、吴茱萸汤组、理中丸组,每组6只。模型组和各给药组小鼠使用雨蛙素造模。观察组分别灌胃小建中、吴茱萸汤和理中丸水溶液。正常组和模型组小鼠给予等量双蒸水灌胃。检测并比较各组小鼠疼痛行为、血清淀粉酶(AMY)、髓过氧化物酶(MPO)、胰腺病理及胰腺组织中瞬时受体电位香草酸受体1(TRPV1)、NK1R和降钙素基因相关肽(CGRP)蛋白表达。结果:与模型组比较,小建中汤、吴茱萸汤和理中丸均能延迟小鼠疼痛行为第1次出现时间、降低MPO活性、降低AMY水平,差异有统计学意义(P<0.05),下调TRPV1、NK1R和CGRP蛋白表达,差异有统计学意义(P<0.05)。结论:温中祛寒三方减轻急性胰腺炎小鼠模型的炎性反应和疼痛可能是通过下调TRPV1、NK1R和CGRP的表达来实现。
关键词 小建中汤;吴茱萸汤;理中丸;急性胰腺炎;热敏通道;瞬时受体电位香草酸受体1;神经激肽1受体;降钙素基因相关肽;作用机制
Effects of 3 Formulas of Warming Spleen and Stomach for Dispelling Cold on the Expression of TRPV1 in Model Mice with Acute Pancreatitis
GUO Rong,GAO Wei,YIN Yin,HAN Xuezhen,CHEN Xiangyun,LIU Tiantian,WU Dantong,AN Zhijun,YANG Zhen,LIU Zhenhong
(Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objective:To explore the mechanism Xiaojianzhong Decoction,Wuzhuyu Decoction and Lizhong Pills in the formulas of warming spleen and stomach for dispelling cold in alleviating inflammation and pain in acute pancreatitis.Methods:A total of 30 male mice were randomly divided into a normal group,a model group,a Xiaojianzhong Decoction group,a Wuzhuyu Decoction group and a Lizhong Pills group,with 6 mice in each group.Mice in the model group and each administration group were modeled with caerulein.Mice in the treatment groups were given intragastric solution of Xiaojianzhong Decoction,Wuzhuyu Decoction and Lizhong Pills respectively.Mice in the normal group and the model group were given the same amount of double distilled water by gavage.The pain behavior,AMY,MPO,protein expression of TRPV1,NK1R and CGRP in pancreatic pathology and tissues of mice in each group were detected and compared.Results:Compared with the model group,Xiaojianzhong Decoction,Wuzhuyu Decoction and Lizhong Pills can delay the first occurrence time of pain behavior in mice,reduce MPO activity ,reduce AMY level (P<0.05),and down-regulate the expression of TRPV1,NK1R and CGRP proteins (P<0.05).Conclusion:The 3 formulas of warming spleen and stomach for dispelling cold can alleviate inflammation and pain in acute pancreatitis model mice by down-regulating the expression of TRPV1,NK1R and CGRP proteins.
Keywords Xiaojianzhong Decoction; Wuzhuyu Decoction; Lizhong Pills; Acute pancreatitis; Thermal channel; TRPV1; NK1R; CGRP; Mechanism
中圖分类号:R285.5;R576文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.15.013
急性胰腺炎(Acute Pancreatitis,AP)是胰腺的急性炎性反应,其发病率近些年有明显的上升趋势,其中一些患者最终发展为重型急性胰腺炎(Severe Acute Pancreatitis,SAP),之后又迅速发展为多器官功能障碍,AP患者发生这种情况的发生率为20%~30%[1]。腹痛常为AP患者的就诊原因,严重者可发展为急腹征。因此,临床上减轻患者疼痛的症状尤为重要,并且也成为临床上治疗该病效果评价指标之一。迄今为止,西医还没有特定的药物或方法来治疗这种疾病。中医根据其腹痛的辨证要点,将其归属到“腹痛”“胃脘痛”等病症中。《方剂学》温中祛寒中的小建中汤、吴茱萸汤和理中丸在临床上主要治疗急慢性胰腺炎[2-3]、急慢性胆囊炎[4-5]、急慢性结肠炎[6]、功能性腹痛[7-8]等中焦腹痛病症,疗效显著。现在普遍认为神经源性炎性反应在急性胰腺炎发展中起重要作用,瞬时受体电位香草酸受体1(TRPV1)通道的激活及后续P物质(SP)和降钙素基因相关肽(CGRP)在脊髓和外周的释放量增加在炎性活动和介导疼痛中发挥着重要作用[9]。本研究采用雨蛙素重复腹腔注射诱导急性胰腺炎模型,研究小建中汤、吴茱萸汤和理中丸对小鼠急性胰腺炎胰腺组织TRPV1、神经激肽1受体(NK1R)、SP受体、和CGRP表达的影响,探讨三方减轻急性胰腺炎炎性反应和胰腺疼痛效应的可能作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性C57BL/6小鼠30只,8周龄(20~25 g),由北京维通利华实验动物技术有限公司提供[许可证号:SCXK(京)2016-0006]。动物饲养于北京中医药大学实验动物房,动物伦理审批号:BUCM-4-2018010802-1008。
1.1.2 药物 小建中颗粒剂,湖南康尔佳制药股份有限公司,15 g/袋,生产批号:170638;吴茱萸汤细粒(日本松浦汉方,生产批号:P6Q4),2 g/包;理中丸[国药集团冯了性(佛山)药业有限公司,生产批号:170006],9 g/丸。
1.1.3 试剂与仪器
雨蛙素(上海源叶生物科技有限公司,货号:S25157);兔抗鼠β-action多抗(英国Abcam公司,货号:ab6276);兔抗鼠NK1R多抗(美国Novus公司,货号:NB300-119);髓过氧化物酶酶联免疫吸附试验(ELISA)试剂盒(Raybiotech生物公司,批号:20160405);兔抗鼠CGRP多抗(美国Santa cruz公司,货号:SC-57053);免疫组织化学法通用型二步法检测试剂盒(北京中杉金桥,货号:PV-9000);兔抗鼠TRPV1多抗(美国Proteintech公司,货号:22686-1-AP);血清淀粉酶试剂盒(南京建成生物工程研究所有限公司,货号:C016-1);光学显微镜(日本Olympus公司,型号:BX60);离心机(德国Eppendorf公司,型号:5415D);Biotek酶标仪450 nm(美国BIO-RAD公司,型号:Elx800);数字凝胶成像系统(美国ALPHA INNOTECH公司,型号:FLUROCHEM9900-50)等。
1.2 方法
1.2.1 分组与模型制备
将C57BL/6雄性小鼠30只隨机分为正常组、模型组、小建中汤组、吴茱萸汤组和理中丸组,每组6只,适应性喂养7 d后开始实验。模型组和各给药组小鼠雨蛙素按50 μg/kg,100 μL/只/次行腹腔内注射,注射1次/h,共8次。正常组小鼠以等量生理盐水行腹腔内注射。
1.2.2 给药方法
给药分为3次给药,即在雨蛙素第1次腹腔注射后1 h第1次给药、雨蛙素第8次注射后1 h第2次给药、雨蛙素第1次腹腔注射后24 h第3次给药。根据临床治疗70 kg体质量的患者,每日服用小建中汤、吴茱萸汤和理中丸按照生药量计分别为45 g、6 g和18 g,根据“人和动物按体表面积折算的等效剂量比值表”折算,三方观察组分别灌胃小建中颗粒,5.85 g/(kg·d)、吴茱萸汤细粒,0.78 g/(kg·d)和理中丸,2.34 g/(kg·d);正常组和模型组小鼠灌服等量0.9%双蒸水溶液。
1.2.3 检测指标与方法
1.2.3.1 小鼠疼痛行为观察 热板实验在取材前1 h进行。测试前各组小鼠在测试环境中适应1 h,将热板温度调至(55+1)℃,记录小鼠在30 s内疼痛行为(舔/抬后爪和跳跃)第1次出现时间[10]。
1.2.3.2 血清淀粉酶(AMY)水平、髓过氧化物酶(MPO)活性 各组小鼠注射戊巴比妥钠麻醉后,小鼠摘眼球取血,离心后取血清用于血清淀粉酶检测,具体按照试剂盒提供的方法步骤进行。颈椎脱臼法处死小鼠后,剥离胰腺组织保存于-80 ℃冰箱,酶联免疫吸附试验(ELISA)法检测小鼠髓过氧化物酶活性,按照说明书将标准品和样品加入相应的孔中,用密封膜密封整个板,在4 ℃孵育过夜,之后用PBS冲洗3次,随后加入生物素标记抗体,并在室温下培养1 h,PBS冲洗3次。每个反应孔加入HRP-链霉亲和素室温孵育45 min后洗涤,每个孔中加入100 μL TMB显色溶液,在室温下孵育30 min,最后在每个孔中加入50 L终止溶液,并立即在酶标仪上以450 nm的速度读取数值。
1.2.3.3 胰腺组织病理 10%甲醛溶液固定的胰腺组织经过脱水、透明并浸蜡,包埋,切片,脱蜡,苏木精-伊红染色,中性树胶封片。100倍高倍显微镜下摄片。胰腺组织损伤情况表现为胰腺水肿,小叶间隙局限性扩张,胰腺腺泡空泡化及坏死,脂肪组织坏死,间质及血管周围炎性细胞浸润等[1]。
1.2.3.4 免疫组织化学法检测胰腺组织中TRPV1、NK1R和CGRP蛋白 免疫组织化学法检测,参照相关文献[11]进行。应用Image Pro Plus 6.0软件进行半定量分析,以累积光密度IOD为指标。
1.2.3.5 免疫印迹法检测胰腺组织中TRPV1、NK1R和CGRP蛋白表达 将-80 ℃冰箱保存的小鼠胰腺组织冰上解冻称重,加入含蛋白酶抑制剂的RIPA裂解液后离心吸取上清。上清液进行蛋白定量测定后,每组样本放在10%聚丙烯酰胺凝胶上电泳后转到PVDF膜上。5%脱脂奶粉封闭液中封闭1 h。弃去封闭液加入一抗进行杂交,于4 ℃反应过夜。取出PVDF膜,TBST漂洗4次。加入二抗(1∶1 000稀释),室温振摇反应1 h。取出PVDF膜,TBST漂洗4次。将膜放入数字凝胶成像系统中检测,观察并拍摄蛋白条带。
1.3 统计学方法
采用SPSS 20.0统计软件和Image-Pro Plus 6.0软件进行数据分析,图像处理采用Graphpad prism 7.0软件,组间测量数据比较采用单因素方差分析,计量资料以均值±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
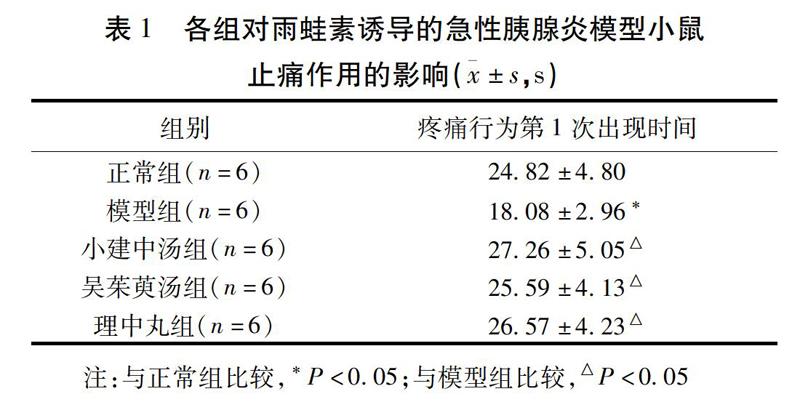
2.1 各组小鼠疼痛行为比较 与正常组比较,模型组小鼠疼痛行为(舔/抬后爪和跳跃)第1次出现时间明显缩短,差异有统计学意义(P<0.05),各观察组小鼠疼痛行为第1次出现时间差异无统计学意义(P>0.05)。与模型组比较,各观察组均能延迟小鼠疼痛行为第1次出现时间,差异有统计学意义(P<0.05)。见表1。
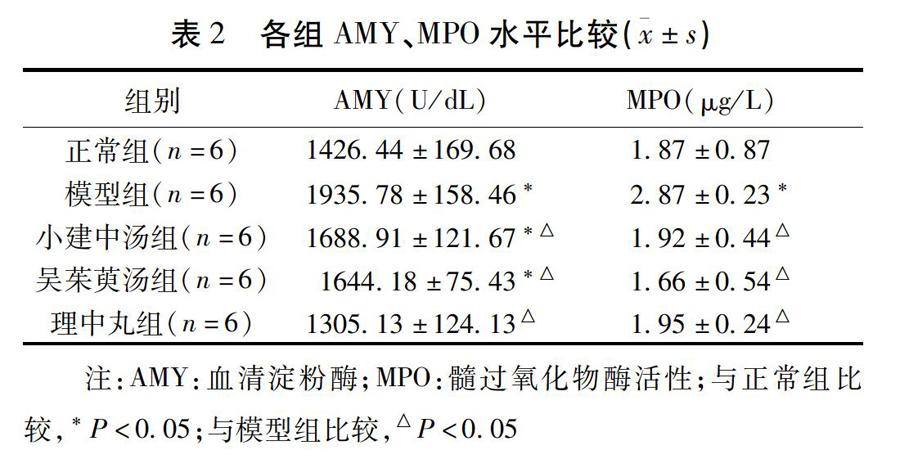
2.2 各组小鼠AMY、MPO水平比较 模型组小鼠血清AMY水平、MPO水平较正常组比较均有明显上升,差异有统计学意义(P<0.05);小建中汤组、吴茱萸汤组小鼠血清AMY水平较正常组比较有上升,差异有统计学意义(P<0.05),而理中丸组小鼠血清AMY水平差异无统计学意义(P>0.05);各给药组小鼠MPO含量与正常组比较,差异无统计学意义(P>0.05)。与模型组比较,观察组三方均降低了小鼠血清AMY水平、小鼠MPO水平,差异有统计学意义(P<0.05)。见表2。
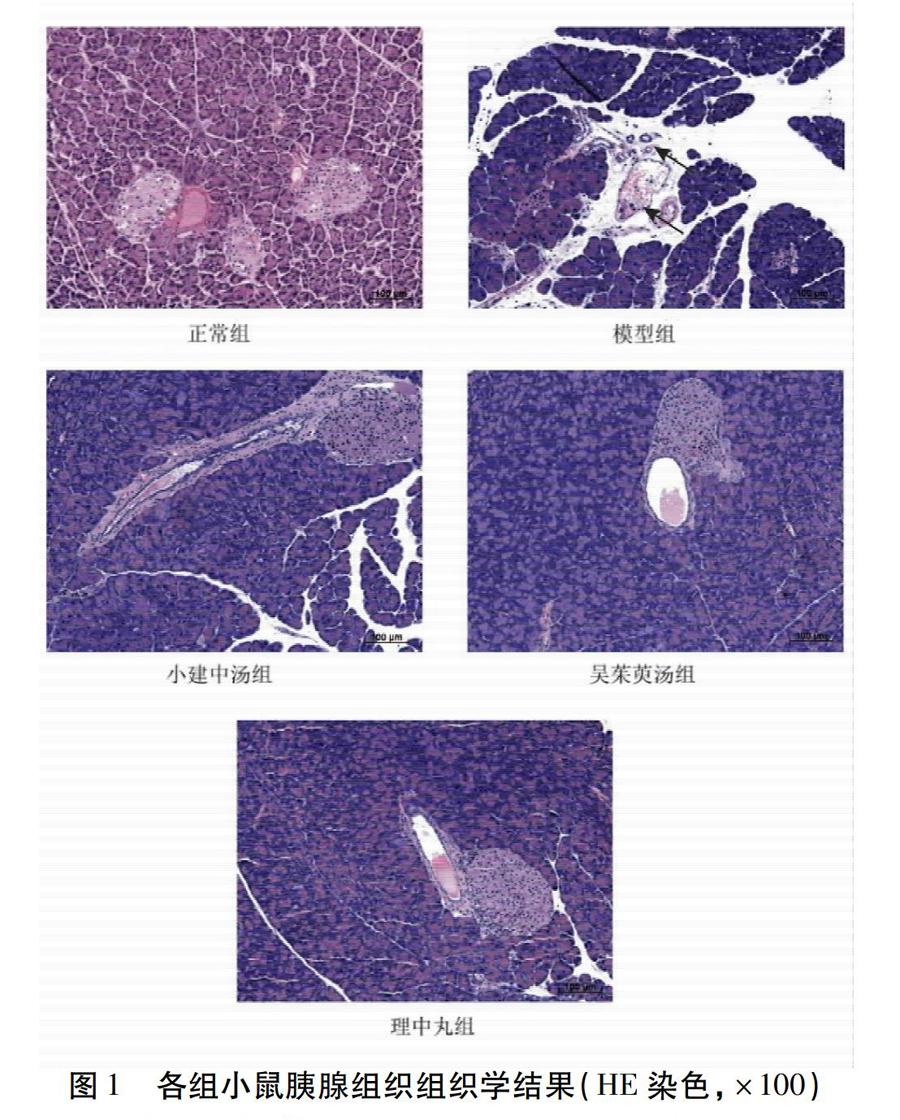
2.3 各组小鼠胰腺组织HE染色病理变化 正常组小鼠的胰腺组织中胰腺腺泡细胞完整,血管及导管未见炎性细胞等浸润,小叶间隔正常。模型组胰腺腺泡细胞较正常组比较,水肿、空泡化严重,血管周围红细胞和炎性细胞浸润、细胞间隙和小叶间隔扩大明显增多。与模型组比较,三方观察组明显改善胰腺腺泡细胞水肿程度及炎性细胞浸润程度。见图1。
2.4 各组小鼠胰腺组织中TRPV1、NK1R和CGRP蛋白表达免疫组织化学法结果比较
正常组小鼠胰腺腺泡之间散在分布TRPV1阳性表达。模型组的胰腺组织中TRPV1阳性表达较正常组比较明显增高;各观察组与模型组比较,胰腺腺泡间TRPV1阳性表达均明显下调。见图2。在正常组中,小鼠胰腺腺泡细胞散在分布少量的NK1R阳性表达量。与模型组比较,各观察组胰腺腺泡细胞内NK1R阳性表达下调。见图3。正常组小鼠胰腺腺泡和血管周围散在分布CGRP而模型组的胰腺组织中CGRP阳性表达明显增高。小建中汤、吴茱萸汤和理中丸治疗后,与模型组比较,胰腺腺泡和血管周围的CGRP阳性表达明显下调。见图4。
与正常组比较,模型组与各观察组小鼠胰腺组织中TRPV1、NK1R和CGRP阳性表达明显上调,差异有统计学意义(P<0.05)。与模型组比较,小建中汤、吴茱萸汤和理中丸观察组小鼠胰腺组织中TRPV1、NK1R和CGRP阳性表达均明显下调,差异有统计学意义(P<0.05)。见表3。
2.5 各组小鼠胰腺组织中TRPV1、NK1R和CGRP蛋白表达比较
TRPV1各组均在95 kDa处出现条带;NK1R各组均在46 kDa处出现条带;CGRP各组均在14 kDa处出现条带。见图5。
与正常组比较,模型组、吴茱萸汤组和理中丸组胰腺TRPV1蛋白表达明显升高,差异有统计学意义(P<0.05)模型组和理中丸组胰腺NK1R蛋白表达升高,差异有统计学意义(P<0.05),模型组胰腺CGRP蛋白表达明显升高,差异有统计学意义(P<0.05),各观察组胰腺CGRP蛋白表达降低,差异有统计学意义(P<0.05)。与模型组比较,各观察组给药后胰腺TRPV1、NK1R和CGRP蛋白表达均明显下降,差异有统计学意义(P<0.05)。见表4。
3 讨论
AP的病因和发病机制较为复杂,涉及胰蛋白酶学说、细胞损伤机制、胆道系统疾病、炎性反应递质和周围神经损伤等[12-14]。随着现代社会快节奏的发展,人们的生活水平不断提高,大量饮酒,暴饮暴食等不健康、不规律的饮食生活习惯越来越多,使得该病的发病率逐年增加,治疗越来越棘手,因此,迫切需要更深入地了解和研究AP的病理机制成为开发相应治疗药物的重要基础。
热敏通道TRPV1一种非选择性阳离子通道,自1997年发现至今,研究其在介导炎性反应和疼痛病理机制中发挥重要作用,并且作为相关疾病治疗的分子靶点[15-16]。近期研究发现,TRPV1可以在胰腺腺泡之间的神经束和纤维中检测到[17]。TRPV1通道的激活及后续SP和CGRP在脊髓和外周的释放量增加可能是介导急性胰腺炎炎性反应和胰腺疼痛的主要作用机制[18]。
SP和CGRP是分布在初级感觉神经元无髓鞘神经元的2个亚群C和Aδ纤维的2种神经递质。CRRP阳性表达分布在整个胰腺组织包括(胰岛和腺泡细胞),特别是腺泡和血管周围的神经纤维处。SP和CGRP在神经末梢的释放具有促炎作用,可与内皮细胞、小动脉、肥大细胞和其他免疫细胞相互作用,从而诱导血管扩张、水肿和炎性细胞浸润等神经源性炎性反应[19]。在胰腺中含SP的神经元较丰富,SP在外周释放并与内皮细胞和上皮细胞上的NK1R结合而发挥相应作用[20]。NK1R受体位于细胞膜上,当SP与其结合后将陷入细胞内开始细胞内吞作用;而SP降解后,NK1R受体又将重新回到细胞膜表面。雨蛙素造模后,NK1R因内吞作用而显示胰腺腺泡细胞核深染,细胞内NK1R阳性表达明显增多。给予速激肽SP与NK1R结合在急性胰腺炎模型小鼠实验中可诱导高淀粉酶血症和血浆外渗、水肿和中性粒细胞浸润等急性胰腺炎早期炎性反应[21]。NK1R药理学拮抗剂阻断了此作用,同样NK1R遗传缺失减少了小鼠胰腺组织中雨蛙素诱导的血浆外渗和严重程度[22]。以上研究证实SP和CGRP释放增加参与了急性胰腺炎炎性反应病理过程。而SP和CGRP的释放往往受TRPV1的调控,在相关实验中,重复使用雨蛙素能够激活TRPV1通道,导致SP、CGRP释放,而它们的大量释放反过来放大炎性联级反应,进一步加重胰腺炎炎性反应[9]。而使用TRPV1拮抗剂辣椒平可以阻断上述病理过程,减少SP和CGRP的释放,降低了雨蛙素诱导的MPO水平的升高和胰腺炎炎性反应组织病理学严重程度等,以减轻胰腺炎炎性反应[23]。重复注射雨蛙素诱导的实验性急性胰腺炎以血清淀粉酶升高、髓过氧化物酶活性增加以及组织病理学变化(胰腺水肿、中性粒细胞浸润和坏死)作为急性胰腺炎特征性标志。本研究采用此造模方法,结果显示模型组小鼠AMY水平、MPO活性显著升高,小鼠胰腺組织胰腺腺泡细胞水肿、空泡化严重程度,血管周围红细胞和炎性细胞浸润均明显增多。同时,TRPV1、NK1R和CGRP蛋白表达在模型组中均明显上调,与上述文献中报道的结果一致。
小建中湯、吴茱萸汤和理中丸三方中的药物包含着多种TRPV1激动剂或拮抗剂,对TRPV1有调控作用。在前期研究中,采用全细胞膜片钳技术测试了吴茱萸碱、10-姜酚、6-姜脑、姜酮和吴茱萸次碱等有效标志成分,进一步证明了其对TRPV1产生的激活效应[24]。本研究结果显示,小建中汤、吴茱萸汤和理中丸三方与模型组比较,均能够有效降低小鼠AMY水平、MPO水平,改善小鼠胰腺组织病理炎性反应程度,下调TRPV1、NK1R和CGRP蛋白的表达。提示三方均可减轻小鼠急性胰腺炎炎性反应,可能的机制与其下调TRPV1而减少SP和CGRP的释放有关。
急性胰腺炎的患者大多以腹痛为就诊原因,严重者发展为急腹征。急性胰腺炎疼痛和躯体疼痛不同,它属于内脏痛,是源于胸腔或腹腔内脏器官发生疼痛的表现。内脏痛分为炎性内脏痛、癌性内脏痛和功能性内脏痛等不同类型,而急性胰腺炎疼痛属于炎性内脏痛的范畴,多表现为患者疼痛定位不精确。目前,西医解痉止痛多采用杜冷丁和阿托品联合治疗,但不良反应等明显。中医药在治疗中焦病症方面疗效突出,尤其是改善患者疼痛症状方面有其特有的优势。小建中汤、吴茱萸汤和理中丸在治疗胆囊炎、痛经、功能性内脏痛等临床常见病症颇有疗效。
TRPV1介导SP和CGRP在中枢和外周的释放不仅引起神经源性炎性反应而且介导着胰腺疼痛,阻断这种神经源性炎性反应疼痛行为出现明显减轻的趋势[25]。伤害性感受器有预警作用,当它感受到刺激性伤害时,会以另外一种信号(如疼痛)向中枢传递信息,然后产生相应的行为来避免伤害。目前,龋齿动物疼痛研究主要依靠行为学方法,模型动物身上会出现特异性疼痛行为,比如舔爪、挠痒、拉伸、退缩等。既往胰腺疼痛相关实验中,用L-精氨酸诱导大鼠坏死性胰腺炎发现大鼠腹部疼痛收缩明显增多,在鞘内注射SP拮抗剂和CGRP拮抗剂后明显减轻了疼痛等伤害性感受的传递,提示SP和CGRP的释放参与了胰腺疼痛,用TRPV1激动剂辣椒素注射到胰管中可使NK1R内吞作用增加(提示SP释放增多),而在同一实验中,通过全身给药辣椒平能够使大鼠腹部疼痛收缩显著降低[12]。因此,拮抗或降低TRPV1受体表达能够减少SP和CGRP的释放量而发挥止痛作用。本实验采用热板实验评估小鼠疼痛行为反应,本研究结果显示三方较模型组比较均使小鼠疼痛行为第1次出现时间延迟,三方较模型组比较明显降低TRPV1、NK1R和CGRP在蛋白层面的表达。
热敏通道TRPV1有致敏和脱敏双重现象,即激动剂可以激活该通道,又可使该通道脱敏,这种作用以剂量依赖方式产生。热敏通道TRPV1作为伤害性感受器负责伤害性刺激的传入,三方减轻炎性反应和发挥止痛效应可能是通过下调TRPV1受体及减少SP和CGRP的释放这一作用来减轻炎性反应和疼痛等伤害感受的感知和传递的。可能涉及2种机制,一是使TRPV1通道脱敏,即伴随时间和浓度的增加,通道由活化状态反转为失活状态;二是对TRPV1通道的抑制作用。TRPA1是寒痛通道,分布的部位与TRPV1大体相似,TRPV1和TRPA1在痛觉感觉神经通路中可相互影响而产生疼痛积分效应[26]。在急性胰腺炎相关研究中证实给予TRPV1和TRPA1拮抗剂联合运用可减轻雨蛙素诱导的胰腺炎炎性反应和疼痛,两者具有协同作用[27]。小建中汤中主要药物桂枝的有效成分桂皮醛是TRPA1的激动剂[28],生姜的有效成分6-姜酚、姜脑等是TRPV1的激动剂[11],那么有一种可能性不能排除,即小建中汤对急性胰腺的消炎、止痛效果,可能是其作用于TRPV1和TRPA1产生的协同作用。
综上所述,小建中汤、吴茱萸汤和理中丸三方可明显减轻雨蛙素诱导的小鼠急性胰腺炎炎性反应和延迟胰腺疼痛出现时间,其可能的作用机制是下调TRPV1(脱敏或抑制TRPV1通道),减少SP和CGRP的释放而实现的。这为三方临床上用于AP的治疗提供了一定理论依据。
参考文献
[1]Yan L,Li QF,Rong YT,et al.The protective effects of rutaecarpine on acute pancreatitis[J].Oncol Lett,2018,15(3):3121-3126.
[2]程竑.汉方药治疗慢性胰腺炎[J].国外医学:中医中药分册,1998,20(4):26-28.
[3]郭蓉.基于热敏通道TRPV1的小建中汤、吴茱萸汤和理中丸对小鼠急性胰腺炎的作用研究[D].北京:北京中医药大学,2019.
[4]张梅梅,王忠敏,牛健华,等.中医治疗亚急性和慢性胆囊炎50例[J].世界中医药,2008,3(5):289.
[5]王洪杰,吕冠华.吴茱萸汤临床应用[J].中医药临床杂志,2016,28(9):1252-1254.
[6]戴云飞,严子兴,林晓英,等.布拉氏酵母菌联合小建中汤治疗脾胃虚寒型慢性结肠炎的临床观察[J].光明中医,2018,33(4):553-554.
[7]赵一粒,韩玲,付建楠.小建中汤合理中丸加减治疗小儿脾胃虚寒性腹痛68例疗效观察[J].国医论坛,2015,30(6):36.
[8]吴言斌.小建中汤治疗功能性腹痛1例[J].中国民间疗法,2017,25(11):55.
[9]Liddle RA.The role of Transient Receptor Potential Vanilloid 1(TRPV1)channels in pancreatitis[J].Biochim Biophys Acta,2007,1772(8):869-878.
[10]Deuis JR,Dvorakova LS,Vetter I.Methods Used to Evaluate Pain Behaviors in Rodents[J].Front Mol Neurosci,2017,10:284.
[11]刘珍洪.基于热敏通道TRPV1、TRPA1探讨吴茱萸汤的散寒止痛机理[D].北京:北京中医药大学,2017.
[12]郭志国,辛毅.急性胰腺炎发病机制研究新观点[J].中国全科医学,2018,21(20):2400-2403.
[13]冯小萌,王原.急性胰腺炎发病机制及治疗研究进展[J].世界最新医学信息文摘,2017,17(40):26-30.
[14]卓玉珍,崔立华,李彩霞,等.中药复方治疗急性胰腺炎作用机制研究进展[J].中国中西医结合外科杂志,2019,25(3):394-398.
[15]Caterina MJ,Schumacher MA,Tominaga M,et al.The capsaicin receptor:a heat-activated ion channel in the pain pathway[J].Nature,1997,389(6653):816-824.
[16]劉珍洪,高琳,汪文来,等.基于热敏通道TRPV1探讨吴茱萸汤对醋酸内脏痛模型小鼠的止痛作用[J].成都中医药大学学报,2017,40(3):1-3,16.
[17]Wick EC,Hoge SG,Grahn SW,et al.Transient receptor potential vanilloid 1,calcitonin gene-related peptide,and substance P mediate nociception in acute pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2006,290(5):G959-969.
[18]Laing RJ,Dhaka A.ThermoTRPs and Pain[J].Neuroscientist,2016,22(2):171-187.
[19]Andreev YA,Kozlov SA,Korolkova YV,et al.Polypeptide modulators of TRPV1 produce analgesia without hyperthermia[J].Mar Drugs,2013,11(12):5100-5115.
[20]杨桢,高琳,赵红霞,等.热敏通道理论与理中丸的温中散寒机制[J].中医药信息,2014,31(6):33-35.
[21]Nathan JD,Patel AA,McVey DC,et al.Capsaicin vanilloid receptor-1 mediates substance P release in experimental pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2001,281(5):G1322-1328.
[22]Pernow B.Substance P:its distribution,pharmacological actions and possible physiological role in sensory neurons[J].Clin Physiol,1981,1(3):235-251.
[23]Bowden JJ,Garland AM,Baluk P,et al.Direct observation of substance P-induced internalization of neurokinin 1(NK1)receptors at sites of inflammation[J].Proc Natl Acad Sci U S A,1994,91(19):8964-8968.
[24]Grady EF,Yoshimi SK,Maa J,et al.Substance P mediates inflammatory oedema in acute pancreatitis via activation of the neurokinin-1 receptor in rats and mice[J].Br J Pharmacol,2000,130(3):505-512.
[25]Figini M,Emanueli C,Grady EF,et al.Substance P and bradykinin stimulate plasma extravasation in the mouse gastrointestinal tract and pancreas[J].Am J Physiol,1997,272(4 Pt 1):G785-793.
[26]Bhatia M,Saluja AK,Hofbauer B,et al.Role of substance P and the neurokinin 1 receptor in acute pancreatitis and pancreatitis-associated lung injury[J].Proc Natl Acad Sci U S A,1998,95(8):4760-4765.
[27]Hutter MM,Wick EC,Day AL,et al.Transient receptor potential vanilloid(TRPV-1)promotes neurogenic inflammation in the pancreas via activation of the neurokinin-1 receptor(NK-1R[J].Pancreas,2005,30(3):260-265.
[28]Pearce LV,Petukhov PA,Szabo T,et al.Evodiamine functions as an agonist for the vanilloid receptor TRPV1[J].Org Biomol Chem,2004,2(16):2281-2286.
(2019-07-26收稿 责任编辑:杨觉雄)
基金项目:国家自然科学基金面上项目(81573847)作者简介:郭蓉(1993.01—),女,硕士研究生在读,研究方向:方剂作用机制、中医四气五味学,E-mail:gr1113215159@163.com通信作者:杨桢(1964.10—),男,博士,教授;研究方向:中医四气五味学,E-mail:yangz@bucm.com.cn;刘珍洪(1990.06—),女,博士研究生在读,研究方向:中医四气五味学,E-mail:lzhh0399@163.com

