基于TP0136蛋白异质性建立一种新的苍白密螺旋体分子分型方法
魏然 柯吴坚 陈文韬 谭玲俏 刘雅慧 吕萍 黄涛张君 张晓辉 王柳苑 车雅敏
1天津医科大学总医院皮肤性病科300052;2南方医科大学皮肤病医院皮肤二科,广州510091;3阳江市公共卫生医院皮肤性病科,广东529500;4清远市慢性病防治医院皮肤性病科,广东511500
密螺旋体属(Treponema pallidum,TP)包括雅司苍白密螺旋体(Treponema pallidum ssp.Pertenue,TPE)、未分类的类人猿密螺旋体(Fribourg-Blanc,FB)、地 方 密 螺 旋 体(Treponema pallidum ssp.endemicum,TEN)、梅毒苍白密螺旋体(Treponema pallidum ssp. Pallidum,TPA)等。雅司病的病原体TPE、地方性梅毒的病原体TEN 与FB 的基因组具有高度亲缘性,且雅司病的临床症状与血清学检测特征难以和梅毒区分[1-2]。因此寻找一种合适的TP分型方法,对TP 的分子流行病学研究和临床防治十分关键。
既往研究显示,TPA基因亚型与毒力、耐药性、病期的发展转归等具有密切关系[3]。现有的TPA酸性重复蛋白(acidic repeat protein,Arp)/重复基因(T.pallidum repeat gene,Tpr)双基因分型方法[4]和Arp/Tpr/TP0548 三基因联合分型法[3]具有结果稳定、重复性好的特点,适用于多种来源的临床样本,目前被普遍采用。然而,我国高达88%的TPA株为14D/f 亚型,无法得到进一步区分,因此现有的双/三基因分型方法均不适用于我国梅毒流行株的研究[1,3,5]。近年来研究者对多个可变位点进行分析,试图选取TP0279、TP0558 、TP0326 等新的基因位点用于临床鉴别,但分型效率均不理想[5-6]。我们前期研究发现,在TP 不同菌种和TPA 不同菌株中TP0136存在基因异质性[7]。利用这一特点,我们通过研究TP0136蛋白在TPA、TPE、FB和TEN 各种之间的异质性,建立一种新的TP分子分型方法。
材料与方法
1.主要试剂与仪器:梅毒螺旋体明胶凝集试验(TPPA)试剂盒(日本富士瑞必欧株式会社),甲苯胺红不加热血清试验(TRUST)试剂盒(上海荣盛生物技术有限公司),QIAamp DNA Mini 试剂盒(德国Qiagen公司),T100PCR仪(美国Bio-Rad公司)。
2.标本收集及DNA提取:2015年1月至2018年12月在广东省南方医科大学皮肤病医院性病门诊收集23 例梅毒患者。所有患者TRUST 和TPPA 血清检测结果均为阳性。根据梅毒分期,采集受试者1 ~3 种标本:①抽取静脉血2 ml,置于促凝管内;②行腰椎穿刺术收集1 ml脑脊液于无菌管中;③用生理氯化钠溶液清洗硬下疳表面,以钝刀轻轻刮取受试者皮损表面并挤压以收集渗出液。将23例的临床样本以GD001-GD023编号。将0.5 ml血液、脑脊液或硬下疳渗出液与0.5 ml 2×细胞裂解液缓冲液(20 mmol/L Tris-HCl,0.2 mol/L 乙二胺四乙酸,1%十二烷基硫酸钠)充分混匀,应用QIAamp DNA Mini 试剂盒(德国Qiagen 公司)严格按照说明书提取23例患者的DNA,冻存于-20 ℃。本研究已取得广东省南方医科大学皮肤病医院医学伦理委员会批准,所有患者均签署知情同意书。
3. TP0136 序列分析和引物设计:从GenBank中查询TP0136 氨基酸和核酸序列,对9 株TPA(Nichols Houston、Nichols Seattle、Nichols Dallas、DAl-1、Bal73-1、Seattle81-4、Chicago、MexicoA 和SS14)、3 株TPE(Samoa D、CDC2 和Gauthier)、1 株FB 和1 株TEN(Bosnia A)进行氨基酸序列多重比对,采用BioEdit 7.1 软件分析。应用Primer Premier 5.0 软件设计TP0136 开放阅读框(ORF)引物。假定的裂解信号肽位于分泌蛋白的N端,一般由15 ~30 个氨基酸组成,在信号肽越膜进入膜外时可被信号肽酶水解,因此ORF 应不含信号肽。用SignalP 4.1 Server 软件预测TP0136 信号肽,TP0136 的ORF 引物不含信号肽。由于TP0136 蛋白羧基端存在差异,本研究共设计两对不同引物以对应菌株TP0136 蛋白的不同羧基端编码序列。Tp0136基因第1对引物:正向5′-ATGACGTGCGAT TTCACTGG-3′,反向5′-CTC GCGGTTCCAGGAGCA CG-3′,扩增产物大小为1 389 bp,目的菌株为Nichols Houston、Bal73-1、Seattle81-4、Chicago、MexicoA SS14;第2 对引物:正向5′-ATGACGTGCG ATTTCACTGG-3′,反向5′-ACTACGTAGATTTTCTG CAC-3′,扩增产物大小为1 260 bp,目的菌株为Nichols Seattle、DAl-1、Nichols Dallas。
4.PCR 扩增TP0136 基因:常规PCR 扩增23 株临床分离株TP0136 基因。50 μl PCR 反应体系含5 μl 待测DNA 样本、4 μl 200 μmol/L dNTPs、5 μl 10×Go Taq PCR 缓冲液(美国Promega 公司)、3 μl 1.5 mmol/L MgCl2、3 μl 0.6 μmol/L TP0136 引物、0.5 μl 热启动Taq PCR 聚合酶(美国Promega 公司)等。扩增条件:95 ℃预变性10 min;95 ℃变性1 min、60 ℃退火2 min、72 ℃延伸1 min,共45 个循环;最后72 ℃延伸10 min。扩增PCR 产物经15 g/L 琼脂糖凝胶电泳鉴定。PCR 扩增产物经ExoSAP-IT PCR产物纯化试剂盒(美国Affymetrix公司)纯化回收处理后,应用双向DNA 测序法[生工生物工程(上海)股份有限公司]对23 株TPA 的ORF 进行测序。
5.TPA 三基因联合分型法:将TPA Arp 基因重复序列的数目、Tpr 经MseⅠ酶切后限制性片段长度多态性的型别和TP0548基因序列的型别进行联合,建立以Arp/Tpr/TP0548为核心的三基因分型方法。参考文献[8]通过PCR 扩增TPA 菌株Arp 基因、Tpr基因、TP0548基因,使用凝胶电泳分析软件分析Arp 基因60 个碱基对的重复序列数目,并与含有14 个重复序列的Nichols 标准株进行比较,将菌株分为“2 ~22”型别;将TprⅡ基因经MseⅠ酶切后进行限制性片段长度多态性分析,与文献[9]报道的“A ~P”型别进行比较;纯化后的TP0548 基因PCR 产物经生工生物工程(上海)股份有限公司测序后,将测序结果用BioEdit7.1 软件与“a ~i”型别进行比较[3-4]。
结 果
1.14株TP TP0136序列分析结果:见表1、图1。多重序列比对结果显示,14株TP的TP0136氨基酸编码序列存在大量基因插入、缺失等情况,表明TP0136存在高度异质性。以序列中至少出现一个氨基酸差异作为分型标准对这些TP株分型,其中,3 株TPE 的TP0136 氨基酸序列各不相同,分为3 型,以Ⅰ~Ⅲ型别表示;TEN(Bosnia A)可与TPE、TPA 显著区分,以Ⅳ型表示;9 株引起人类性病的TPA 分为6 型,以Ⅴ~Ⅹ型别表示。除TPE 中的CDC2 和FB 无法完全区分外,其他TPE 和FB 菌株均可区分。从第100 位氨基酸起,Ⅰ~Ⅲ型差异明显,Samoa D株在第108位是异亮氨酸,而CDC2、FB和Gauthier 株是丝氨酸;Gauthier 株在第166 位与CDC2株、FB株相比缺少丝氨酸。TPA中的Ⅴ型较Ⅵ型菌株缺少1 组重复序列;Dal-1 和Nichols Seattle 株的TP0136 氨基酸序列完全一致,分为Ⅵ型;Nichols Houston、Chicago 和Bal73-1 株 的TP0136 氨基酸序列完全一致,分为Ⅶ型;其他3 株(Seattle 81-4、SS14、MexicoA)的TP0136 氨基酸序列各不相同,以Ⅷ~Ⅹ型别表示。

表1 14株密螺旋体分型情况
2. 23 株TPA 菌 株TP0136 ORF 氨基酸序列分析结果:BioEdit 7.1 软件比对显示,23 株TPA TP0136 ORF 氨 基 酸 序 列 可 分 为4 型,GD008 的TP0136 ORF 序列不同于Ⅰ~Ⅹ型,与Ⅶ型有1个氨基酸序列不同(G370D),记为Ⅺ型,见表2。
3.TP0136 分型与传统TP 分型部分结果比较:根据Arp/Tpr/TP0548 三基因分型法可将23 株TPA分为5型,菌株优势型为14D/f(39.1%,9/23)。若将新的分型方法与传统分型相结合,23 株TPA 可分为10 型,其中9 株传统的14D/f 亚型可进一步分为3型。见表2、图2。
讨 论

图1 14 株密螺旋体的TP0136 蛋白多重氨基酸序列比对图 I ~X 表示TP0136 蛋白氨基酸的10种不同序列型别

表2 23株梅毒螺旋体临床株分型情况
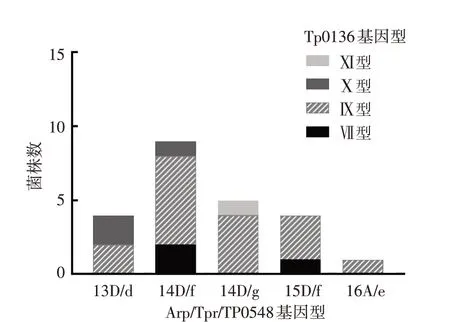
图2 23株梅毒螺旋体临床株的Tp0136基因型别分布
随着基因组数据的不断累积,全基因组DNA指纹图谱技术揭示TP各亚种基因组之间具有高度相似性,这使通过分子靶点在分子水平上对TP 不同亚种进行区分成为可能。在众多TP 候选靶点中,TP0136 ORF区在不同TP亚型和菌株之间表现出高度多态性,成为当前研究的热点。这促使我们对9 株TPA、3 株TPE、1 株FB 和1 株TEN 的TP0136ORF 氨基酸序列进行多重比对分析。我们发现,TP0136 基因可显著区分TP 中除TPE(CDC2株)和FB 以外的4 个种(TPA、TPE、FB、TEN),表明TP0136 异质性可用于不同致病性螺旋体的分子分型。
我国TPA 新发感染率连续数年居甲乙类传染病第三位,且逐年上升,已成为不容忽视的公共卫生问题[10]。1998 年,美国疾病控制和预防中心建立了基于Arp和Tpr序列差异的首个TPA双基因分型方法[4],Marra等[3]在此基础上引入TP0548基因,提出具有更强区分能力的CDC 亚型/TP0548 三基因联合分型法。流行病学调查显示,梅毒在各地区的优势流行株具有一定的分布特征。近年多项研究表明[11-12],中国大陆多个地区流行的梅毒优势亚型14D/f 在TPA 感染者中占比可高达66% ~88.8%。Marra等[3]对西雅图地区TPA分型后发现,14D/f亚型与神经梅毒有着紧密联系。然而在我国所有14D/f 亚型感染者中,仅4.5%最终确诊为神经梅毒[11]。现有TPA 分型方法无法区分我国近90%梅毒感染者中TPA分子型别,无法准确用于我国梅毒分子流行病学研究及临床评估,因此迫切需要一种更有效的TPA分子分型方法。
本研究中,我们利用建立的TP0136 蛋白分子分型方法,将23株TPA临床分离株分为4种序列类型。而根据传统的三基因分型法可分为5 型,将TP0136 分型方法与传统分型相结合后可分为10 型,优势菌株14D/f 亚型可被进一步分为3 型。其中,TP0136 序列Ⅺ型是在广东地区TPA 临床分离株中新发现的特有型别,仅与Ⅶ型在第370位氨基酸存在差异(G370D)。在23 株TPA 临床分离株中,69.6%(16/23)为Ⅸ型,即SS14 型。该基因型可能与大环内酯类抗生素耐药密切相关[13]。Stamm等[14]发现阿奇霉素耐药表型的SS14 株TPA 23S rRNA基因在第2058位点发生腺嘌呤(A)→鸟嘌呤(G)突变,且该型菌株在多次传代后均表现出稳定的大环内酯类抗生素耐药表型。我国指南建议[15]临床采用阿奇霉素、红霉素等大环内酯类抗生素治疗青霉素过敏的母婴梅毒患者,而TPA对大环内酯类抗生素的耐药现象将影响TPA治疗的有效性,增加先天梅毒儿的出现。因此,通过将TP0136 分型方法与传统分型相结合,不仅可用于进一步细化TPA分型,或许还具有指导临床用药的作用。
综上,TP0136 蛋白异质性可用于鉴别TP 的TPA、TPE、FB 和TEN 亚种,TP0136 分子分型将有助于进一步完善TPA分型方法,为探究基因型别与临床诊断、发展转归及耐药监测提供帮助。
利益冲突所有作者均声明不存在利益冲突

