中文版荨麻疹控制评分量表及信效度验证
于淼 陈玉迪 刘擘 宋晓婷 赵作涛
1北京大学护理学院100191;2北京大学第一医院皮肤性病科 国家皮肤与免疫疾病临床医学研究中心 皮肤病分子诊断北京市重点实验室100034
慢性荨麻疹(chronic urticaria,CU)主要表现为皮肤风团和/或血管性水肿,病程超过6 周,皮疹反复发作且常伴剧烈瘙痒,严重影响患者的生活质量[1]。目前,尚无特异性生物标志物用于反映CU患者的疾病控制情况[2]。临床研究多采用患者报告结局评分评估疗效,其中,荨麻疹控制评分(Urticaria Control Test,UCT)使用最为广泛,在多项国外研究中显示出良好的信效度[3-6],而我国目前尚无使用UCT 评估的相关研究。因此,我们引进UCT 量表,将其汉化并进行信效度检验,以便在我国进一步应用和推广,从而建立与国际接轨的CU评价体系,促进临床患者管理规范化。
资料与方法
一、量表的翻译、回译及文化调适
获 得 原 量 表 作 者(Karsten Weller,karsten.weller@charite.de)的授权后,采用Brislin 两人直译(原版德语问卷译为中文)-回译(翻译后的中文问卷译为德语)原则转化量表[3],直译过程中进行文化调适,即遵循中文习惯法翻译。将UCT回译版发送至量表原作者审核;并选取10例CU患者进行预调查。结合原作者的建议和预调查中的问题进行修订,最终形成中文版UCT 量表,保留原量表的所有条目及评分方法,具体条目见表1。
二、研究对象及方法
随机选取2019 年8 月至2020 年1 月于北京大学第一医院皮肤科确诊的CU患者。根据样本量为条目数5~10倍的原则,计划纳入40 ~50例慢性自发性荨麻疹(chronic spontaneous urticaria,CSU)病例,及40 ~50 例慢性诱导性荨麻疹(chronic inducible urticaria,CIndU)病例。纳入标准:符合CSU或/和CIndU诊断标准的患者[1]。排除标准:①合并其他皮肤疾病,如泛发性湿疹、中重度特应性皮炎等;②合并严重心脑血管疾病等导致身体状态极差或合并严重精神心理疾病;③因知识、文化水平不足无法阅读量表。本研究经过中国注册临床试验伦理委员会批准(ChiECRCT20190290),患者均签署知情同意书。

表1 中文版荨麻疹控制评分(UCT)量表条目及评分方法
记录患者的临床诊断,指导患者评估入组前4 周内疾病情况,并填写中文版UCT、中文版皮肤病生活质量指数(dermatology life quality index,DLQI)量表。同时向仅患CSU 的患者及CSU 伴CIndU 的患者发放荨麻疹活动评分(urticaria activity score,UAS)量表,告知患者填写规则。入组时,47例(45.6%)患者未用药治疗,45(43.7%)例使用抗组胺药治疗,11例(10.7%)使用奥马珠单抗治疗。在入组后第4、8周时进行第1、2次随访,同时回收入组时填写完成的UAS量表,同时指导患者再次填写中文版UCT、中文版DLQI,发放新的UAS量表。
三、评定量表
1.UCT:采用患者自评的方式对过去4 周内疾病的临床症状和体征、对生活质量的影响、治疗效果和总体疾病控制情况进行回顾性评价[3]。共包含4个条目,每个条目0~4 分,总分为4 个条目得分之和,总分越低提示患者的疾病控制情况越差。见表1。
2.DLQI:包含10个问题,用以回顾性评价过去1 周内皮肤疾病相关生活质量[6],各问题得分相加即为患者的DLQI总分,得分越高,患者的生活质量越差。
3.UAS:衡量CSU疾病活动情况的金标准。该量表要求患者每日1 次记录风团的数目和瘙痒严重程度。风团评分和瘙痒评分相加即为当日UAS评 分[7]。连 续 记 录28 d 的UAS 评 分 之 和 即 为UAS28,得分越高,患者的疾病活动度越高。将UAS28 得分≤10 分、11 ~35 分、36 ~70 分、71 ~105分和≥106分的患者分别分类为“无活动”、“轻度活动”、“中度活动”、“重度活动”、“非常重度活动”[3]。
四、统计分析
采用SPSS24.0 软件对数据进行统计分析。正态分布的计数资料采用±s表示,两组间比较采用配对t 检验;不符合正态分布的计数资料采用M(P25,P75)表示,两组间比较采用配对样本Wilcoxon 符号秩和检验或Mann-Whitney U 检验。采用Cronbach′s α 系数评定量表的内部一致性,系数>0.8表示内部一致性极好,0.6 ~0.8表示内部一致性较好,<0.6 表示内部一致性差[8]。采用Spearman 相关系数分析中文版UCT 与DLQI、UAS28 的相关性(聚合效度),并分析患者中文版UCT、UAS28、DLQI 变化量相关性(敏感性)。采用单因素方差分析比较不同疾病活动度CSU 患者和不同生活质量损害的CIndU患者UCT评分(已知族群效度),若方差齐,事后多重比较选用LSD 法;若方差不齐,事后多重比较选用Tamhane′s T2法。将UAS28 得分≤10 分归类为“控制良好”(赋值为1),>10 分归类为“控制不佳”(赋值为0),利用受试者工作特征曲线(ROC)及ROC 曲线下面积确定“荨麻疹控制良好”的分界值。
结 果
一、一般资料
共纳入112 例CU 患者,其中103 例(92.0%)各次随访问卷资料完整,进入最终分析。患者年龄16 ~84(36.87±14.70)岁,女68 例(66.0%)。单纯CSU 51 例(49.5%),单纯CIndU 41 例(39.8%),CSU合并CIndU 11例(10.7%)。
随访期间,根据患者各问卷评分调整治疗方案,最终81例(78.6%)患者使用抗组胺药治疗,8例(7.8%)使用奥马珠单抗治疗,14例(13.6%)联合抗组胺药和奥马珠单抗治疗。CSU 组与CIndU 组的基线UCT(Z=-0.433,P=0.665)和DLQI 评分(Z=-0.232,P=0.816)差异均无统计学意义。
第1、2 次随访时CSU 组的UAS28(62 例)评分[M(P25,P75)]分别为21.0(10.0,72.0)分、14.0(0.0,51.0)分,两次评分差异有统计学意义(Z=-5.938,P<0.001);其他问卷得分较基线均显著下降(P<0.001),见表2。
二、内部一致性信度
中文版UCT 评分工具对CSU 组和CIndU 组均显示出极强的内在一致性。基线、第1、2次随访时CSU组UCT问卷各条目得分的Cronbach′s α系数分别为0.886、0.940 和0.945,CIndU 组分别为0.834、0.864和0.958。
三、效度
1. 聚合效度:对于所有患者,在基线和第1、2次随访时UCT评分与DLQI评分均显著相关(rs值分别为-0.633、-0.808、-0.798,均P<0.001)。CSU组UCT 评分与UAS 评分在第1、2 次随访时显著相关(rs值分别为-0.654、-0.717,均P<0.001),与DLQI 评分在基线、第1 次随访、第2 次随访时亦显著相关(rs值分别为-0.672、-0.829、-0.765,均P<0.001)。CIndU 组UCT 评分与DLQI 评分在基线和第1、2 次随访时亦显著相关(rs值分别 为-0.578、-0.778、-0.834,均P<0.001)。

表2 慢性荨麻疹患者不同时间皮肤病生活质量指数(DLQI)与中文版荨麻疹控制评分(UCT)评估结果[分,M(P25,P75)]
2. 已知族群效度:见表3。对于CSU 和CIndU 组,第1、2 次随访时中文版UCT 显示出相似的已知族群有效性。将CU 患者依据UAS(62 例)、DLQI(103 例)评分分组后对UCT 评分进行方差齐性检验,结果显示方差不齐(P<0.05),因此用Tamhane′s T2法进行事后多重比较。不同UAS 评分组间的UCT评分在第1、2 次随访时差异均有统计学意义(均P<0.05)。不同DLQI 评分组间CSU 和CIndU 患者第1、2 次随访时UCT 评分差异均有统计学意义(均P<0.05)。
四、敏感性
中文版UCT 对于评估疾病活动度的变化和生活质量变化具有一定的敏感性。CSU组在第1、2 次随访间的UCT 变化量与UAS 变化量显著相关(rs=-0.569,P<0.01);与基线相比,第1、2次随访时UCT 变化量与相应的DLQI 评分变化量显 著 相 关(rs值 分 别 为-0.693、-0.447,均P<0.01)。与基线相比,CIndU 组第1、2次随访时UCT变化量与DLQI 变化量亦显著相关(rs值分别为-0.615、-0.408,均P<0.01)。
五、筛选准确性
在第2 次随访时的31 例UAS28<10 分(无活动)的患者中进行准确性分析。31 例CSU 或CSU伴CIndU 患者的ROC 曲线下面积显示为0.777,表明中文版UCT 筛选疾病控制良好的CSU 或CSU 伴CIndU患者的准确性较好(图1),分界值为12分。
表3 中文版荨麻疹控制评分的已知族群效度检验结果
讨 论
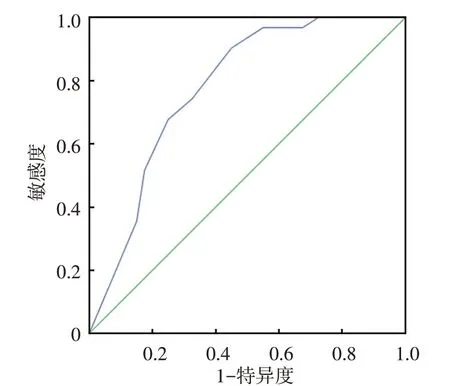
图1 中文版荨麻疹控制评分(UCT)的受试者工作特征曲线(ROC曲线) 在荨麻疹活动度评分<10分的伴或不伴慢性诱导性荨麻疹的31 例慢性自发性荨麻疹患者中进行筛选准确性检验,曲线下面积为0.777,“疾病控制良好”的中文版UCT 的分界值为12 分。蓝线为ROC曲线,绿线为无效线
由于CU患者临床症状和体征的发生常难以预期且具有明显的波动性,即使患者拍摄相关照片也不能充分、全面地反映其近期实际的疾病情况。目前尚缺乏敏感度高、检测方便的免疫学标志物,对患者病情和药物疗效的判断缺乏统一规范[2]。因此,中国荨麻疹诊疗指南推荐使用UCT作为各亚型CU 患者疾病控制情况的评估工具[1,9]。我们将英文版UCT 进行翻译,在我国CU 患者中进行信、效度验证,并对量表的敏感性及筛选控制不佳患者能力进行检测。中文版UCT包含4项简单的问题,可回顾性评价过去4周内疾病的临床症状和体征、对生活质量的影响、治疗效果和总体疾病控制情况,验证结果显示,其信效度指标均在可接受范围内,对病情变化具有一定的敏感性,能够协助医生识别疾病控制不佳的患者,及时调整治疗方案。
本研究选用内在一致性检验各条目之间的内在相关性,即量表各条目反映同一方面问题的一致程度。本研究中,CSU 与CIndU 患者每次随访时UCT评分的Cronbach′s α系数均在0.8以上,说明整个量表内部一致性极好,4个条目能够同时反映疾病控制情况。该结果与德文版量表的Cronbach′s α系数相似(CSU患者0.84,CIndU患者0.89)[3]。
聚合效度是指用不同测量方法测定同一特征,反映测量结果的相似程度。由于UCT是正向计分,即UCT 评分越高,患者的疾病控制情况越好;而DLQI和UAS28为负向计分,故UCT与DLQI和UAS负相关。CSU 患者第1、2 次随访时,UCT 评分与UAS28、DLQI评分中度及以上相关,提示UCT能够反映CSU 患者的疾病活动情况和生活质量损害程度。虽然UAS 是CSU 患者疾病活动度评估的金标准,但由于UAS 的评估是前瞻性的,医生无法获得患者初次就诊时既往的疾病活动情况和药物疗效。而UCT作为回顾性评分工具,可以使临床医生连续比较包括基线资料在内的评分结果,并判断药物疗效,及时调整治疗方案。在临床工作中,联合使用UCT 与UAS 评分能够更加全面地了解患者的疾病相关情况。
在CIndU患者中,基线、第1次随访和第2次随访时UCT 评分与DLQI 评分呈中度及以上负相关,提示UCT 能够在一定程度上反映CIndU 对患者的生活质量损害情况。本研究中CIndU 患者UCT 与DLQI 评分相关系数波动较大,可能因为CIndU 患者的症状会因短时间接触诱因而发作或避免诱因自行消退。而DLQI与UCT对患者病情的回顾性评价的时长不同,DLQI评估就诊前1周内生活质量损害情况,UCT评估就诊前4周内疾病控制情况。这可能使DLQI、UCT会不同程度地夸大或掩盖病情,导致相关系数的波动。建议在临床工作中,联合使用UCT与DLQI评分,以全面了解患者的疾病情况。
已知族群效度检验结果显示,具有不同疾病活动度及生活质量损害的CSU 和CIndU 患者的UCT评分差异具有统计学意义。疾病活动度更高、生活质量损害更重即UAS28、DLQI 评分更高的患者,UCT 评分更低。CSU 与CIndU 患者UCT 变化量与UAS、DLQI变化量的相关系数均大于0.4,提示中文版UCT 的变化能够反映患者疾病活动度和疾病相关生活质量的变化,具有中度敏感性。该结果与土耳其版UCT 研究结果相似,该研究中UCT 与UAS28 相关系数为-0.598,与DLQI 相关系数为-0.543[6]。
ROC曲线下面积可以评价工具的筛选效果,当面积小于0.7时,表示识别准确度较低,0.7 ~0.9为中等,0.9 以上表示准确性较高。在CSU 患者中,ROC 曲线下面积为0.777,提示中文版UCT 具有较好的识别能力。ROC 曲线通过综合分析能够确定疾病控制良好的患者UCT 得分范围。UAS 是衡量CSU 疾病活动度的金标准,本研究中将UAS28 得分≤10 分的患者归类为“控制良好”,将UCT 评分≥12分的CSU患者确定为“控制良好”。此与德国原版的分界值一致[3]。在国际上,激发阈值测试是CIndU患者疾病诊断及疗效判断的金标准[10],但是目前国内尚缺乏各亚型CIndU 的激发阈值测试的临床适用性研究,故我们没有进一步对CIndU患者的疾病控制情况进行分层,缺少CIndU患者控制良好的UCT分界值。
综上,UCT 作为回顾性评估工具,能够了解患者初次就诊时的疾病控制情况,在CSU和CIndU患者中均具有良好的信效度,对病情的变化评估具有一定的敏感性,UCT ≥12 分时提示CSU 患者病情控制良好。UCT 量表的引入进一步完善了我国的CU 病情评价体系,促进了规范化患者管理流程的形成。但本研究尚未确定CIndU 患者控制良好的UCT分界值,未来需要进一步研究。
利益冲突所有作者均声明不存在利益冲突

