新型尿液标志物在紫癜性肾炎患儿中的水平变化
马一飞,李玉峰,郭桂梅,朱亚菊,龚莹靓,董 瑜
上海交通大学医学院附属新华医院小儿肾脏内科,上海 200092
过敏性紫癜(Henoch-Schonlein purpura,HSP)是儿童常见的血管炎,是儿童继发性肾脏疾病的常见原因之一。HSP 引起的紫癜性肾炎(Henoch-Schonlein purpura nephritis,HSPN)是影响预后的主要因素,严重者可进展为终末期肾功能不全[1]。临床上评估HSP 肾脏损害主要依赖于肾活检,但由于肾活检为有创操作,患者重复检测的依从性较差。因此通过尿液标志物来评估HSPN 的严重程度具有重要意义。近年来的研究[2]表明,血管紧张素系统(renin-angiotensin system,RAS)活化在肾脏病进展过程中十分重要;尿血管紧张素原(urinary angiotensinogen,UAGT)可以反映肾脏局部RAS 活化程度。成纤维细胞特异蛋白-1(fibroblast-specific protein-1,FSP-1)是成纤维细胞的标志物,反映肾小管上皮细胞、间充质细胞的转分化水平[3],在HSPN 疾病发展中非常重要。尿凝血酶(thrombin)可反映新月体肾炎炎症水平及肾脏局部凝血活动中的作用[4]。
本研究通过检测新型尿液标志物UAGT、FSP-1 及尿凝血酶在尿检正常儿童、HSP 患儿和HSPN 患儿中的水平,及在不同治疗阶段的HSPN 患儿中的水平,初步探讨3 种新型尿液标志物在HSPN 诊断及疗效评估中的价值。
1 对象与方法
1.1 研究对象及其临床资料
选取2016 年4 月—2019 年10 月上海交通大学医学院附属新华医院小儿肾脏内科收治的HSPN 患儿(HSPN组,n=14)、尿检正常的HSP 患儿(HSP 组,n=28)及尿检正常的儿童(对照组,n=23)。HSPN 患儿的诊断标准参考中华医学会儿科学分会肾脏病学组发布的《紫癜性肾炎的诊治循证指南(2016)》;在排除合并心血管系统疾病、慢性肝肾疾病、其他风湿性疾病、泌尿系统感染等疾病的同时,均行肾穿刺活检术明确肾脏病理改变,且肾小球病理分级均为Ⅲ级以上,即病理检查提示系膜增生,伴有<50%肾小球新月体形成和(或)节段性病变(硬化、粘连、血栓、坏死),其系膜增生又分为局灶/节段和弥漫性[5]。HSPN 组患儿均尚未经过治疗。HSP 患儿的诊断根据欧洲抗风湿病联盟和欧洲儿童肾脏病防治委员会标准[6],表现为孤立性皮肤白细胞增生性血管炎,即具有典型过敏性紫癜皮疹,可合并关节或腹部症状,排除肾脏受累症状,如蛋白尿、血尿。另选取尿检正常,排除过敏性紫癜及其他血管炎诊断的儿童作为对照组。
选取同一时期入院进行治疗的HSPN 患儿,治疗方案采取糖皮质激素(glucocorticoid,GC)联合免疫抑制剂,具体方案为甲泼尼龙(methylprednisolone)冲击治疗[15 ~30 mg/ (kg·d),静脉滴注,每日最大剂量不超过1.0 g,隔天给药,3 次后间隔1 周为1 个疗程,共2 个疗程],联合环磷酰胺(cyclophosphamide,CTX)序贯冲击治疗[8 ~12 mg/ (kg·d),静脉滴注,连续给药2 d 后间隔2 周为1 个疗程,共6 个疗程]。根据不同的治疗阶段,将HSPN 患儿分为未治疗组10 例、GC 组(GC 冲击治疗2 个疗程结束)9 例、GC+CTX 组(GC 冲击治疗2个疗程联合CTX 序贯冲击治疗6 个疗程结束)8 例,各组患儿之间无重复病例。收集以上患儿的性别、年龄、体质量等基本信息以及入院当天的血肌酐、尿素氮、24 h 尿蛋白定量、新月体指数等指标。
患儿入院当天均留取新鲜晨尿5 mL,于4 ℃下1 308×g 离心15 min,收集上清液冻存于-80 ℃,用于UAGT、FSP-1、尿凝血酶的检测(部分患儿未检测尿凝血酶)。所有入组尿样均获得入选对象监护人的知情同意。
1.2 UAGT、FSP-1、尿凝血酶及尿肌酐检测
尿肌酐(urinary creatinine,Ucr)采用全自动生化分析仪(7600,日本Hitachi)检测。UAGT 检测试剂盒购自日本IBL 公司(货号27412),尿FSP-1 检测试剂盒购自日本MBL 公司(货号CY-8086),尿凝血酶检测试剂盒购自中国武汉华美公司(货号CSB-E14235h)。具体操作严格按照说明书进行。
1.3 统计学方法
采用SPSS 23.0 统计软件进行数据分析,采用单个样本K-S 检验正态分布。正态分布的定量资料采用±s 表示;若符合方差齐性,则组间比较采用单因素方差分析,两两比较采用Bonferroni 法;若方差不齐,组间比较采用秩和检验。非正态分布的定量资料,采用M(Q1,Q3)表示,组间比较采用秩和检验。定性资料用频数(百分比)表示,组间比较采用χ2检验。P<0.05 认为差异有统计学意义。
2 结果
2.1 一般临床资料
在不同疾病患儿一般资料的比较中,HSPN 组患儿14 例,年龄(10.00±2.04)岁;HSP 组患儿28 例,年龄(6.11±2.48)岁;对照组儿童23 例,年龄(5.17±3.10)岁。其中HSPN 组患儿的年龄大于其他2 组,血肌酐和体质量高于对照组,差异均有统计学意义(P<0.05);但3 组间性别比、血尿素氮差异均无统计学意义 (表1)。
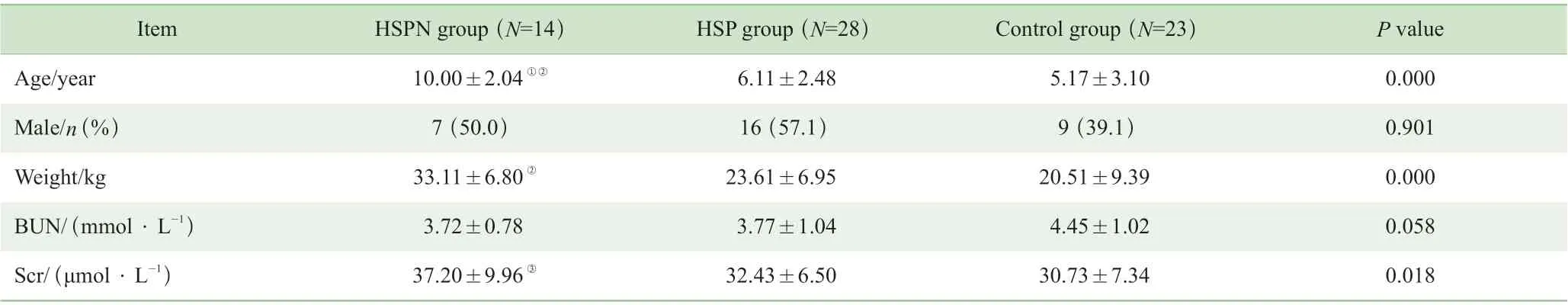
表1 HSPN 组、HSP 组患儿和对照组儿童一般资料的比较Tab 1 Comparison of the general information among HSPN group, HSP group and control group
在HSPN 不同治疗阶段患儿基线资料(治疗前)的比较中,未治疗组10 例,年龄(10.03±2.05)岁;GC组9 例,年龄(8.67±2.45)岁;GC+CTX 组8 例,年龄(8.88±2.59)岁。3 组患儿治疗前基线资料的各项指标差异均无统计学意义(表2)。
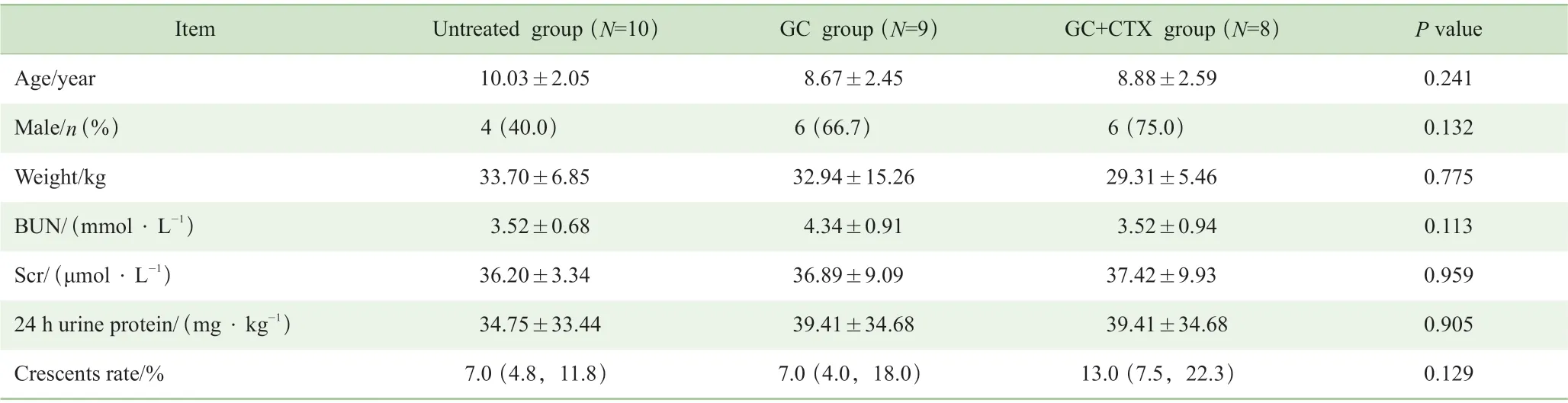
表2 未治疗组、GC 组和GC+CTX 组HSPN 患儿基线资料的比较Tab 2 Comparison of the general information among untreated group, GC group and GC+CTX group
2.2 HSP 累及肾脏时UAGT、FSP-1 和尿凝血酶水平的变化
分别检测HSPN 组、HSP 组患儿和尿检正常儿童的UAGT、FSP-1 和尿凝血酶水平。由于UAGT 经肾小球滤过,用Ucr 校正UAGT 水平。HSPN 组UAGT/Ucr 和FSP-1均显著高于HSP 组和对照组(均P<0.05),而HSP 组与对照组间差异无统计学意义。HSPN 组患儿尿凝血酶水平与HSP 组间差异无统计学意义,但2 组均显著高于对照组(均P<0.05)(图1)。
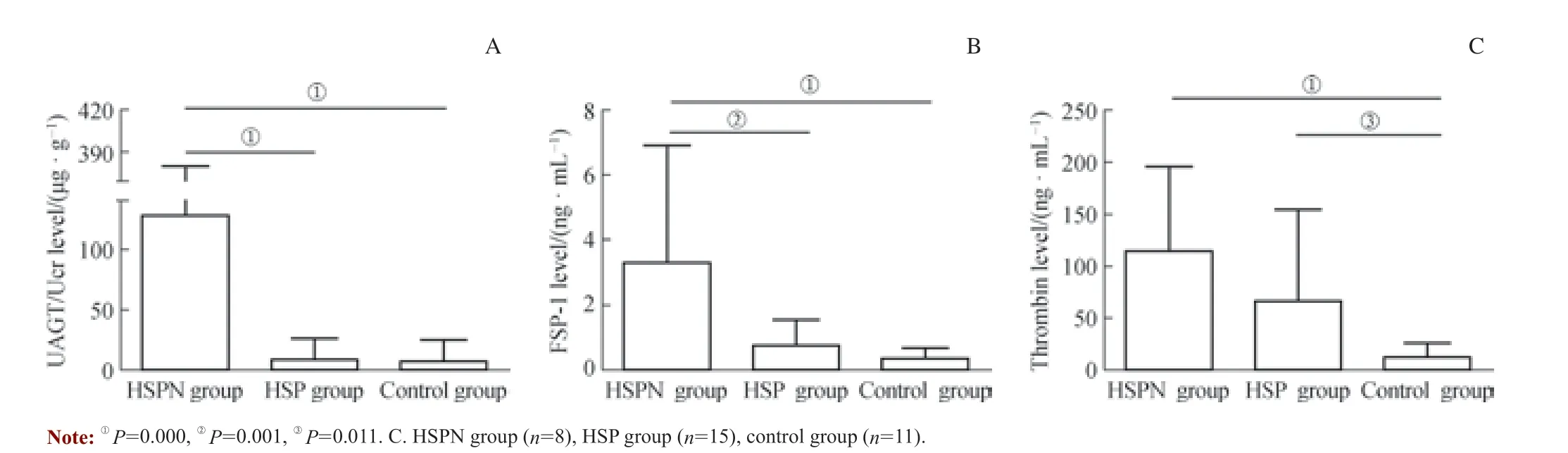
图1 HSPN 组、HSP 组患儿和对照组儿童UAGT/Ucr(A)、FSP-1(B)和尿凝血酶(C)的表达Fig 1 Levels of UAGT/Ucr (A), FSP-1 (B) and thrombin (C) in HSPN group, HSP group and control group
2.3 HSPN 不同治疗阶段UAGT、FSP-1、尿凝血酶水平及24 h 尿蛋白定量的变化
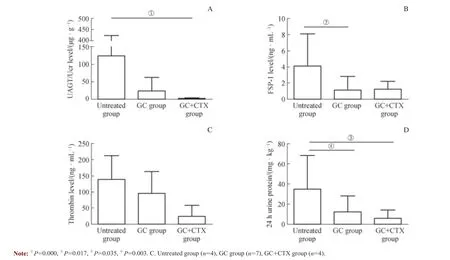
图2 未治疗组、GC 组和GC+CTX 组HSPN 患儿UAGT/Ucr (A)、FSP-1 (B)、尿凝血酶(C)及24 h 尿蛋白定量(D)水平Fig 2 Levels of the UAGT/Ucr (A), FSP-1 (B), thrombin (C) and 24 h urine protein (D) in untreated group, GC group and GC+CTX group
在HSPN 患儿的不同治疗阶段,UAGT/Ucr、FSP-1、尿凝血酶和24 h 尿蛋白定量水平均在未治疗组最高,GC组和GC+CTX 组均有一定程度的降低,但完成GC 序贯CTX 冲击治疗后仅UAGT/Ucr 和24 h 尿蛋白定量显著低于未治疗组(均P<0.05),尿凝血酶在3 组间差异均无统计学意义。FSP-1 在GC 冲击治疗后即较未治疗组显著下降(P<0.05),但序贯CTX 冲击治疗后反而出现了回升,与未治疗组间差异无统计学意义(图2)。
3 讨论
HSP 患儿若发生肾脏损害会对其远期预后有较大的影响,少部分HSPN 患儿可进展为终末期肾病。目前HSPN的严重度评估主要依赖于肾活检,新月体指数越高,说明损伤程度越严重。及时动态评估肾脏损害程度有利于指导临床开展精准治疗。肾活检有一定的创伤,临床上重复肾活检依从性差;如有无创、简便、特异的尿液标志物帮助临床医师早期发现疾病进展并尽早干预,既可改善预后,又可避免过度治疗。
近年来研究发现了多种与新月体形成相关的尿液标志物。肾脏局部RAS 在肾脏病理生理中起重要作用。肾脏内存在完整独立的局部RAS[7],其活化在包含IgA 肾病在内的肾病进程中至关重要。血管紧张素原(angiotensinogen,AGT)主要通过血管紧张素转化酶(angiotensin converting enzyme,ACE)等的作用转化为血管紧张素Ⅱ型(angiotensin Ⅱ,Ang Ⅱ)发挥作用,后者可通过与血管紧张素受体(angiotensin receptors,ATR)结合,导致肾小球内压升高,肾血流量减少,继而引起肾小球滤过率下降,并刺激肾小球系膜细胞增生、活化和肥大,促进细胞外基质增生[8-9]。另外Ang Ⅱ可以诱发、参与炎症反应,并通过影响白细胞对血管内皮细胞的损伤作用,改变血管通透性,引起血管炎[10],并通过激活氧化应激系统、诱导上皮 - 间充质转化(epithelial-mesenchymal transition,EMT)介导新月体的形成。免疫组织化学实验表明,UAGT 与肾脏内Ang Ⅱ染色强度呈正相关,与血AGT 水平无关,提示UAGT 可以较好地反映肾脏局部RAS 活性。在本研究中,UAGT/Ucr 在HSPN 组的水平显著高于HSP 组和对照组,而后2 组间差异无统计学意义;表明HSPN 发病过程中存在局部RAS 活化,导致肾脏局部AGT 水平明显升高。另HSPN 患儿经过GC 和CTX 序贯冲击治疗后,24 h 尿蛋白定量逐步减少,UAGT/Ucr 水平亦随之下降,可见UAGT/Ucr 水平在评估病情进展和疗效上具有一定的价值。
FSP-1 又称S1004A 蛋白,是S100 蛋白家族成员之一,分布于人类的成纤维细胞、单核细胞、巨噬细胞等多种细胞中,但正常肾脏细胞中未见表达。FSP-1 在EMT过程中起重要作用[11-12]。Iwano 等[13]发现FSP-1 在新月体肾炎患者的尿液中显著升高,Turnier 等[14]在狼疮性肾炎患者中亦发现FSP-1 与新月体指数及疾病活动度有关。故尿FSP-1 可反映肾脏新月体的形成程度。在本研究中,HSPN 组的FSP-1 水平较HSP 组和对照组明显升高,表明HSPN 患儿肾脏损害过程中激活新月体形成,并出现EMT 及纤维化现象。在后续治疗评估中,GC 冲击可引起FSP-1 水平明显下降,但在序贯CTX 冲击后出现了小幅回升。由于HSPN 患儿在治疗后期肾脏的纤维化程度未进行病理学检查,无法从病理学角度加以验证。
尿凝血酶与慢性肾脏病关系密切。早在2004 年,有研究[15]发现尿凝血酶与肾小球肾炎相关,反映肾小球肾炎局部凝血过程。2015 年,Kitamoto 等[4]发现尿凝血酶可反映新月体肾炎的活动程度;这可能与肾小球内纤维蛋白的沉积有关,后者可促进肾脏局部凝血酶生成,参与肾脏局部细胞外基质代谢调控,与细胞外基质的完整性密切相关,而细胞外基质系统的紊乱是新月体形成的重要因素。因此,尿凝血酶可反映肾脏新月体形成以及炎症活化的程度。在本研究中,尿凝血酶在HSPN 组中水平显著高于对照组,但与HSP 组差异不大,提示HSP 患儿无论是否累及肾脏,都可能引起尿凝血酶升高,推测可能与HSP 引起广泛的血管炎,导致凝血功能异常有关。另外,尿凝血酶在GC 组及GC+CTX 组患儿中的水平较未治疗组有所下降,但差异无统计学意义。一方面可能提示尿凝血酶与肾脏受损无明显相关性,与血管炎关系更密切;另一方面可能与样本量较少有关,需要收集更多的病例资料加以明确。
综上所述,UAGT/Ucr 和尿FSP-1 可以在一定程度上反映HSP 患儿有无发生肾脏损害,并有可能对HSPN 患儿的疗效有一定的提示作用。
参·考·文·献
[1] Davin JC, Coppo R. Henoch-Schönlein purpura nephritis in children[J]. Nat Rev Nephrol, 2014, 10(10): 563-573.
[2] Urushihara M, Kagami S. Role of the intrarenal renin-angiotensin system in the progression of renal disease[J]. Pediatr Nephrol, 2017, 32(9): 1471-1479.
[3] Harada K, Akai Y, Yamaguchi Y, et al. Prediction of corticosteroid responsiveness based on fibroblast-specific protein 1 (FSP1) in patients with IgA nephropathy[J]. Nephrol Dial Transplant, 2008, 23(10): 3152-3159.
[4] Kitamoto Y, Arizono K, Fukui H, et al. Urinary thrombin: a novel marker of glomerular inflammation for the diagnosis of crescentic glomerulonephritis (prospective observational study)[J]. PLoS One, 2015, 10(3): e0118704.
[5] 中华医学会儿科学分会肾脏学组. 紫癜性肾炎诊治循证指南(2016)[J]. 中华儿科杂志, 2017, 55(9): 647-651.
[6] Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J]. Ann Rheum Dis, 2006, 65(7): 936-941.
[7] 章晓燕, 吕文律, 滕杰, 等. 慢性肾脏病患者尿血管紧张素原与肾脏肾素血管紧张素系统活性的相关性[J]. 中华肾脏病杂志, 2011, 27(5): 327-332.
[8] Urushihara M, Nagai T, Kinoshita Y, et al. Changes in urinary angiotensinogen posttreatment in pediatric IgA nephropathy patients[J]. Pediatr Nephrol, 2015, 30(6): 975-982.
[9] Kobori H, Urushihara M. Augmented intrarenal and urinary angiotensinogen in hypertension and chronic kidney disease[J]. Pflugers Arch, 2013, 465(1): 3- 12.
[10] Yamamoto T, Nakagawa T, Suzuki H, et al. Urinary angiotensinogen as a marker of intrarenal angiotensin Ⅱ activity associated with deterioration of renal function in patients with chronic kidney disease[J]. J Am Soc Nephrol, 2007, 18(5): 1558-1565.
[11] Nishitani Y, Iwano M, Yamaguchi Y, et al. Fibroblast-specific protein 1 is a specific prognostic marker for renal survival in patients with IgAN[J]. Kidney Int, 2005, 68(3): 1078-1085.
[12] Mishra SK, Siddique HR, Saleem M. S100A4 calcium-binding protein is key player in tumor progression and metastasis: preclinical and clinical evidence[J]. Cancer Metastasis Rev, 2012, 31(1/2): 163-172.
[13] Iwano M, Yamaguchi Y, Iwamoto T, et al. Urinary FSP1 is a biomarker of crescentic GN[J]. J Am Soc Nephrol, 2012, 23(2): 209-214.
[14] Turnier JL, Fall N, Thornton S, et al. Urine S100 proteins as potential biomarkers of lupus nephritis activity[J]. Arthritis Res Ther, 2017, 19(1): 242.
[15] Kitamoto Y, Tomita K, Imamura T. Assessment of thrombin in the urine of glomerulonephritic patients by enzyme-linked immunosorbent assay[J]. Ann Clin Biochem, 2004, 41(Pt 2): 133-137.

