SBP-1蛋白作为肺腺癌潜在诊断标志物的验证*
韩宾, 魏慧敏, 张舒林, 孟民杰△
1广东药科大学生命科学与生物制药学院(广东广州 510006); 2同济大学高等研究院(上海 310106); 3上海交通大学基础医学院(上海 200025)
呼吸系统疾病在全世界具有最高的病死率,包括慢性阻塞性肺疾病、支气管哮喘、肺癌、肺弥漫性间质纤维化和肺结核(pulmonary tuberculosis,PTB)。迄今为止,肺癌和肺结核仍然是这些疾病中的世界性难题。根据组织病理学类型,肺癌可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),NSCLC包括肺腺癌(lung adenocarcinoma,LUAD)、鳞状细胞肺癌(lung squamous cell carcinoma,LUSC)、大细胞癌(large cell carcinoma)和基底细胞癌(basal-like cell carcinoma)。全球癌症统计数据表明,2018年各类癌症中肺癌的发病率和病死率最高[1]。此外,结核病是全球十大死亡原因之一,也是全球单一传染源的首要原因[2]。不仅如此,PTB在临床上还容易被误诊为肺癌。尽管多年来对肺癌的研究取得了重大进展,但其发病率和病死率仍然很高。目前,通过手术治疗的肺癌患者的五年生存率为30%~42%,而非手术治疗的为4%~12%。肺癌患者各个阶段的治疗效果也有很大差异。肿瘤标志物的发现和合理利用可以达到早期发现肺癌的目的。虽然已经有肿瘤标志物在临床上使用,但是缺乏足够的敏感度和特异度。因此,迫切需要发现具有高敏感度和特异度的肿瘤标志物。硒是人体必需的微量元素。它在阻断细胞周期,促进细胞凋亡,减少细胞增殖,DNA低甲基化[3],增加谷胱甘肽过氧化物酶和硫氧还蛋白还原酶的活性[4],调节内质网应激反应[5]和增强DNA修复[6]中起关键作用。此外,硒还被认为与降低癌症风险有关[7-10]。SBP-1是人体中硒的一种存在形式。研究表明,硒可能以共价键的形式存在于SBP-1中,其结合位点位于第57个半胱氨酸上[11-12]。也有研究表明,SBP-1是一种与口臭有关的甲硫醇氧化酶,参与了甲硫醇的代谢过程[13]。另外,与肺癌、肝癌、食管癌、子宫平滑肌瘤、乳腺癌和恶性黑色素瘤等许多癌症相比,SBP-1的表达较正常人降低[14-21]。但是,基于先前对肺腺癌组织样品进行蛋白质组学研究的结果,我们发现与匹配的癌组织相比,SBP-1蛋白在肺腺癌组织中表达上调。因此,我们进一步证实了这一结果,并观察LUAD中SBP-1蛋白是否上调。
1 资料与方法
1.1 样本及试剂 在先前的蛋白质组学研究中,我们于2011年4月至2011年8月从河南大学第一附属医院收集了18例LUAD组织和配对癌旁组织,作为发现组样本,病例均经病理学诊断。2018年10月至2019年3月从上海市公共卫生临床中心病理科收集36例NSCLC组织切片,包括23例肺腺癌和13例肺鳞癌;21例肺结核组织切片,其中12例痰涂片阳性结核(P-PTB)和9例痰涂片阴性(N-PTB)的患者,作为验证组样本,所有样本均由病理专家检查。样本的详细临床信息如表1所示。本研究是在上海市公共卫生临床中心伦理审查委员会的批准下进行的,所有参与者均签署了知情同意书。伦理道德已经认证(2019-S009-02)。

表1 肺癌组织样本(发现组)和石蜡切片样本(验证组)临床信息 例(%)
鼠源抗人SBP-1单克隆抗体(日本MBL)购自MEDICAL&BIOLOGICAL LABORATORIES CO,LTD。带有FITC标记的驴抗小鼠多克隆抗体和HRP标记的山羊抗小鼠多克隆抗体购自英国Abcam公司。ImmPACTTM DAB过氧化物酶底物购自VECTOR LABORATORIES。
1.2 方法
1.2.1 免疫荧光 使用超高分辨率激光扫描共聚焦显微镜,通过免疫荧光法对36例NSCLC患者和21例PTB患者进行SBP-1的细胞定位。用二甲苯和浓度梯度递减的乙醇分别对切片进行脱蜡和水化处理。在高温条件下用枸橼酸钠缓冲液(pH=6.0,碧云天)抗原修复。自然冷却至室温后,用PBS缓冲液(pH=7.4)洗涤3次。在室温下使用5%正常驴血清封闭1 h,然后使用抗人SBP-1单克隆抗体(MBL,日本)以1∶200稀释度孵育1 h,然后使用PBS缓冲液洗涤3次。通过使用带有FITC标记的驴抗小鼠多克隆抗体(Abcam,UK)以1∶100稀释度避光孵育1 h。用PBS缓冲液(pH=7.4)洗涤3次后,用DAPI染色确定细胞核的位置,并用抗荧光猝灭剂封片。随后,用超高分辨率激光扫描共聚焦显微镜(德国LEIKA TCS SP8 STED)获得数字图像。
1.2.2 免疫组化 通过免疫组织化对36例NSCLC患者和21例PTB患者进行了SBP-1表达水平的测定。分别使用二甲苯和浓度梯度递减的乙醇对切片进行脱蜡和水化,然后使用过氧化氢溶液(BOSTER,美国)避光孵育10 min。在高温条件下用枸橼酸钠缓冲液(pH=6.0,碧云天)抗原修复。自然冷却至室温后,用PBS缓冲液(pH=7.4)洗涤3次。在室温下使用5%正常山羊血清封闭1 h,然后使用小鼠抗人SBP-1单克隆抗体(MBL,日本)以1∶500稀释度孵育1 h,用PBS缓冲液(pH=7.4)洗涤3次。使用带有HRP标记的山羊抗小鼠多克隆抗体(Abcam,UK)以1∶2 500稀释度孵育1 h。用PBS缓冲液(pH=7.4)洗涤3次后,根据说明书用DAB试剂盒(Vector Laboratories)对切片染色,并用苏木精复染。随后,通过浓度递增的乙醇和二甲苯脱水。用显微镜(日本Nikon H550S)拍摄电子图像,并使用Image Pro Plus 6.0计算平均光密度,该平均光密度代表SBP-1的定量蛋白表达水平。
1.3 统计学方法 采用SPSS 23.0统计软件,通过配对Mann-WhitneyU检验分析两组间SBP-1的表达水平差异,以P<0.05为差异有统计学意义。
2 结果
2.1 SBP-1蛋白在组织中的表达水平分析 在先前的蛋白质组学研究中,我们通过2-DE和MALDI-TOF-MS技术研究了18例LUAD及其癌旁组织,与癌旁组织相比,SBP-1蛋白在LUAD组织上调。为了验证与癌旁组织相比SBP-1蛋白在LUAD中是否上调。我们对另一独立的肺癌组织(包括LUAD和LUSC)和配对的癌旁组织样本进行了免疫组织化学染色。通过免疫组织化学分析对36例肺癌样本(0.017 2±0.017 7)和匹配癌旁组织(0.004 0±0.006 5)以及21例PTB样本(0.005 3±0.007 6)进行SBP-1表达的定量分析。结果显示SBP-1蛋白主要集中在肺癌组织的肺泡上皮细胞,并分布在细胞质和细胞核中。与肺癌样本相比,在癌旁组织中观察到SBP-1在零星的细胞中表达,但是染色强度却更高。尽管SBP-1蛋白主要在肺泡上皮细胞中表达,但它更集中于细胞核(图1)。同样的在LUAD中检测到SBP-1表达上调也比较明显(P<0.05)(图1-C)。另外,SBP-1区分LUAD和癌旁组织的特异度高达95.7%(95%CI:0.76~0.97),受试者操作特征(ROC)曲线下面积(AUC)为0.863 9(图1-D)。LUSC和癌旁组织之间没有显著差异。痰涂片阳性PTB(P-PTB)和痰涂片阴性PTB(N-PTB)样本之间也无明显差异。此外,与P-PTB组(P<0.05)和N-PTB组(P<0.05)相比,肺癌组织中SBP-1表达上调。特别是在LUAD中,SBP-1对鉴别LUAD和PTB特异度高达93.3%(95%CI,0.79~1.0),AUC为0.892 8(图1-E)。
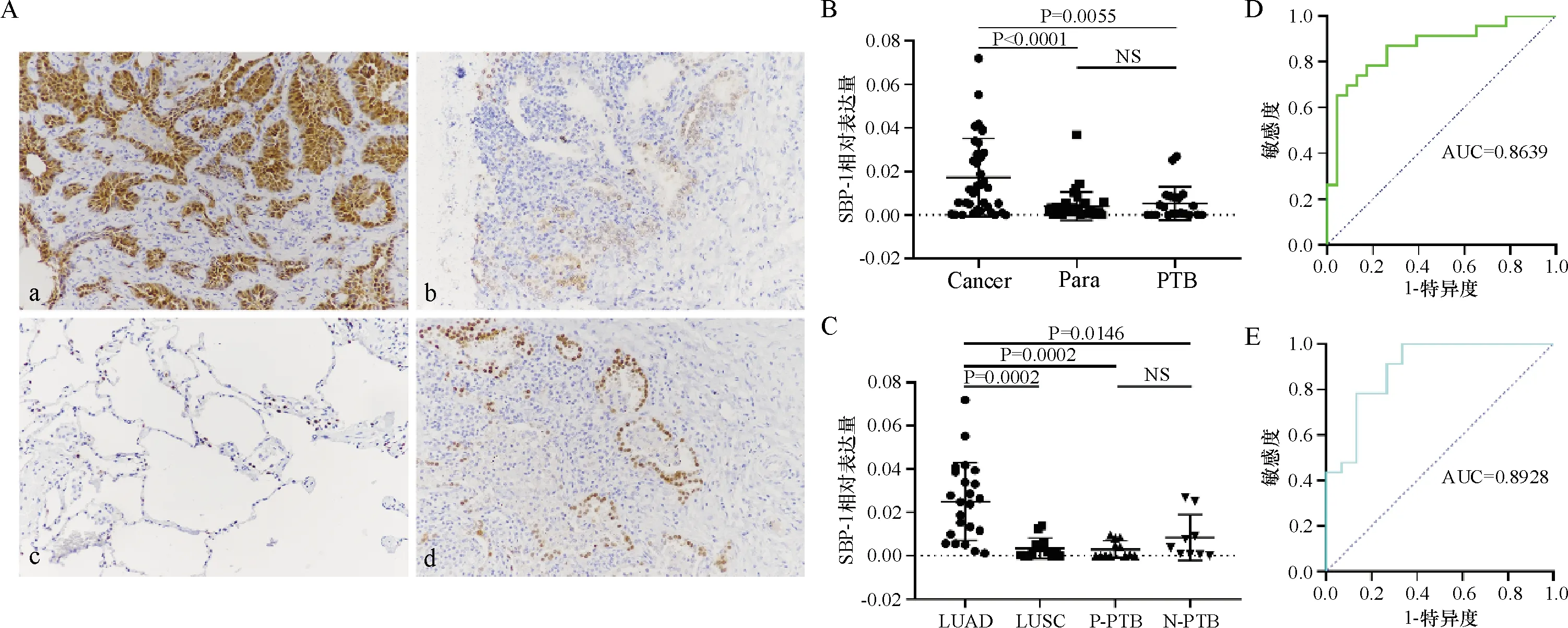
注:A:肺癌和肺结核组织SBP-1蛋白免疫组化染色(×200),a为肺腺癌组织,b为肺鳞癌组织,c为癌旁组织,d为肺结核组织;B、C:SBP-1蛋白在肺癌、癌旁、肺结核组织中的表达水平分析;D、E:利用SBP-1从癌旁和肺结核组织中鉴别肺腺癌的ROC曲线,Para表示癌旁组织
2.2 SBP-1蛋白在组织中的定位 我们还在肺癌和癌旁组织细胞中定位了SBP-1蛋白,以检测人体异常条件下细胞中SBP-1蛋白的分布。我们通过免疫荧光分析证实了SBP-1蛋白同时分布在细胞质和细胞核中(图2)。在肺癌样本的细胞核中观察到轻微的免疫荧光信号,可能是由于染色质变松。在癌旁组织中,SBP-1蛋白分布在细胞质和细胞核中,但更多地集中于细胞核。同样,在肺结核样本中也观察到在细胞质和细胞核中分布SBP-1蛋白,在细胞核中免疫荧光信号轻微。并且观察到与肺癌样品相比,PTB组织细胞核较小的现象。
3 讨论
肺癌是最常见的恶性肿瘤之一,具有最高的发病率和病死率。根据病理类型的不同,肺癌可分为SCLC和NSCLC。NSCLC是最常见的肺癌病理类型,占肺癌的85%,其5年生存率仅为15.9%[22]。目前,治疗NSCLC的常用方法是手术,化学疗法和免疫疗法。手术治疗对于处于不同阶段的癌症患者具有不同的治疗效果。对于晚期NSCLC患者,主要通过手术切除进行治疗,但肿瘤复发仍不可避免[23]。靶向肿瘤的小分子化疗药尽管对肿瘤表现出良好的杀伤作用,虽然能够在一定程度上延长生存时间,但常常伴随一系列不良反应。PD-1/PD-L1单克隆抗体是用于肿瘤免疫治疗的一线药物,即使是对PD-L1阳性的患者有效率也达不到100%。由于耐药性的问题想要长期有效地抑制肿瘤的发展在很大程度上不可能的,因此需要尽可能在早期就进行医疗干预。因此发现一种能够达到早期诊断目的的肿瘤标志物显得非常重要。
SBP-1是一种高度保守的蛋白,分子量56 kD,人与小鼠之间的同源性为86%[24]。SBP-1在人的心、肝、脾、肺、肾、结直肠和前列腺中有不同程度表达。作为肿瘤抑制因子,SBP-1在许多肿瘤中表达,例如肺癌、肝癌、胃癌、大肠癌、乳腺癌、前列腺癌、食管鳞状细胞癌和黑素瘤。Chen等[15]研究了94例LUAD组织和10例正常肺组织,发现SBP-1在LUAD中的表达水平与肿瘤的分化程度和TNM临床分期有关,而低水平的SBP-1可以预测不良预后。此外,Tan 等[19]研究了82例LUSC,结果表明SBP-1在LUSC中的表达水平较正常支气管组织降低,SBP-1表达水平与年龄、性别、原位肿瘤分期、TNM临床分期和远处转移无相关性,与淋巴结转移和低生存率显着相关,低水平的SBP-1可作为LUSC不良预后的独立影响因素。但是根据我们之前的蛋白组学研究,SBP-1蛋白在LUAD中表达上调,为了验证这一结果我们做了进一步研究。
我们通过免疫荧光和免疫组织化学研究了SBP-1蛋白在NSCLC和PTB组织中的定位情况和表达水平。免疫荧光实验结果表明,SBP-1蛋白在NSCLC和PTB组织的细胞质和细胞核中表达。然而,在癌旁组织中SBP-1蛋白更集中于细胞核中。在前列腺癌研究中,肿瘤细胞中SBP-1蛋白的核质比与肿瘤的恶性呈负相关[14]。因此,免疫荧光实验结果表明,SBP-1蛋白在肿瘤细胞中的分布对判断肿瘤的恶性程度有一定的指导作用,也表明SBP-1蛋白可能在肿瘤的发生中起关键作用。免疫组织化学结果表明,肺癌中SBP-1的表达明显高于癌旁组织,而LUAD的表达明显高于LSUC。这一发现有助于区分不同组织学类型的NSCLC。尤其在LUAD中,SBP-1的表达明显高于PTB。另外,SBP-1鉴别LUAD和正常组织的特异度达到了95.7%,AUC为0.863 9,表明SBP-1蛋白具有从正常组织中鉴别肺腺癌的潜在价值。如果结合使用其他标志物,这将极大地提高LUAD的诊断效率。SBP-1蛋白有潜力作为评估LUAD发展和预后的指标,甚至可以作为LUAD的诊断标志物或疗效评判指标。
本研究首次检测到PTB组织中SBP-1蛋白的表达,研究表明SBP-1蛋白具有评估LUAD发展和预后的潜力,甚至可以作为LUAD的辅助诊断工具,具有良好的临床应用价值。SBP-1蛋白的表达水平在一定程度上也有助于区分LUAD和LUSC。另外,SBP-1蛋白的核质比在判断肺癌的恶性程度方面也具有一定的指导作用。

