小胶质细胞自噬和炎症及其交互作用对脑出血调控机制的研究进展
姚林,穆琼
本文要点:
本文阐述并归纳、分析了脑出血后自噬和炎症的执行者——小胶质细胞对脑出血的调控机制,并细致地罗列了脑出血后小胶质细胞自噬和炎症的具体信号通路,进一步增强了对脑出血后自噬和炎症的认识,并对小胶质细胞自噬与炎症之间的可能关系进行了分析。
脑出血患者血肿形成后血肿析出的血液成分(如凝血酶、免疫蛋白、补体)及损伤组织、凋亡细胞释放的物质(如血红蛋白、核酸、脂质递质)均会引起小胶质细胞活化,小胶质细胞活化后一方面可通过结构及形态改变、增殖[1-2]而对抗中枢神经系统损伤,另一方面可通过自身表型/功能改变[3]及炎性小体途径而产生炎性因子、氧自由基并导致白细胞浸润、血-脑脊液屏障遭破坏,最终形成脑出血后炎症;小胶质细胞活化后产生的炎症虽具有再生修复作用,但若炎症无法控制则会加重脑损伤[4-6]。此外,小胶质细胞活化后还可导致自身内环境稳态遭破坏并启动小胶质细胞自噬[7],而对脑出血后小胶质细胞自噬及炎症的调节可减轻脑出血后继发性损伤。本文综述了小胶质细胞自噬和炎症及其交互作用对脑出血的调控机制,现报道如下。
1 脑出血后小胶质细胞自噬
1.1 自噬的概述 自噬是真核细胞中普遍存在的一种高度保守的溶酶体途径介导的吞噬降解相关成分过程,可分为大自噬、小自噬及分子伴侣介导的自噬(CMA),本文中自噬主要指大自噬;自噬启动后溶酶体膜突出并将其周围物质通过内陷、包裹等形式进行降解[8]。自噬流(autophagy flux)即自噬流程,主要分为3步:(1)细胞内环境改变及其产生的相关信号通过信号通路而诱导自噬,如细胞内环境稳态改变后通过抑制雷帕霉素复合物1而启动自噬[9];(2)双层膜结构形成、延伸以包裹目标底物并形成密闭结构,即自噬体,一般自噬体的形成需募集约15种自噬基因(ATG)及其他相关蛋白协助[10];(3)自噬体与溶酶体膜融合而使其包裹的内容物在溶酶体酸性水解酶的作用下降解。近年研究发现,可溶性 N-乙基马来酰胺敏感因子附着蛋白受体(SNARE)蛋白复合物虽对自噬体与溶酶体的膜融合具有关键作用,但其对自噬体的形成影响不大,而自噬体与溶酶体融合受阻将阻碍溶酶体对目标底物的降解[11]。
1.2 脑出血后小胶质细胞活化及自噬 虽然脑出血后小胶质细胞活化诱导的炎症可促进组织修复,但过度的小胶质细胞活化则会造成脑出血后继发性损伤及细胞内环境稳态改变,因此为减少损伤、清除有害物质及维持细胞内环境稳态,小胶质细胞会启动自噬,但自噬的过度激活可导致细胞自噬程序性死亡。HE等[12]进行的体内研究发现,雄性脑出血大鼠受损脑组织中自噬体标志物微管相关蛋白1轻链3(LC3)-Ⅱ/LC3-Ⅰ比值及溶酶体中自噬相关组织蛋白酶D水平均升高,进一步通过电子显微镜观察发现雄性脑出血大鼠血肿周围出现自噬空泡且含有自噬空泡结构的细胞多为神经胶质细胞,提示脑出血后自噬加重同时细胞自噬程序性死亡导致脑损伤加重。一项体外研究表明,分别沉默自噬相关基因beclin1和Atg5及使用自噬抑制剂均可减少体外培养的溶解红细胞诱导的小胶质细胞炎性因子的释放,有利于减轻脑出血后脑损伤[13]。因此,小胶质细胞自噬在脑出血后病理生理改变过程中发挥着重要作用。
1.3 脑出血后小胶质细胞自噬与脑损伤的关系 脑出血后小胶质细胞自噬可能加重脑损伤,也可能对脑出血损伤具有保护作用,这一双重作用提示脑出血后小胶质细胞自噬与炎症紧密相关,但目前关于脑出血后小胶质细胞自噬的双重作用及其在脑出血后病理生理改变过程中究竟发挥单向作用还是双重作用尚存在争议,需进一步探究。
1.3.1 小胶质细胞自噬加重脑出血后脑损伤 脑出血后多条自噬相关信号通路激活并诱导小胶质细胞自噬,而小胶质细胞自噬引发炎症及中枢神经系统损伤涉及的信号通路以Toll样受体4(TLR4)-自噬-核因子κB(NF-κB)途径、白介素-17A(IL-17A)途径、微小核糖核酸-144(miRNA-144)-哺乳动物雷帕霉素靶蛋白(mTOR)途径为主(见图1)。
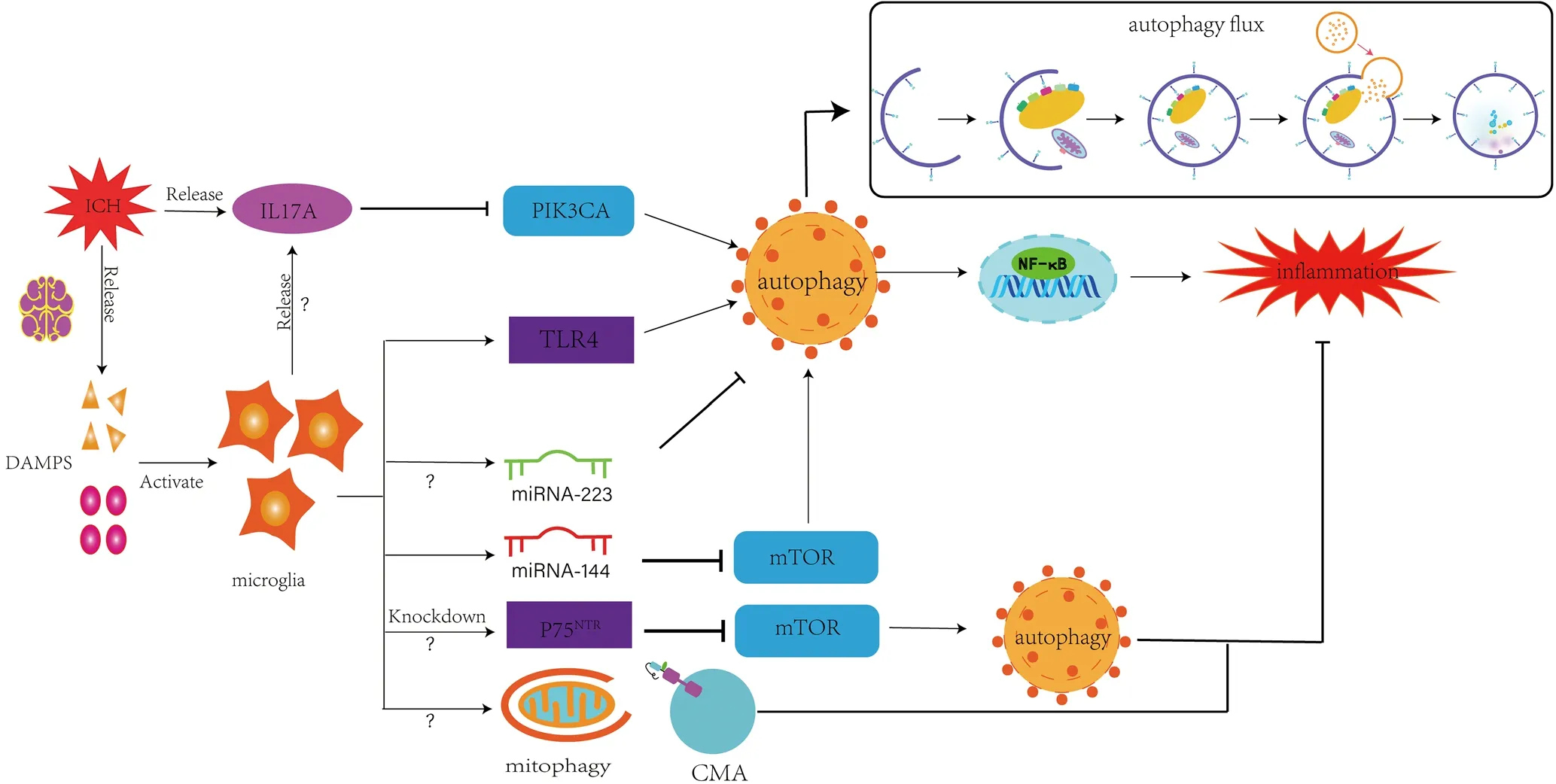
图1 脑出血后小胶质细胞自噬相关信号通路模式图Figure 1 Signaling pathway related to post-intracerebral hemorrhage microglia autophagy
1.3.1.1 TLR4-自噬-NF-κB途径 TLR4是一种受体识别蛋白,会在识别有害刺激后引发自噬;NF-κB信号通路在炎症和细胞凋亡及其调节方面发挥着重要作用。陆梦茹等[14]研究发现,脑出血小鼠脑组织小胶质细胞自噬水平升高,而采用TLR4-小干扰RNA(siRNA)干扰TLR4表达后脑出血小鼠脑组织小胶质细胞自噬水平下降,相关炎性因子及NF-κB信号蛋白表达减少;但也有研究表明小胶质细胞中TLR4与其配体结合后会抑制磷脂酰肌醇-3-激酶(PI3K)-转录因子叉头蛋白3(FOXO3)通路而非mTOR或丝裂原活化蛋白激酶(MAPK1/3)通路,并最终使小胶质细胞自噬水平下降[15]。上述研究提示TLR4途径在脑出血后小胶质细胞自噬中发挥着重要作用,脑出血后小胶质细胞自噬可能通过NF-κB信号通路和细胞凋亡而加重脑出血损伤[15-16]。
1.3.1.2 IL-17A途径 脑出血后损伤脑组织可释放IL-17A等炎性因子[17]并促进小胶质细胞自噬[18],目前研究认为IL-17A的主要来源是T淋巴细胞,但有少量证据支持IL-17A可能由小胶质细胞释放[19-20]。IL-17A途径在脑出血后主要通过抑制小胶质细胞中磷脂酰肌醇-3-激酶催化亚单位α(PIK3CA)蛋白的表达而诱导小胶质细胞自噬,而小胶质细胞自噬会进一步引起小胶质细胞炎症并导致脑出血后神经损伤,抑制小胶质细胞自噬后小胶质细胞炎症减轻同时神经损伤得以改善[18]。
1.3.1.3 miRNA-144-mTOR途径 研究表明,脑出血后小胶质细胞自噬的激活可能与微小RNA(miRNA)的调控有关:miRNA-144可通过直接结合mTOR 基因相关靶点而抑制mTOR的表达,继而激活小胶质细胞自噬、引发炎症,脑出血小鼠小胶质细胞中miRNA-144表达明显升高[21];miRNA-223可通过靶向自噬相关基因Atg16L1mRNA的3'非编码区(3'UTR)而抑制小胶质细胞自噬并引发中枢神经系统炎症。目前研究认为,miRNA调控脑出血后小胶质细胞自噬的过程可能是复杂的,其调控作用也视不同miRNA而定[22]。
1.3.2 小胶质细胞自噬对脑出血后脑损伤的保护作用
1.3.2.1 mTOR途径 有研究发现脑出血大鼠脑组织mTOR通路下游信号蛋白分子4E结合蛋白1和p70核糖体S6蛋白激酶1磷酸化水平升高,提示mTOR通路激活,而在阻断mTOR通路后脑出血相关炎性因子释放幅度明显降低、细胞凋亡水平下降,但mTOR通路与细胞自噬的关系尚不明确[23]。由于阻断 mTOR 通路可以激活细胞自噬[9,21,24],因此WANG等[25]进行的体外实验通过抑制P75神经营养因子受体(P75NTR)表达而阻断了mTOR通路,并达到了促进脑出血后星形胶质细胞自噬以发挥其保护神经元作用的目的,而在此之前已有研究证实小胶质细胞自噬与mTOR通路有关[21]。
1.3.2.2 miRNA途径 有研究发现伴有炎症的中枢神经系统中小胶质细胞miRNA-223大量表达,抑制miRNA-223表达后小胶质细胞自噬增强且静息小胶质细胞数量增多、活化的小胶质细胞数量减少、中枢神经系统炎症减轻,说明miRNA-223可能参与了中枢神经系统炎症及小胶质细胞自噬的调节[22]。
1.3.2.3 其他途径 除大自噬外,CMA和选择性自噬(如线粒体自噬)也可能在脑出血后发挥积极作用:小胶质细胞CMA可通过降解具有炎症调节作用的经典IκB激酶β(IKKβ)/ NF-κB途径中的IKKβ而减少炎性因子的产生[26];高血压脑出血大鼠脑组织出现线粒体自噬,而抑制线粒体自噬可导致高血压脑出血大鼠脑损伤加重,提示线粒体自噬对高血压脑出血大鼠脑损伤具有一定保护作用[27];体外实验证实增强线粒体自噬具有减少小胶质细胞活性氧自由基(ROS)积累的作用[28]。
2 脑出血后小胶质细胞炎症
2.1 损伤相关分子模式(DAMPs)与核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体 诱导脑出血后炎症的模式识别受体(PRRs)是一种传感器蛋白,其主要来源于胞膜和胞质的Toll样受体(TLR)和Nod样受体(NLR),机体主要通过PRRs而对内、外有害刺激进行识别。能与受体结合的分子及激活下游炎症通路的引发分子称为DAMPs[29],脑出血后产生的血红蛋白、凝血酶、血红素及凋亡细胞所释放的高迁移率族蛋白1等均属DAMPs,而其均可促进小胶质细胞活化并诱导炎症[30-32];此外,脑出血后产生的凝血酶和血红素还可激活小胶质细胞NLRP3炎性小体[31-32],而中枢神经系统损伤后小胶质细胞NLRP3炎性小体被激活可促进促炎性细胞因子白介素-1β(IL-1β)的分泌[33]并诱导炎症。NLRP3炎性小体是脑出血领域研究最多的炎性小体家族成员。目前,NLRP3炎性小体活化的经典双信号模型已被证实在脑出血NLRP3炎性小体途径中发挥着重要作用[29]:(1)启动信号模型:来源于微生物相关组件或细胞内源性因子的两类启动信号通过激活转录因子NF-κB而激活NF-κB通路并上调NLRP3及白介素-1β前体(pro-IL-1β)的表达;(2)激活信号模型:作为激活信号,多种刺激、多种分子或细胞事件可激活NLRP3炎性小体并完成NLRP3、凋亡相关斑点样蛋白(ASC)及半胱氨酸天冬氨酸蛋白酶-1(caspase-1)的组装,其中ASC是一个桥梁蛋白[34],可促进caspase-1生成并使其活化,而活化的caspase-1可使pro-IL-1β转化为成熟因子IL-1β并诱导炎症。最新研究表明,NLRP3和ASC本身可通过非炎性小体途径而发挥调节免疫作用[35]。
脑出血后小胶质细胞迅速活化并激活小胶质细胞中的炎性小体,而炎性小体激活是脑出血后主要炎症通路之一[29](见图2)。大量脑出血动物实验证实脑出血后炎性小体的产生与小胶质细胞有关,而NLRP3炎性小体可引发脑出血后无菌炎症[36]。有研究发现急性脑出血小鼠脑血肿周围与小胶质细胞共定位的NLRP3表达升高,且脑组织NF-κB/核因子kappa B抑制蛋白(IκBs)及下游分子环氧合酶2(COX-2)表达上调[37],而干扰小胶质细胞中NLRP3的表达可减轻血-脑脊液屏障破坏程度及炎性反应[38],这在一定程度上符合脑出血后NLRP3炎性小体活化的经典双信号模型。需要指出的是,有研究发现氯化高铁血红素可诱导体外小胶质细胞活化并使NLRP3、ASC、caspase-1进行组装,但体外培养的小胶质细胞所分泌的IL-1β及其前体并没有增加,这可能提示了启动信号模型并未完全启动,或是两种信号模型缺少了脑出血后某种机制的关联[31]。
既往研究表明,脑出血大鼠小胶质细胞活化后嘌呤能离子通道型受体7(P2X7R)蛋白会感知相关信号并促使小胶质细胞中烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NOX2)和一氧化氮合酶(iNOS)表达增多,进而导致过氧亚硝基阴离子(ONOO-)表达增加[39]。ONOO-是一种ROS,ROS作为一种激活信号[29]可使硫氧还蛋白结合蛋白(TXNIP)和硫氧还蛋白(Trx)解离并与NLRP3上相关受体蛋白结构域相互作用而诱发炎症[32]。最新研究表明,脑出血后小胶质细胞中miRNA-152表达减少,miRNA-152过量表达则可通过抑制ROS/TXNIP途径而抑制炎性小体活化[40]。此外,还有研究发现NLRP3 mRNA上存在miRNA-223可作用的靶点3'UTR,且miRNA-223可通过与靶点的结合而调节NLRP3的表达[41]。
2.2 脑出血后小胶质细胞极化介导的炎症 小胶质细胞是大脑组织的主要吞噬细胞,脑出血等引起脑损伤时活化的小胶质细胞发育成具有促炎作用的M1型和抗炎作用的M2型两种经典表型,即小胶质细胞极化(见图2),其中M1表型小胶质细胞可分泌IL-1β、肿瘤坏死因子α(TNF-α)、ROS等多种促炎性因子并引发脑出血后炎症[5,42]。有研究发现脑出血大鼠脑血肿周围可见活化的小胶质细胞且M1/M2表型小胶质细胞比值增高,之后72 h M1/M2表型小胶质细胞比值明显增高且M2表型小胶质细胞所占比例升高,此后血肿核心可检测到小胶质细胞极化;采用过氧化物酶体增殖物激活受体γ(PPARγ)激活剂对脑出血大鼠进行干预可激活M2表型小胶质细胞并促进脑出血后血肿消退[3,43]。
2.3 脑出血后小胶质细胞极化和炎性小体途径之间的关系小胶质细胞极化后产生的IL-1β、TNF-α、ROS等促炎性因子可继续激活其他小胶质细胞[44],其中ROS还可激活炎性小体途径[32,39]。LIN等[45]研究发现脑出血小鼠小胶质细胞活化,脑组织NLRP3表达升高,pro-IL-1β及IL-1β、M1表型小胶质细胞增多,而M1表型小胶质细胞可分泌IL-1β,炎性小体炎症通路也可产生IL-1β,但这之间是否有联系、NLRP3是否和M1表型小胶质细胞共定位等目前尚不清楚。体外模拟脑出血模型研究发现凝血酶可诱导小胶质细胞三重基序蛋白37(TRIM37)表达增加及自身活化,促进炎性因子IL-1β释放,但TRIM37是否与小胶质细胞极化及炎性小体途径有关尚不得而知[46]。
3 脑出血后小胶质细胞自噬与炎症的交互作用
自噬和炎症在机体多种病理生理过程中具有重要作用,越来越多的研究发现自噬和炎症并不是两个独立的过程,二者存在联系和平衡,了解其联系和平衡可能为疾病的靶向治疗提供参考[47]。近期研究发现诱导自噬可减轻疾病所致炎症,若自噬相关缺陷导致自噬活动减弱则可造成炎症进展[48],而小胶质细胞活化后产生的炎症与氧化应激均可诱导自噬[49]。

图2 脑出血后小胶质细胞炎症相关信号通路模式图Figure 2 Signaling pathway related to post-intracerebral hemorrhage microglia inflammation
3.1 自噬和小胶质细胞极化在脑出血后可能的交互作用有研究通过脂多糖诱导的小鼠小胶质细胞活化模型发现体外PPARγ拮抗剂T0070907可激活肿瘤抑制因子肝激酶B1-腺苷单磷酸活化蛋白激酶(LKB1-AMPK)通路并在促进小胶质细胞自噬的同时抑制其IKKβ/ NF-κB途径的激活[50],分别使用siRNA降低PPARγ和LKB1的表达均可使小胶质细胞M2蛋白标记物(CD206)表达增加而小胶质细胞M1蛋白标记物(CD86)表达减少,进而促进小胶质细胞M1表型向M2表型转化,证实小胶质细胞极化引起的炎症可诱导自噬,而自噬在调节小胶质细胞表型转化方面具有重要作用,脑出血后自噬可能通过改变小胶质细胞极化而发挥抗炎及修复作用;值得注意的是,多数研究是通过使用PPARγ激动剂而起到了激活自噬的作用[51-52]。
3.2 自噬和炎性小体途径在脑出血后可能的交互作用 一方面,自噬可启动相关炎症通路(如自噬后NF-κB信号通路激活[14,16]并促进 NLRP3 的组装[29,38])并可能通过对小胶质细胞M1表型向M2表型转化的调节而减少小胶质细胞促炎性因子(如ROS)的释放、抑制脑出血后NLRP3激活信号模型的激活[29,32,39];另一方面,小胶质细胞活化后可增强其自噬作用并造成NLRP3蛋白被泛素修饰,而被泛素修饰的NLRP3蛋白可通过自噬-溶酶体途径降解并抑制炎症,发挥中枢神经系统保护作用,但抑制小胶质细胞自噬后NLRP3炎性小体活化增多、中枢神经系统保护作用减弱[1]。此外,YOU等[2]研究还发现增强体外诱导的小胶质细胞自噬作用后小胶质细胞炎性小体相关炎性因子释放水平下降,在此基础上加用自噬抑制剂则其中枢神经系统保护作用被逆转。因此,脑出血后小胶质细胞自噬与炎症的关系可能并不单一,而是相互制约、相互促进的,但二者之间的平衡被打破则可能造成中枢神经系统损伤(见图3)。
4 小结与展望

图3 脑出血后小胶质细胞自噬与炎症交互作用的模式图Figure 3 The interaction between post-intracerebral hemorrhage microglia autophagy and inflammation
脑出血后小胶质细胞通过一系列信号通路启动自噬及炎症,虽然有证据表明小胶质细胞自噬和炎症可能会减轻脑出血后脑损伤,但小胶质细胞自噬和炎症会在一定程度上造成脑出血后脑损伤加重,而通过对小胶质细胞自噬和炎症进行干预及维持二者平衡有利于减轻脑出血后脑损伤。目前,虽有研究表明脑出血后小胶质细胞自噬和炎症信号通路之间存在类似靶点,但尚缺少进一步深入研究或干预研究,而这既是脑出血后小胶质细胞自噬和炎症领域研究难点,也是研究热点。此外,涉及脑出血后小胶质细胞自噬和炎症交互作用的相关研究报道较少,尚不能进行全面分析。鉴于已有动物模型研究证实相关药物干预脑出血后小胶质细胞自噬和炎症效果良好,因此,继续探索其他脑出血后小胶质细胞自噬和炎症信号通路、整合发现新的类似靶点并根据靶点研发新药物才能从真正意义上改善脑出血患者预后。
作者贡献:姚林进行文章的构思与设计,撰写论文;穆琼进行文章的修订,负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
文献检索策略:
检索数据库:中国知网、万方数据知识服务平台、PubMed、GeenMedical;检索关键词:脑出血,小胶质细胞,自噬,NLRP3炎性小体,小胶质细胞极化,炎症,intracerebral hemorrhage,microglia,autophagy,NLRP3 inflammasome,microglia polarization,interaction;检索时间截至2020年3月。文献纳入标准:(1)内容涉及小胶质细胞自噬对脑出血的调控;(2)内容涉及小胶质细胞炎症对脑出血的调控;(3)内容涉及小胶质细胞自噬和炎症交互作用对脑出血的调控;(4)语种限定为中文或英文。文献排除标准:(1)信息太少而无法利用和提取相关数据;(2)不能获取全文;(3)内容与脑出血后小胶质细胞自噬、炎症无关;(4)未公开发表或出版发行。

