癌症患者行超声引导改良塞丁格技术经锁骨下静脉置PICC 导管的对照研究
谷小燕,杨金芳,谢华琴,张亚琼
(1.湖北文理学院附属医院 襄阳市中心医院,湖北 襄阳;2.襄阳市第一人民医院,湖北 襄阳441021)
经外周静脉置入中心静脉导管(peripherally inserted central catheters,PICC)、 中心静脉导管(central venous catheter, CVC)、 植入式静脉输液港(venous port access,VPA)为癌症患者提供了长期、安全的静脉输液通道[1-3]。 临床上有部分癌症患者如双侧乳腺癌术后、合并类风湿性关节炎、肩周炎、肢体缺如等各种原因不宜留置PICC, 而VPA 费用较高不能普及, 因此,CVC 就成了此类患者静脉置管的最佳选择。因锁骨下静脉穿刺置管相较颈内静脉置管、股静脉置管具有便于维护、并发症少、患者耐受性好、不易污染等优点而成为CVC 的首选方式[4-5], 超声引导下经锁骨下静脉穿刺置管可在超声的“透视效应”下达到精准穿刺[5]。 当前临床普遍运用一次性使用中心静脉导管(CVC 导管)行锁骨下静脉穿刺置管,其在危重患者抢救、补液输血、营养支持、肿瘤化疗等治疗中发挥着重要的作用[2,5-6],由于CVC 导管外延管较长,为TPU 材料,材质较硬,加上导管的缝合固定等,患者舒适度较低[7],其相关性不良反应及非计划性拔管频频发生[6]。硅胶材质的PICC 导管柔软有弹性[8],可尾端修剪,我市某2 家三级甲等医院肿瘤治疗中心研究将PICC 导管用于癌症患者超声引导下锁骨下静脉置管,取得一定效果,现报道如下。
1 对象
选择2017 年1 月—2018 年12 月在我市某2家三级甲等医院住院行超声引导下锁骨下静脉置管的癌症患者为研究对象。 入选标准:(1)年龄>18 岁;(2) 患恶性肿瘤需周期性输注化疗药物等需要长期反复治疗者;(3)凝血功能正常;(4)患者强烈要求行锁骨下静脉置管或存在1 项不宜行PICC 置管的情况,如:双侧乳腺癌术后、合并类风湿性关节炎、双侧肩周炎、肢体缺如、腋下包块致上肢回流障碍、有外周血管手术史;双上肢感知运动功能障碍;(5)拟穿刺部位皮肤无感染、放疗、手术伤口;(6)锁骨下静脉→头臂静脉→上腔静脉走向无肿瘤压迫、 血管外科手术史及血管畸形狭窄;(7)配合研究并签署知情同意书。排除标准:(1)有上腔静脉综合征、血栓性疾病;(2)凝血功能异常;(3)因基础疾病需要使用抗凝药物者;(4)有精神疾病,或意识不清,语言表达障碍;(5)带管期间有使用抗菌药物者。 本研究经襄阳市中心医院医学伦理委员会和襄阳市第一人民医院医学伦理道德委员会批准(编号分别为:2016-127;KYLS2016103)
采用随机数字表法将患者分成对照组和观察组,观察组74 例,男43 例,女31 例;年龄26~77(51.44±13.28)岁;诊断:乳腺癌23 例,肺癌20 例,胃肠癌13 例,其他18 例;穿刺静脉:右锁骨下静脉70 例,左锁骨下静脉4 例;穿刺静脉内径11.60~20.10(15.62±4.78)mm,置管长度13.00~17.00(15.38±1.39)cm;凝血4 项结果:凝血酶原时间11.03~15.00(13.01±1.22)s,活化部分凝血活酶时间22.70~42.95(32.26±6.17)s,纤维蛋白原2.07~3.99(2.94±0.65)g/L,凝血酶时间测定14.11~19.98(16.97±1.58)s。 对照组74 例,男39 例,女35 例;年龄28~76(53.61±14.72)岁;诊断:乳腺癌21例,肺癌23 例,胃肠癌15 例,其他15 例;穿刺静脉:右锁骨下静脉72 例,左锁骨下静脉2 例;穿刺静脉内径11.90~20.20(15.74±4.32)mm,置管长度13.00~17.00(15.45±1.36)cm;凝血4 项结果:凝血酶原时间11.02~15.00(13.33±1.36)s,活化部分凝血活酶时间23.01~42.89(33.06±5.51)s,纤维蛋白原2.09~3.99(2.86±0.51)g/L,凝血酶时间测定14.07~19.76(16.12±1.01)s。 2 组患者性别、年龄、凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原、凝血酶时间测定、诊断、穿刺静脉、穿刺静脉内径、置管长度的比较,差异均无统计学意义(P>0.05),具有可比性。
2 方法
2.1 操作者及置管材料 本研究的置管操作均由固定的2 名具有麻醉医师执业资格者操作完成,这2 名麻醉医师硕士学位, 均接受过血管超声相关知识、 塞丁格技术置管及改良塞丁格技术置管的培训与考核, 有5 年以上超声引导下锁骨下静脉置管工作经验,以减少因操作手法和技术带来的误差。所有的置管操作前均进行充分的风险评估, 所有患者均签署置管知情同意书。 PICC 导管材料选择为山东百多安公司的三向瓣膜式经外周穿刺中心静脉导管套装,CVC 材料选择珠海福尼亚医疗设备有限公司生产的CVC-1 型14G 20 cm 一次性使用中心静脉导管包,所有患者均使用山东百多安公司BA-50 便携式多普勒彩色超声仪引导穿刺。
2.2 操作方法
2.2.1 观察组 癌症患者置入PICC 导管, 采用超声引导下改良塞丁格技术经锁骨下静脉置管[9]。 (1)摆体位;(2)确定穿刺点:用血管超声仪评估拟穿刺侧锁骨下静脉, 确定穿刺点并在穿刺点部位用记号笔做上标记;(3)预测置管长度:从标记点至右胸锁关节再向下至第三肋间的距离+2 cm;(4)消毒铺巾;(5)穿刺送引导导丝;(6)扩皮;(7)送入血管鞘;(8)送管:导管送至预测置管长度后,需要将多余导管修剪掉,由于安装连接器时有2 cm 导管被接入了连接器,另需1 cm 便于导管体外部分U 形摆放固定,因此修剪导管时体外需要保留导管至少3 cm;(9)导管定位:行X 线胸部正位片检查,确认导管尖端位置。
2.2.2 对照组 患者置入CVC 导管,采用超声引导下塞丁格技术行锁骨下静脉置管。在观察组基础上,当静脉穿刺成功送入导丝并退出穿刺针后,扩皮,将扩张管套沿引导导丝扩张穿刺点的皮肤及皮下组织,退出扩张管,将CVC 导管套入导丝并送入,待导管进入锁骨下静脉后,边送导管边退引导导丝,直至将导管送至预定置管长度,同观察组方法排除导管颈内静脉异位,连接输液接头,于距离穿刺点0.8~1 cm处连接导管固定夹并与皮肤缝合,穿刺点加压贴膜固定,X 线胸片定位,记录。
2.3 评价标准 (1)比较2 组置管操作时间。 局部麻醉开始至置管成功贴膜固定所需时间为置管操作时间;(2)比较2 组带管并发症发生情况。 带管并发症包括穿刺点感染、 导管脱出、 锁骨下静脉血栓形成、导管堵塞。 穿刺点感染判断标准:导管入口处轻者出现红肿、硬结,重者出现脓性分泌物[10]。 脱管:导管体内部分滑出体外。锁骨下静脉血栓诊断标准:伴或不伴锁骨下部位肿胀、发红、触痛,多普勒超声检查见锁骨下静脉实质性低回声团块, 静脉管腔明显扩张,探头挤压不塌陷,未见明显血流信号[9]。 堵管判断标准: 既不能输入液体也不能抽出回血或能够输入液体但输液速度减慢不能抽出回血[11]。 (3)比较2 组非计划拔管率。 非计划拔管是指在患者预定的治疗尚未结束时,由于各种原因(包括意外过失)导致的导管不能再继续使用,必须提前将其拔除[12]。
2.4 统计学方法 所有数据采用SPSS 19.0 进行统计分析,符合正态分布计量资料以±S 表示,比较采用两独立样本t 检验, 计数资料比较采用χ2检验,以P<0.05 为差异有统计学意义。
3 结果
3.1 2 组锁骨下静脉置管的癌症患者置管操作时间的比较 2 组癌症患者超声引导锁骨下静脉穿刺均1 次成功,置管成功率均100%;观察组锁骨下静脉置管的癌症患者置管操作时间短于对照组, 差异有统计学意义(P<0.01)。 见表1。
表1 2 组锁骨下静脉置管的癌症患者置管操作时间的比较(±S,min)
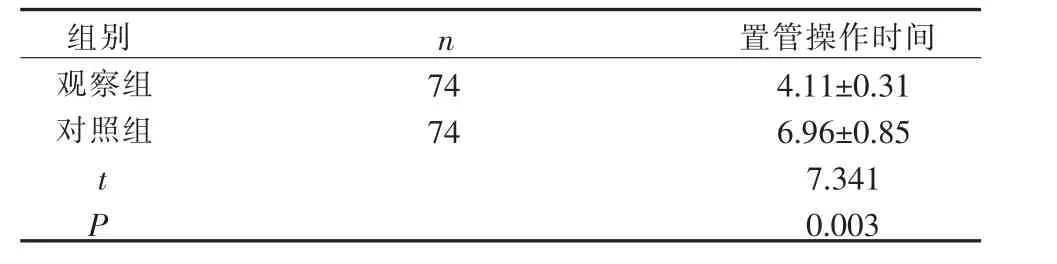
表1 2 组锁骨下静脉置管的癌症患者置管操作时间的比较(±S,min)
组别 n 置管操作时间观察组 74 4.11±0.31对照组 74 6.96±0.85 t 7.341 P 0.003
3.2 2 组锁骨下静脉置管的癌症患者带管并发症发生情况的比较 观察组锁骨下静脉置管的癌症患者锁骨下静脉血栓、穿刺点感染率、导管脱出率、导管堵塞率低于对照组,差异有统计学意义(P<0.01)。 见表2。
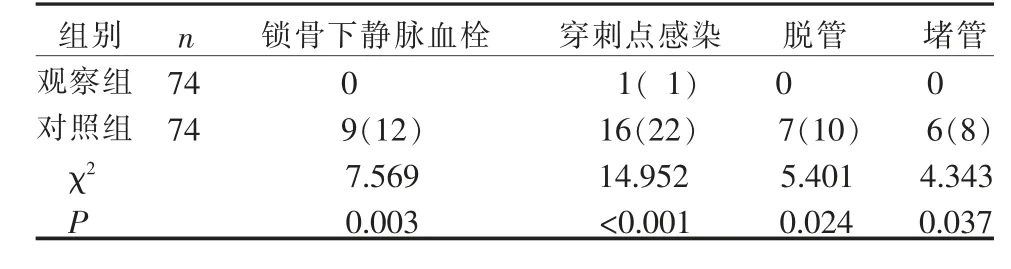
表2 2 组锁骨下静脉置管的癌症患者带管并发症发生情况的比较(例,%)
3.3 2 组锁骨下静脉置管的癌症患者非计划拔管率的比较 观察组锁骨下静脉置管的癌症患者非计划性拔管率低于对照组,差异有统计学意义(P<0.01)。见表3。
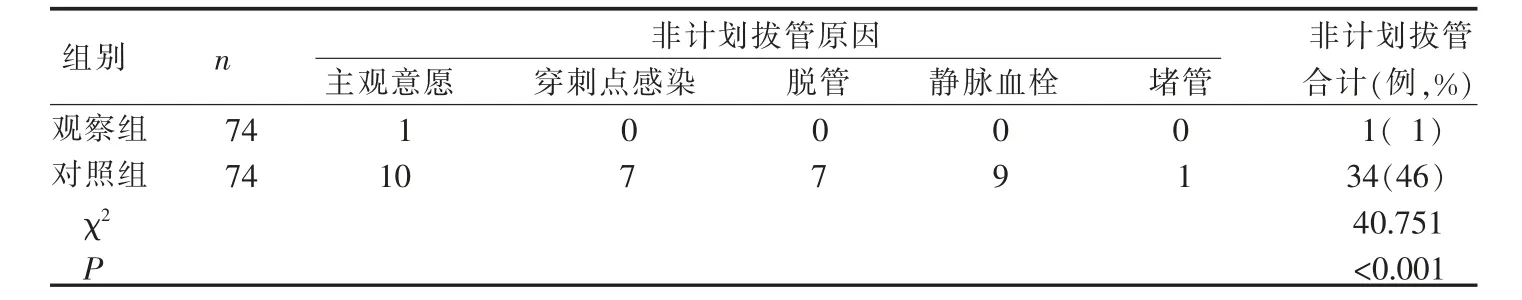
表3 2 组锁骨下静脉置管的癌症患者非计划拔管率的比较
4 讨论
4.1 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能缩短置管操作时间 本研究结果显示, 观察组锁骨下静脉置管的癌症患者置管操作时间短于对照组(P<0.01)。究其原因,对照组所采用的置管方法为塞丁格技术,即引导导丝送入成功后,用扩张管套沿引导导丝扩张穿刺点的皮肤及皮下组织,退出扩张管,然后将CVC 导管套入引导导丝并送入[4],此时没有一个开放的通道供CVC 导管送入,皮下组织对导管的送入将产生阻力,导管需要在导丝的引导作用下依赖操作者的助推力和自身的韧性通过皮下组织进入血管, 实际操作过程中常由于CVC 导管前端较柔软韧性不足而难以将导管一次性轻松通过皮下组织而送入血管, 需要反复用力尝试送管,延长了置管操作时间,此外,在导管送至预定刻度后,安装导管固定夹以及缝合操作均会耗费操作时间,本研究中对照组置管操作耗时(6.96±0.85)min,用时较长。 观察组所采用的置管方法为改良塞丁格技术,即引导导丝送入成功后,沿引导导丝送入带扩张器的可撕裂血管鞘,退出扩张器及引导导丝后,经鞘管送入导管[9],此时鞘管在皮肤与血管之间建立了一个开放的通道,导管送入过程中无阻力,可顺利送入导管[13],且导管送入后仅需修剪导管和安装连接器,无需缝合,省时省力,置管操作用时仅(4.11±0.31)min,与对照组比较,其置管操作时间明显缩短。
4.2 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能减少穿刺点感染率 本研究结果显示,对照组出现穿刺点感染16 例,观察组仅出现1例穿刺点感染,2 组比较差异有统计学意义(P<0.01)。导管尖端位置的准确对导管的安全留置和有效使用至关重要,导管过深,可引发心律失常、心脏压塞等,导管过浅,易致导管异位、药物或机械性静脉炎、静脉血栓形成等, 导管尖端位于上腔静脉下1/3 处为佳, 体表测量置管长度的方法为从穿刺点至右胸锁关节再向下至第三肋间的距离[11],因此,患者的置管长度是依据实际测量所得。CVC-1 型14G 一次性使用中心静脉导管长度为20 cm,其为一体式导管,导管前端为圆弧设计,长度一定,不能修剪,置管后多会出现导管外露,为防止外露导管滑入体内或脱出,在距离穿刺点0.8~1 cm 处常连接导管固定夹并与皮肤缝合固定,此导管固定夹为两部分卡扣而成,其卡扣咬合面缝隙及与皮肤接触面均成为维护死角,容易滋生细菌, 易致穿刺点感染。 为尽可能的提高CVC 导管的消毒效果,每次维护时均需向上牵拉外延管以抬高固定夹, 方便含消毒剂的棉球进入固定夹与皮肤接触面之间擦拭消毒, 反复的牵拉外延管以及棉球进入固定夹下方的擦拭消毒, 易致固定夹与皮肤之间的缝合裂开。缝合裂开后,每次维护消毒时均需翻转固定夹,因固定夹体积较大,翻转幅度也相对较大,极易引起导管在穿刺点处进出,容易引起穿刺点感染,甚至菌血症[14]。 而应用PICC 导管行锁骨下静脉置管后, 外露部分仅有1 cm 导管和连接器,连接器表面光滑、无缝隙、无维护死角,消毒效果有保障, 每次维护消毒时翻转连接器对导管深浅无影响。
4.3 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能减少静脉血栓形成 本研究结果显示,对照组锁骨下静脉血栓形成9 例,观察组无静脉血栓形成,2 组锁骨下静脉血栓形成率比较差异有统计学意义(P<0.01)。 导管的材质也是患者静脉血栓形成的影响因素, 使用材质相对较硬的导管,血管内皮机械损伤的严重程度较高,静脉内膜受损可致静脉壁的炎性反应,释放炎性因子,引起炎症细胞因子TNF-α、IL-6 水平变化,参与激活凝血酶原,诱发静脉血栓形成, 聚氨酯材质导管相较硅胶材质导管硬[15-16],有研究表明聚氨酯导管机械性静脉炎、静脉血栓发生率高于硅胶导管[17],有研究报道,应用聚氨酯导管其血栓性静脉炎发生率为70%, 硅胶管为20%[15],本研究中PICC 导管为硅胶材料制成,材质柔软,导管外露1 cm,每次维护消毒时翻转连接器对穿刺点无机械刺激,组织相容性好,导管表面行抗血栓处理,可降低血小板粘附和防止血栓形成,而CVC 导管为聚氨酯材料制成,材质较硬,静脉血栓形成率会增加, 同时上述固定夹与皮肤的缝合裂开后,每次维护翻转固定夹引起导管反复进出穿刺点,也易引起细菌性或/和机械性静脉炎、静脉血栓[14]。此外,本研究中CVC 导管外径为1.75 mm,PICC 导管外径为1.4 mm,对照组和观察组患者锁骨下静脉直径为分别为(15.74±4.32)mm、(15.62±4.78)mm,虽然2 组导管-静脉比均<45%,但导管直径的大小是静脉血栓发生的重要危险因素,置入的导管直径与静脉血栓发生率呈正相关[15]。 因此,从导管材质和导管直径方面来讲,观察组静脉血栓形成率与对照组相比处于优势地位。
4.4 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能减少导管脱出率 本研究结果显示,观察组无脱管发生,对照组脱管7 例,2 组脱管率比较差异有统计学意义(P<0.05)。 体外导管较长,患者活动、翻身、穿脱衣物都会对导管造成牵绊,必然影响导管的携带质量。本研究观察组所使用的百多安公司PICC 导管为尾端修剪式导管,导管总长60 cm,置管后导管修剪保留3 cm,安装连接器时2 cm 导管被接入连接器内,实际导管外露1 cm,连接器长度4.5 cm,因此导管体外长度就包含连接器长度+导管外露长度等于5.5 cm,导管体外长度较短,连接器体积小且轻便,固定简单牢固,不易脱管,不影响美观和舒适度,日常生活、活动对导管的携带也无影响。 CVC 导管长度为20 cm,外延管长14 cm,本研究中对照组平均置管长度为(15.45±1.36)cm,平均导管体外长度即外延管长度+导管外露长度为(18.62±1.39)cm。导管体外部分较长,重量相对较重,患者活动、翻身、穿脱衣物时对导管的牵绊, 又由于上述固定夹与皮肤的缝合裂开后, 导管的初步固定作用丧失, 极易引起脱管。
4.5 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能降低导管堵塞率 本研究结果显示观察组带管过程中无导管堵塞发生, 对照组出现导管堵塞6 例,2 组导管堵塞率比较差异有统计学意义(P<0.05)。癌症患者血液呈高凝状态,留置导管期间常发生导管堵塞[18],据国外文献报道,深静脉导管堵塞的发生率高达21.37%[19], 导管堵塞易致非计划拔管,影响患者治疗,增加患者再次穿刺的痛苦和医疗费用[20]。 咳嗽、恶心呕吐、用力排便等均导致胸腔内压力增高,静脉压高于深静脉导管内压力,可使血液返流[18],此外导管长期漂浮于血管中,影响血液循环,血液冲击导管的前端,形成涡流也易导致血液反流入导管[21],本研究中CVC 导管为前端开口式导管,导管前端持续开放,不具备避免血液反流功能,上述原因极易导致血液反流入导管内,形成血凝性堵管,而本研究中PICC 导管为三向瓣膜式导管,导管的末端是密闭式结构,侧壁开口,瓣膜向外打开即可入药,无操作时瓣膜呈自动关闭状态,能有效防止血液反流[22],可明显减少堵管发生率。 但频繁咳嗽、顽固性恶心呕吐等导致胸腔内压力急剧增大,仍可导致上腔静脉血液进入导管,引起血凝性堵管。 1项不同导管对并发症发生影响的系统评价结果显示,三向瓣膜式导管的堵塞发生率明显低于末端开口导管[17],有研究显示PICC 导管同CVC 导管相比,其留置时间长,不需要肝素封管,可有效防止导管堵塞,减少了护理工作量和治疗费用[23]。
4.6 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能降低非计划拔管率 临床不建议拔除功能良好且有使用需求的静脉导管[24],预防非计划拔管是医院护理安全管理的重要内容[12]。 主观意愿及客观因素是静脉导管非计划拔管的主要原因,主观意愿包括局部不适、维护繁琐、影响日常活动、影响外观等, 客观因素为各种并发症, 包括导管脱出、静脉血栓、穿刺点感染、堵管等[25]。 体外导管的长短对导管的固定、携带效果都会产生影响,对照组的体外导管较长,维护时需要粘贴的胶布较多,连同体积较大的导管固定夹, 影响美观的同时患者的舒适度也下降,同时较长的体外导管也会影响患者活动、翻身、穿脱衣物的自由度,此外,并发症的高发增加了患者生理、 心理和经济负担, 其从主观意愿上对CVC 导管产生了排斥, 对照组10 例患者自诉CVC导管体外部分较长且硬,长期携带不舒适、不美观,对日常生活影响较大, 其中有的患者导管曾经出现过并发症,担心再次出现并发症,以致心情烦躁、焦虑,主观意愿强烈要求拔管,心理疏导、劝解无效,经主管医生及护士长、 责任护士综合评估分析认为CVC 导管带给患者的痛苦大于其优势,最终同意并予以拔管。各种并发症是非计划拔管的直接原因,对照组7 例导管意外全部脱出,9 例静脉血栓患者经抗血栓治疗后拔管,7 例穿刺点感染者由于患者免疫力低、 汗液较多等原因局部抗感染处理效果不佳予以拔管,1 例堵管再通失败拔管,最终本组非计划拔管率46%。 观察组体外导管较短,维护简单,易于固定,对患者日常生活、活动和美观度、舒适度无明显影响,仅有1 例患者因身体虚弱,不便往返医院维护而要求拔管,本组非计划拔管率仅1%,明显低于对照组,差异有统计学意义(P<0.01)。
利用超声技术可进行血管定位,观察血管内径、深度、走向、血流及血管变异等,可实时引导穿刺针稳、准、快、好地完成静脉穿刺[26],本研究在超声引导下行锁骨下静脉置管,结果所有患者均1 次静脉穿刺成功,无出血血肿、血气胸等穿刺并发症。 研究显示, 超声引导改良塞丁格技术经锁骨下静脉置PICC 导管,能明显缩短置管操作时间,减少带管并发症发生率及非计划拔管率, 值得临床借鉴应用。PICC 导管材料费用较CVC 高,但对照组带管并发症及非计划拔管率较高,本研究的不足之处在于未对处理并发症及非计划拔管后再次置管等护理成本进行核算,拟在下一步的研究中探讨。

