棉花黄萎病菌VdHP1的克隆及功能分析
孙琦,何芳,邵胜楠,刘政,黄家风
棉花黄萎病菌的克隆及功能分析
孙琦,何芳,邵胜楠,刘政,黄家风
(石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用重点实验室,新疆石河子 832003)
【】明确棉花黄萎病菌(大丽轮枝菌)中一个新基因()的功能,为解析棉花黄萎病菌的致病机制以及棉花黄萎病的防治提供依据。以大丽轮枝菌野生型菌株V592的基因组DNA和cDNA为模板,对全长进行克隆并测序;利用逆转录实时荧光定量PCR(RT-qPCR)分别对棉花根系诱导不同时间的表达量及V592菌株不同组织中的表达量进行测定;构建针对的敲除载体、互补载体和过表达载体,通过农杆菌介导的遗传转化筛选基因敲除突变体、互补菌株和过表达菌株;以野生型菌株V592为对照,对基因敲除突变体及互补菌株的菌落及菌丝形态进行观察,并对微菌核量、产孢量及致病力进行测定;通过RT-qPCR测定其他致病力相关的基因在基因敲除突变体及过表达体菌株中的表达情况。全长为862 bp,预测编码蛋白含268个氨基酸,与GenBank中已注释的基因没有任何的序列相似性。野生型菌株V592受棉花根系诱导6—12 h时表达水平显著上调,表明在大丽轮枝菌侵染早期发挥作用。在分生孢子中的表达量显著高于在菌丝和微菌核中的表达量,表明在大丽轮枝菌不同组织中的表达具有差异性。与野生型菌株V592相比,基因敲除突变体产孢量和产孢梗显著减少,菌丝分支呈螺旋状,对棉花的致病力明显下降。与侵染钉形成相关基因(、、)、分泌蛋白释放相关基因()及分生孢子产生相关基因(、、、、、、)在基因敲除体中的相对表达量显著下调,在过表达菌株中上调;而与黑色素合成相关基因(、、、)在基因敲除突变体中则显著上调,在过表达菌株中下调。与大丽轮枝菌分生孢子和产孢梗的产生有关,参与大丽轮枝菌致病;对与侵染钉形成、分泌蛋白释放及分生孢子产生相关基因的表达具有正调控作用,对黑色素合成相关基因的表达具有负调控作用。
棉花黄萎病;大丽轮枝菌;;产孢;致病力;转录表达
0 引言
【研究意义】棉花黄萎病(cotton verticillium wilt)是威胁我国棉花生产的一种重要土传病害,由大丽轮枝菌()引起[1]。目前有关该病原菌致病机制的解析尚不全面,加之其特殊的存活方式,黑色微菌核可在土壤中存活多年,使得依赖传统方法进行防治难以奏效[2]。因此,通过基因功能鉴定找到调控大丽轮枝菌致病机制的关键因子,对全面解析大丽轮枝菌致病机制,以及利用靶基因进行棉花抗病育种和探索新型防治方法具有重要的理论价值。【前人研究进展】近年来有关大丽轮枝菌致病相关基因及致病机制的研究取得了较大进展,大致分成4种情况:第1类基因编码效应子蛋白,通过干扰或阻止植物免疫过程参与致病,如编码的聚多糖脱乙酰酶,通过对真菌细胞壁组分几丁质寡糖进行脱乙酰作用,阻止几丁质寡糖触发免疫信号传递,进而抑制寄主的免疫反应[3];编码的分泌蛋白直接作用于调节植物免疫的转录因子以阻止植物的免疫反应[4];此类效应子蛋白还有VdNLP1、VdNLP2[5-6]和VdCUT11[7]。第2类基因通过形成侵入结构或分泌结构参与致病,如和编码的蛋白复合体定位于附着枝细胞膜,通过促进胞质内活性氧和钙离子的积累激活VdCrz1转录因子及钙离子信号途径,从而调控附着枝分化形成侵染钉,/基因敲除导致附着枝不能形成侵染钉,进而使大丽轮枝菌丧失致病力[8];VdSep5蛋白在侵染钉与其侵入寄主后的侵染性菌丝之间形成一种环状结构,即在大丽轮枝菌与寄主互作界面形成菌丝颈环用于分泌蛋白的释放和输出[9]。第3类基因编码转录因子,这类基因通常不仅影响致病力,也参与大丽轮枝菌的产孢、微菌核(或黑色素)形成,如转录因子基因和敲除后分别影响大丽轮枝菌的穿透能力和在寄主体内的定殖,并导致大丽轮枝菌产孢量下降、微菌核减少,进一步研究发现,SOM1和VTA3共同调控与产孢、微菌核形成及毒力相关基因的表达[10];Vdpf转录因子通过cAMP依赖信号途径和G蛋白信号途径调控大丽轮枝菌黑色素形成、并且还通过调控与产孢及毒力相关基因的表达影响大丽轮枝菌的致病力和产孢量[11];此类转录因子还有VdSge1、VdCmr1、VdHapX等[12-14]。第4类基因通过信号途径参与大丽轮枝菌致病,同时也参与分生孢子、微菌核或黑色素的形成过程,如MAPK信号途径中编码的跨膜蛋白与Vst50-Vst7-Vst11蛋白模块共同调控大丽轮枝菌黑色素形成和穿透能力,黑色素含量与大丽轮枝菌的穿透能力密切相关[15];此外,该信号途径中的、、分别敲除均导致大丽轮枝菌致病力下降并伴随产孢量下降和微菌核减少[16-18];又如和分别通过cAMP依赖信号途径和G蛋白信号途径对大丽轮枝菌的致病力、产孢量和微菌核形成产生影响[19-20]。综上所述,参与大丽轮枝菌致病的基因很多,致病机制复杂,各基因参与的途径之间相互作用,共同决定了大丽轮枝菌对寄主的致病作用。【本研究切入点】笔者课题组从前期已构建的大丽轮枝菌T-DNA插入突变体库中筛选到一株致病力显著下降的突变菌株,通过鉴定发现,被插入突变的基因是VDAG_07100基因,其预测编码蛋白(hypothetical protein)没有功能注释,因此将其命名为。除了影响大丽轮枝菌的致病力外,其他生物学功能尚不明确。【拟解决的关键问题】从大丽轮枝菌强致病力菌株V592中克隆,并对在棉花根诱导条件下的转录表达及不同组织中的转录表达进行分析;通过获得的敲除突变体菌株、互补菌株和过表达菌株,研究该基因对大丽轮枝菌生长发育、致病力及对其他致病相关基因的影响,明确的生物学功能。
1 材料与方法
试验于2018年6月至2019年8月在新疆石河子大学新疆绿洲农业病虫害治理与植保资源利用重点实验室完成。
1.1 材料
1.1.1 菌株和质粒 大丽轮枝菌V592菌株由本实验室分离、鉴定并保存。p克隆载体购自TaKaRa公司。敲除载体p和过表达载体p由中国科学院微生物研究所郭惠珊研究员惠赠。互补载体p由本实验室构建并保存。
1.1.2 植物材料 棉花品种为感病品种军棉1号。
1.2 VdHP1的克隆与测序
参考宋雯等[21]的方法,利用真菌DNA提取试剂盒(BioFlux)及Trizol(QIAGEN)法分别提取V592菌株的DNA和RNA;用反转录试剂盒(TaKaRa)将RNA反转录成cDNA。根据大丽轮枝菌VdLs.17菌株的VDAG_07100基因序列(NCBI),设计引物full-F(5′-ATGCGTTTCTTCGCCTTTTT-3′)和full-R(5′-TAGTCCATTCTGATCCATGT-3′),分别以V592的DNA和cDNA为模板扩增的全长和CDS序列并测序。
1.3 VdHP1在大丽轮枝菌中的表达
1.3.1 棉花根诱导条件下的表达 挑选粒大饱满的军棉1号种子,剥去种皮后置于0.1%的升汞溶液中消毒处理30 min,用清水漂洗3遍,放入装有40 mL MS培养基的三角瓶中,暗培养7 d。待根长至5—10 cm时剪取2 g棉花根段,添加至100 mL Czapek-Dox液体培养基中;再将PDA上培养7 d的V592菌株,取10个直径1 cm的菌饼加入,分别在26℃、200 r/min培养2、4、6、8、10、12、24和48 h;分别以未加棉花根系在同样条件下培养的V592菌株为阴性对照;剔除棉花根段,参照方法1.2,提取各菌株的总RNA并反转录成cDNA;按照SYBR(Life Technologies)试剂盒说明添加样品,通过qPCR反应分析受棉花根系诱导后的表达特征。qPCR反应在7500实时PCR系统(Life Technologies)中完成,以作为内参基因对目标基因的转录水平进行标准化,每种菌株设3次生物学重复,每个反应设3次重复,根据2-ΔΔCt方法进行数据处理,再利用SPSS 17.0软件进行统计分析。
1.3.2在大丽轮枝菌不同组织中的表达 参考王春巧等[22]的方法,分别收集V592菌株的菌丝体、分生孢子和微菌核,提取各组织的总RNA并反转录成cDNA,利用上述qPCR方法分析在不同组织中的表达情况。
1.4 载体构建及真菌转化
构建针对的敲除载体,先用引物up-F和up-R从V592菌株的基因组中扩增基因上游780 bp片段,再用引物down-F和down-R从V592基因组DNA中扩增基因下游782 bp片段。将获得的2个目标片段与Ⅰ线性化的敲除载体通过多片段重组酶(Vazyme)进行重组构建敲除载体p,再将其通过ATMT方法转化V592菌株的分生孢子。将获得的转化子参考Wang等[23]的PCR方法进行初步筛选。再分别用的特异引物U和L,及的特异引物full-F和full-R对转化子进行再次筛选。为了获得互补菌株,用引物EC-F和EC-R从V592菌株的基因组DNA中扩增基因编码区全长,将其插入到I/H I线性化的互补载体中,通过ATMT转化基因敲除突变体,对转化子用抗生素G418和PCR方法进行筛选。为了获得基因过表达菌株,用引物对OE-F和OE-R从V592菌株中扩增基因编码区全长,插入到I/I线性化的p载体中。然后通过ATMT方法将该载体转化V592菌株。最后,用引物-qPCR-F和-qPCR-R通过RT-qPCR对目标基因在野生型菌株、敲除突变体菌株、互补菌株和过表达菌株中的转录表达进行确定。载体构建所用引物见表1。

表1 载体构建所用引物
1.5 VdHP1基因敲除突变体生物学性状的测定
基因敲除突变体的菌落形态、产孢量及微菌核产量参考宋雯等[21]的方法进行测定;菌丝的显微观察:将真菌在PDA平板上划线,再将灭菌的盖玻片斜插到划好的线上,26℃暗培养3 d,取出盖玻片在显微镜下观察菌丝生长情况。玻璃纸穿透试验:参考Zhao等[8]的方法将灭菌玻璃纸平铺在MM基本培养基上,用牙签挑取菌丝接种至玻璃纸中央,分别培养3、4、5、6和7 d揭去玻璃纸,继续培养7 d观察真菌穿透玻璃纸后的菌落形成情况。每个菌株设3个重复。
1.6 致病力测定
将棉苗在MS液体培养基中培养至4—5片真叶展开时[21],参照Gao等[24]的无伤浸根接种法用浓度为1×107cfu/mL的孢子悬浮液进行接种,每个菌株接种3个营养钵,每个营养钵12棵棉苗。参考Zhang等[25]的方法进行病情指数统计。
1.7 利用qPCR测定感病植株中真菌生物量
对接种28 d的棉花分别提取根、茎、叶的总DNA,通过qPCR测定其中大丽轮枝菌的生物量。qPCR所用引物ITS-F和ITS-R基于核糖体RNA的ITS1和ITS2区设计[25]。每个反应设3个重复。qPCR反应及数据处理与同1.3.1。
1.8 其他致病相关基因在VdHP1基因敲除突变体中的表达量测定
通过RT-qPCR对大丽轮枝菌其他致病相关基因在野生型菌株V592、敲除突变体和互补菌株中的转录水平进行测定。被检测的致病相关基因及其引物见表2,每个反应设3个重复。RT-qPCR反应及数据处理同1.3.1。
2 结果
2.1 VdHP1克隆
分别以大丽轮枝菌野生型菌株V592的基因组DNA和cDNA为模板,通过克隆测序得到全长为862 bp,预测编码蛋白的cDNA为807 bp,序列分析显示,该基因由2个外显子和1个内含子组成,编码268个氨基酸。的预测编码蛋白与大丽轮枝菌VdLs.17同源基因编码的氨基酸序列相似性为98.95%,与非苜蓿轮枝菌()的D7B24_004502基因编码的氨基酸序列相似性为94.90%,与苜蓿轮枝菌(.)的VDBG_05451基因编码的氨基酸序列相似性为94.48%,而与其他真菌没有任何氨基酸序列相似性;在GenBank中进行检索,与已注释的基因没有任何序列相似性。上述结果表明是轮枝菌属所特有的基因。
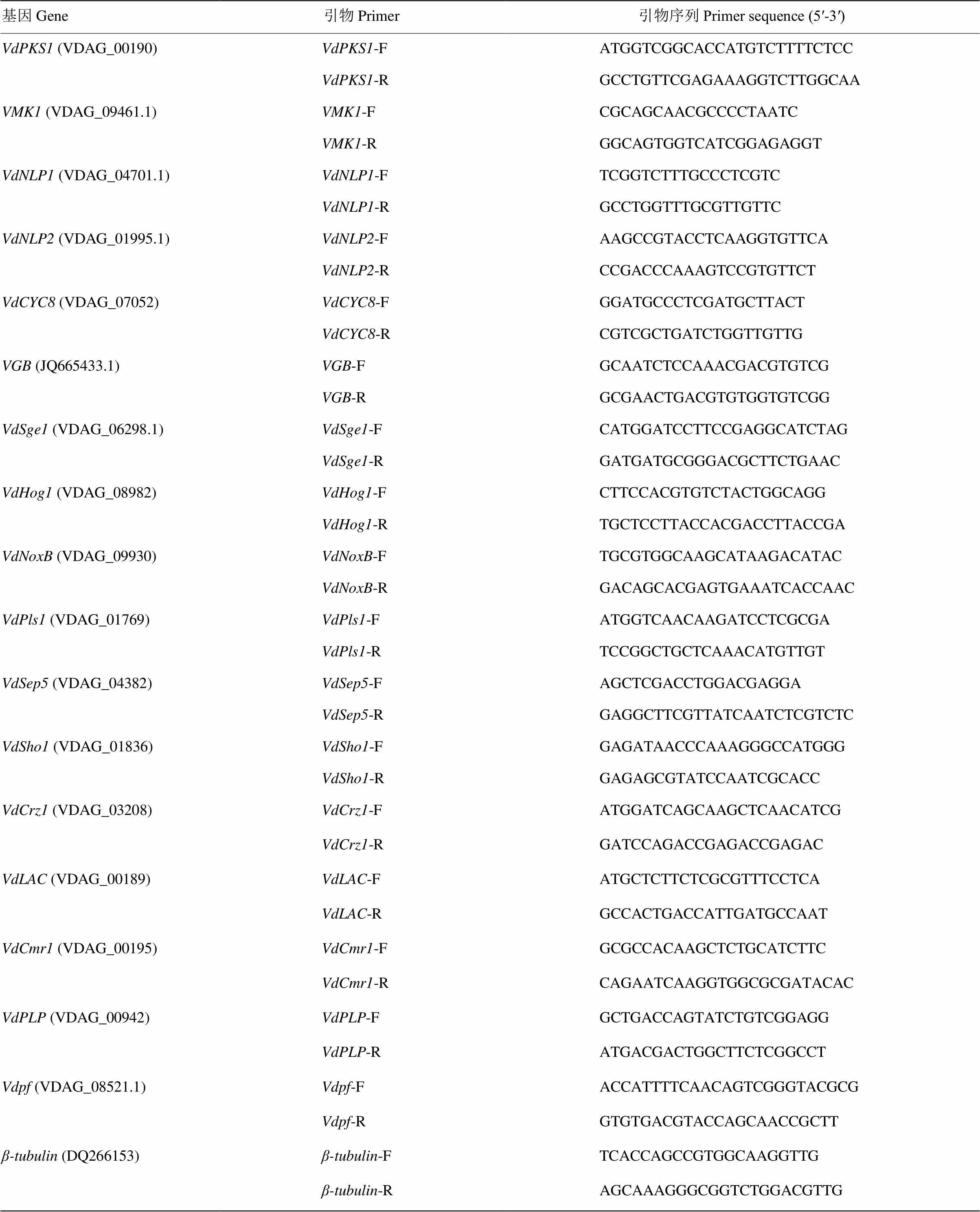
表2 被检测的致病相关基因及其引物
2.2 VdHP1在大丽轮枝菌中的表达分析
通过RT-qPCR测定受棉花根系诱导后的表达特征,结果显示V592菌株受棉花根系诱导培养6 h后的表达水平呈现剧烈上调,10 h达到最大值,12 h后转录表达水平显著下降(图1-A),表明可能在大丽轮枝菌侵染早期发挥作用。
对在大丽轮枝菌不同组织中的转录表达水平进行测定,结果发现在分生孢子中的表达量最高,分别是菌丝和微菌核中的14倍和28倍(图1-B),表明在大丽轮枝菌中的表达具有组织差异性。
2.3 VdHP1基因敲除突变体和互补菌株的筛选
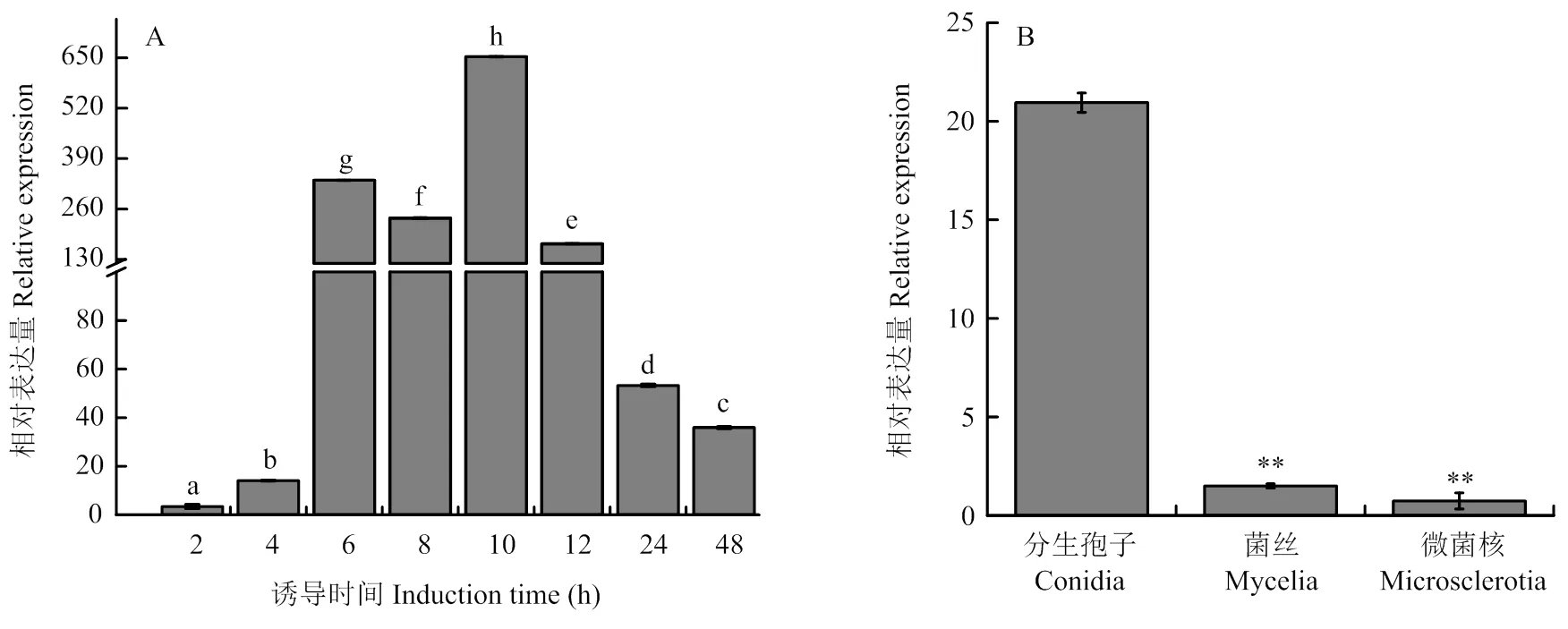
以野生型菌株V592为对照,将PCR初步筛选获得的2个敲除突变体和互补菌株用2对特异引物进行再次确认,结果如图2-B所示,用的特异引物只能从2个敲除突变体(和)中扩增出457 bp的基因片段,用的特异引物只能从V592菌株和2个互补菌株(和)中扩增出862 bp全长。上述结果表明在基因组水平上,敲除突变体中已被成功取代,互补菌株中得到回补。再对敲除突变体和互补菌株中的的转录表达进行测定,结果如图2-C所示,在2个敲除突变体和中几乎不表达,而在互补菌株和中的表达恢复至野生型菌株水平,因此从转录水平再次表明,在和中被成功敲除,在互补菌株和中得到互补。
A:V592菌株被棉花根系诱导后VdHP1的转录表达VdHP1 transcriptional expression in V592 strain induced by cotton roots;B:VdHP1在V592菌株不同组织中的转录表达VdHP1 transcriptional expression in different tissues of V592 strain
A:VdHP1基因敲除载体构建图Strategy diagram of VdHP1 knockout vector construction;B:利用特异引物对目标基因VdHP1进行PCR检测Specific primers were used to detect VdHP1 by PCR;C:利用RT-qPCR对VdHP1的转录水平进行确定Confirmation of transcriptional expression of VdHP1 by RT-qPCR analysis
2.4 VdHP1基因敲除突变体表型特征的观察
在PDA培养基上,基因敲除突变体与V592菌株和互补菌株一样形成典型的菌核型菌落,菌落生长速度也无明显差异(图3-A),说明基因敲除不影响大丽轮枝菌的菌落生长。将等量分生孢子接种在营养缺乏的培养基上诱导微菌核的形成,接种14 d后,2个基因敲除突变体的微菌核干重和湿重与V592菌株和2个互补菌株相比也无明显差异(图3-B),表明不参与大丽轮枝菌微菌核的形成。
2.5 VdHP1基因敲除突变体产孢量的测定
与V592菌株相比,2个敲除突变体和的产孢量明显减少(图4),在接种第7 天时,和的产孢量分别是V592产孢量的46.62%和45.00%;而2个互补菌株和的产孢量恢复至野生型菌株的水平,表明参与大丽轮枝菌分生孢子的产生。
2.6 VdHP1基因敲除突变体菌丝形态观察
显微观察结果显示,与野生型菌株V592相比,2个基因敲除突变体分支菌丝呈现螺旋状,产孢梗减少;而互补菌株和的菌丝体形态和分生孢子梗恢复至野生型水平(图5)。表明与大丽轮枝菌菌丝形态及产孢梗的形成有关,突变体产孢量的减少可能与产孢梗减少有关。

图5 显微镜下菌丝的形态特征
2.7 VdHP1基因敲除突变体致病力测定
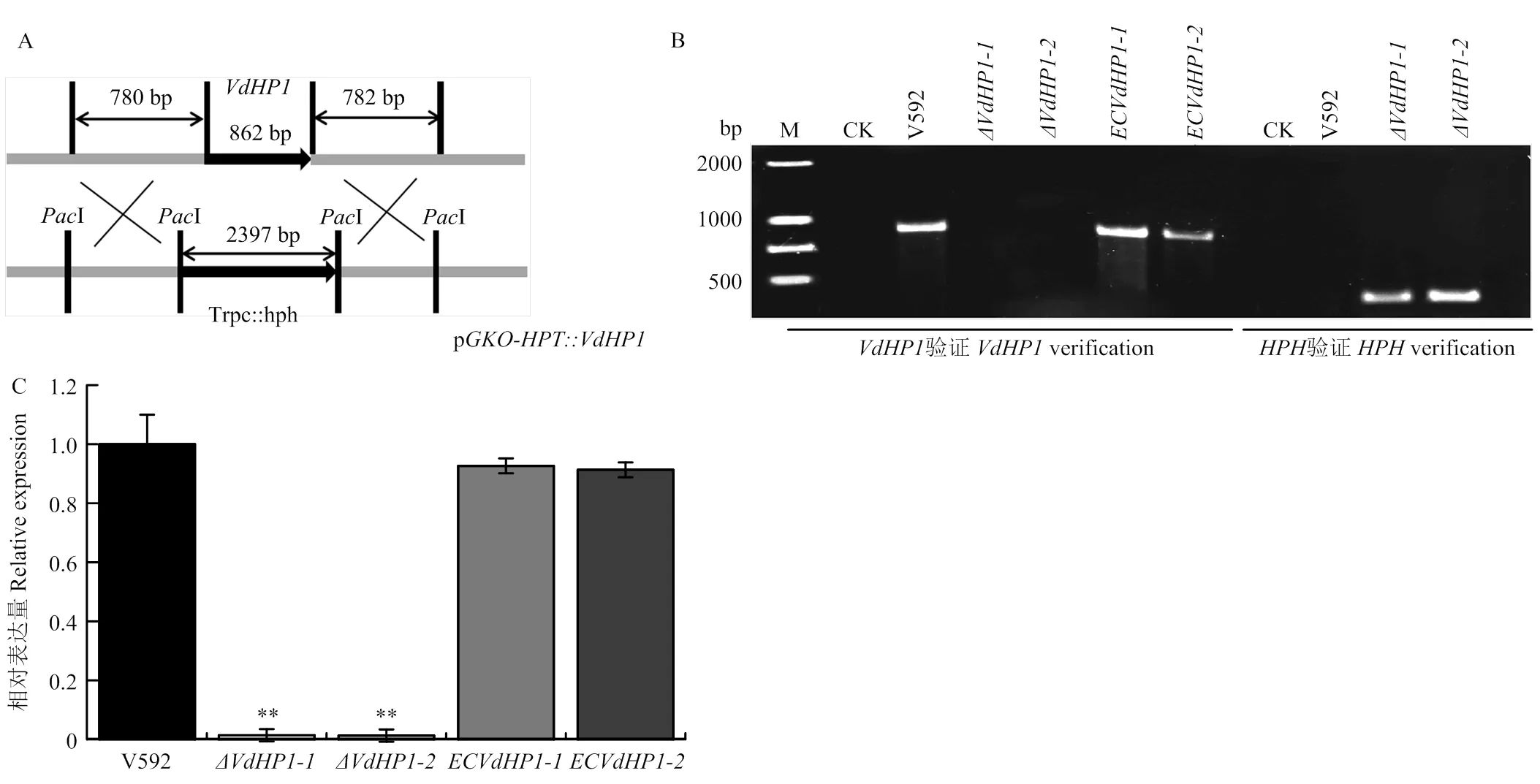
为了明确对大丽轮枝菌致病力的影响,以野生型菌株V592为对照,测定了基因敲除体对棉花的致病力。结果如图6所示,接种10 d时所有植株开始出现萎蔫症状,随着病情发展,基因敲除突变体导致的病害症状与对照相比明显减轻。接种28 d时,V592菌株引起感病植株叶片萎蔫、焦枯及脱落,病情指数达到95.4,而敲除突变体和所致病害的病情指数则分别为44.3和43.2;互补菌株和对棉花的致病力明显得到恢复,病情指数分别为92.2和91.1(图6-A、6-B)。接种30 d时,对感病植株进行剖杆观察,V592菌株及2个互补菌株均导致棉杆维管束明显变褐,而接种2个敲除突变体的棉花,其维管束基本不变色(图6-C)。表明基因敲除影响大丽轮枝菌对棉花的致病力。
为了明确是否影响大丽轮枝菌在寄主体内的定殖能力,通过qPCR对棉花中的真菌生物量进行了测定,结果如图6-D显示,基因敲除突变体在根组织中的生物量显著高于V592菌株和2个互补菌株,而在茎组织中的生物量又显著低于V592和互补菌株,表明基因敲除导致大丽轮枝菌在棉花茎中的扩展受阻。
为了进一步明确致病力下降是否与菌株的穿透能力下降有关,以V592为对照,对基因敲除突变体和互补菌株进行了玻璃纸穿透试验,结果如图6-F所示,V592菌株和2个互补菌株均可在接种第3天时穿透玻璃纸在MM培养基上生长,而基因敲除突变体则在接种第5天时才能穿透玻璃纸。RT-qPCR结果显示,与野生型V592菌株和互补菌株相比,在基因敲除突变体中,与大丽轮枝菌侵染钉形成相关的2个基因和以及与分泌结构菌丝颈环形成相关基因的表达量均明显下降(图6-E)。表明基因敲除导致大丽轮枝菌穿透延迟并且影响侵染钉及菌丝颈环形成相关基因的表达。
A:感病棉花的症状,照片拍摄于接种后20 d The symptoms of diseased cotton plants, the photograph were taken at 20 days post inoculation;B:棉花发病后的病情指数Disease index of cotton plants;C:感病棉花维管束变褐现象Vascular discoloration of diseased cotton plants;D:棉花根、茎、叶中的真菌生物量Relative quantification of fungal biomass in roots, stems and leaves of cotton plants;E:与侵染钉形成和分泌蛋白释放相关基因在VdHP1基因敲除突变体中的相对表达量The transcriptional expression of genes involved in penetration peg formation and delivery of secretory protein in VdHP1 gene knockout mutants;F:玻璃纸穿透试验Cellophane penetration test of VdHP1 gene knockout mutants
2.8 致病相关基因在VdHP1基因敲除突变体中的表达
为了明确表达对其他致病相关基因的影响,首先构建了基因过表达载体,获得过表达菌株(和),RT-qPCR测定结果显示,在过表达菌株中的表达量显著高于野生型菌株V592中的表达量(图7-A)。与野生型菌株V592相比,与黑色素合成相关的基因、、和在基因敲除体中的相对表达量均显著上调,在过表达菌株中除外均显著下调(图7-B);与之相反,与侵染钉形成有关的基因、、和分泌蛋白释放有关的基因在基因敲除体中的相对表达量均显著下调,在过表达菌株中和表达量显著上调(图7-C);同样,与分生孢子产生有关的基因、、、、、和在基因敲除突变体中的相对表达量显著下调,、、、、表达量在过表达菌株中显著上调,和的表达则不受表达量影响(图7-D)。上述结果表明,对与侵染钉形成、分泌蛋白释放及分生孢子产生有关基因的表达具有正调控作用,对黑色素合成有关基因的表达具有负调控作用。
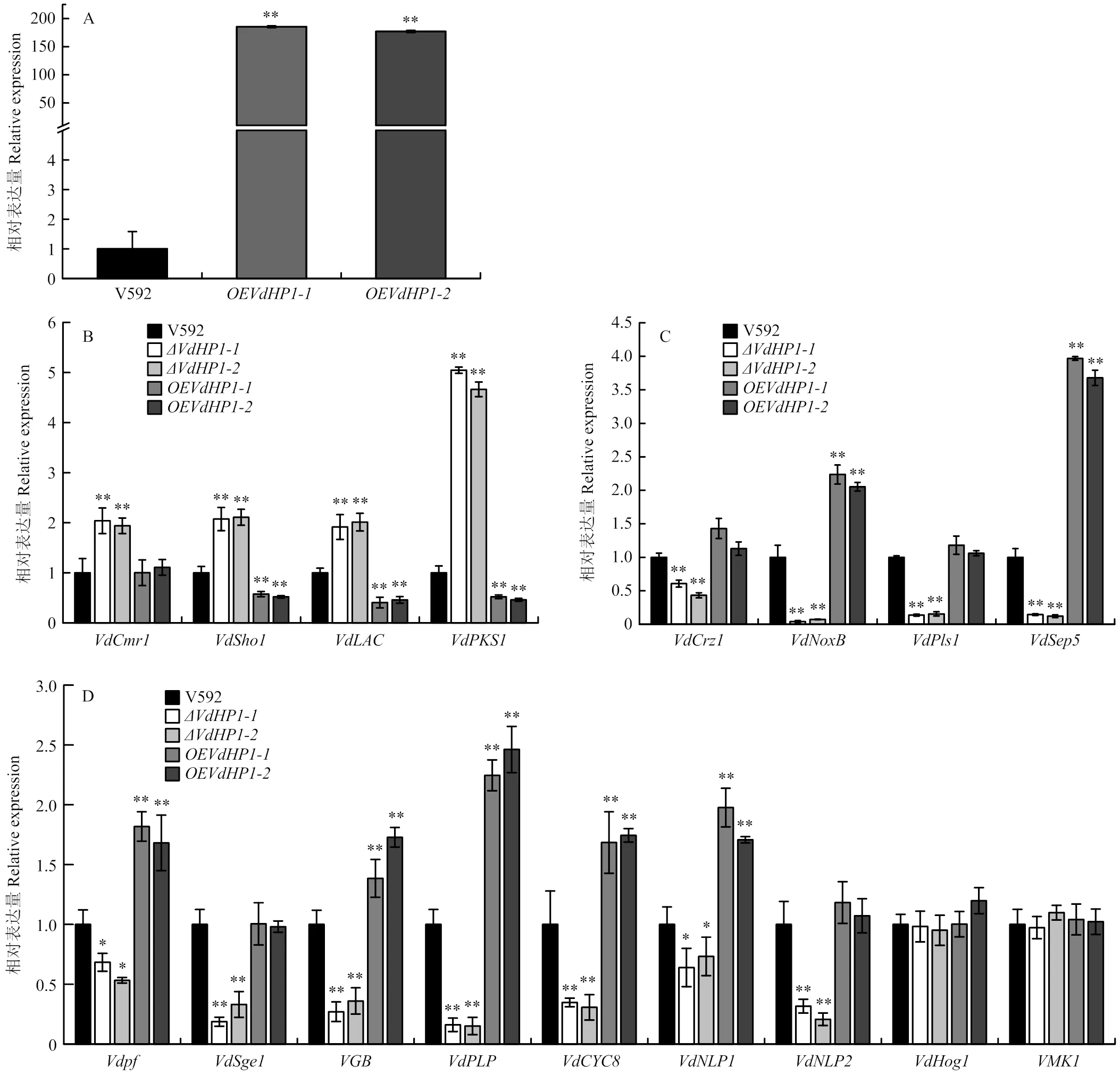
A:VdHP1过表达菌株中的转录水平验证Transcriptional expression of VdHP1 in V592 strain and overexpressed strains;B:大丽轮枝菌中黑色素合成相关基因的转录表达Transcriptional expression of genes involved in melanin synthesis;C:大丽轮枝菌中与穿透及分泌蛋白释放相关基因的转录表达Transcriptional expression of genes involved in penetration peg and delivery of secretory protein;D:大丽轮枝菌中产孢相关基因的转录表达Transcriptional expression of genes involved in conidial production
3 讨论
本研究从大丽轮枝菌中克隆到的与GenBank中已有功能注释的基因没有任何序列相似性,并且只与轮枝菌属中的同源基因具有很高的序列相似性,表明该基因是轮枝菌属特有的基因。Klosterman等通过亚细胞定位和信号肽预测轮枝菌属中大丽轮枝菌(VdLs.17菌株)和黑白轮枝菌()(VaMs.102菌株)分别编码780个和759个分泌蛋白,其中574个基因在2个种间保守[26]。由于许多真菌典型的效应子蛋白是氨基酸数目<400,半胱氨酸数>4的小蛋白[27-29],据此轮枝菌属中246个未被注释的基因编码的蛋白为这类典型的效应子蛋白[26]。而本研究克隆到的,通过亚细胞定位和信号肽预测编码的蛋白也是分泌蛋白,包含268个氨基酸,但是其半胱氨酸只有2个,因此VdHP1蛋白可能是轮枝菌属中一种非典型效应子蛋白。
在分生孢子中的表达量是微菌核中的28倍、菌丝的14倍,当从大丽轮枝菌中敲除,因其不能在分生孢子和菌丝中表达,导致敲除突变体产孢梗和产孢量明显减少,菌丝形态也发生改变,表明参与大丽轮枝菌的产孢过程。已有研究表明,大丽轮枝菌的产孢过程是多基因参与的过程,如[11]、[12]、[19]、[20]、[30]、[16]、[31]、[32]、[6]和[6]等基因敲除均导致大丽轮枝菌产孢量下降。本研究发现,正调控其中一些与产孢相关基因、、、、、、的表达,其中,[11]、[12]和[32]是参与调控产孢过程的转录因子,是G蛋白信号途径的关键基因[20]。基因敲除导致产孢量下降可能与这些产孢相关基因表达量下降有关,同时也表明可能通过与其他基因或信号途径互作参与分生孢子的形成过程。
敲除突变体在棉花根、茎中的生物量测定结果表明,基因敲除导致大丽轮枝菌在棉花茎中的扩展受阻;与之一致的结果是,基因敲除体穿透玻璃纸的能力下降,并且与附着枝侵染钉形成相关的基因、、在基因敲除体中的表达量显著下调[8],表明基因敲除导致附着枝形成侵染钉的能力下降,从而导致大丽轮枝菌穿透寄主细胞壁和在寄主体内的扩展能力下降。大丽轮枝菌发挥致病作用的途径之一就是通过分泌各类效应子蛋白与寄主互作,干扰或阻止植物免疫。是大丽轮枝菌侵染钉与寄主界面形成菌丝颈环结构所必需的基因,其作用是释放分泌蛋白[9];在基因敲除体中的表达量显著下调,表明基因敲除突变体致病力下降可能与其分泌效应子能力下降有关。此外,[11]、[12]、[20]、[30]、[32]、[6]、[6]不仅是产孢相关基因,也是致病相关基因,它们在基因敲除突变体中的表达量显著下调也可能是导致致病力下降的因素之一。
虽然有些致病相关基因的功能鉴定表明,其产孢过程与其微菌核形成过程相互偶联,如[11]、[20]和[32]均与分生孢子产生和微菌核的形成有关。本研究结果显示,不参与大丽轮枝菌微菌核形成,表明参与的产孢和致病过程不与微菌核形成途径偶联。已有研究表明,黑色素含量与大丽轮枝菌的致病力密切相关,[13]、[15]、[25]、[33]基因敲除均导致大丽轮枝菌致病力显著下降,其中,和是真菌DHN黑色素合成途径起始和结束的2个关键基因[13];VdCmr1蛋白是调控黑色素合成途径的转录因子[13];编码的跨膜蛋白通过MAPK级联信号途径调控大丽轮枝菌黑色素的合成和穿透寄主的能力[15]。本研究发现,对黑色素合成相关基因、、、的表达具有负调控作用,但是与这4个基因所涉及的调控网络是如何相互作用的还有待深入研究。
4 结论
从大丽轮枝菌中克隆到的是轮枝菌属特有的新基因。基因敲除导致大丽轮枝菌产孢量和产孢梗减少、菌丝形态发生改变、对寄主的致病力下降,表明与大丽轮枝菌分生孢子和产孢梗的产生有关,参与大丽轮枝菌致病。其他致病相关基因在敲除突变体中的转录分析结果表明,对与侵染钉形成、分泌蛋白释放及分生孢子产生相关基因的表达具有正调控作用,对黑色素合成相关基因的表达具有负调控作用。
[1] 朱荷琴, 李志芳, 冯自力, 冯鸿杰, 魏锋, 赵丽红, 师勇强, 刘世超, 周京龙. 我国棉花黄萎病研究十年回顾及展望. 棉花学报, 2017, 29(增刊): 37-50.
ZHU H Q, LI Z F, FENG Z L, FENG H J, WEI F, ZHAO L H, SHI Y Q, LIU S C, ZHOU J L. Overview of cotton verticillium wilt research over the past decade in china and its prospect in future., 2017, 29(Suppl.): 37-50. (in Chinese)
[2] KAWCHUK L M, HACHEY J, LYNCH D R, KULCSAR F,van Rooijen G, Waterer D R, Robertson A, Kokko E, Byers R, Howard R G, FISHER R, PRUFER D. Tomatodisease resistance genes encode cell surface-like receptors., 2001, 98(11): 6511-6515.
[3] GAO F, ZHANG B S, ZHAO J H, HUANG J F, JIA P S, WANG S, ZHANG J, ZHOU J M, GUO H S. Deacetylation of chitin oligomers increases virulence in soil-borne fungal pathogens., 2019, 5(11): 1167-1176.
[4] QIN J, WANG K, SUN L, XING H, WANG S, LI L, CHEN S, GUO H S, ZHANG J. The plant-specific transcription factors CBP60g and SARD1 are targeted by asecretory protein VdSCP41 to modulate immunity., 2018, 7: DOI: 10.7554/eLife.34902.
[5] ZHOU B J, JIA P S, GAO F, GUO H S. Molecular characterization and functional analysis of a necrosis- and ethylene-inducing, protein-encoding gene family from., 2012, 25(7): 964-975.
[6] SANTHANAM P, VAN ESSE H P, ALBERT I, FAINO L, NURNBERGER T, THOMMA B P. Evidence for functional diversification within a fungal NEP1-like protein family., 2013, 26(3): 278-286.
[7] GUI Y J, ZHANG W Q, ZHANG D D, ZHOU L, SHORT D P G, WANG J, MA X F, LI T G, KONG Z Q, WANG B L, WANG D, LI N Y, SUBBARAO K V, CHEN J Y, DAI X F. Aextracellular cutinase modulates plant immune responses., 2018, 31(2): 260-273.
[8] ZHAO Y L, ZHOU T T, GUO H S. Hyphopodium-specific VdNoxB/VdPls1-dependent ROS-Ca2+signaling is required for plant infection by., 2016, 12(7): e1005793.
[9] ZHOU T T, ZHAO Y L, GUO H S. Secretory proteins are delivered to the septin-organized penetration interface during root infection by., 2017, 13(3): e1006275.
[10] BUI T T, HARTING R, BRAUS-STROMEYER S A, TRAN V T, LEONARD M, HOFER A, ABELMANN A, BAKTI F, VALERIUS O, SCHLUTER R, STANLEY C E, AMBROSIO A, BRAUS G H.transcription factors Som1 and Vta3 control microsclerotia formation and sequential steps of plant root penetration and colonisation to induce disease., 2019, 221(4): 2138-2159.
[11] LUO X, MAO H, WEI Y, CAI J, XIE C, SUI A, YANG X, DONG J. The fungal-specific transcription factorinfluences conidia production, melanized microsclerotia formation and pathogenicity in., 2016, 17(9): 1364-1381.
[12] SANTHANAM P, THOMMA B P H J.Sge1 differentially regulates expression of candidate effector genes., 2013, 26(2): 249-256.
[13] WANG Y, HU X, FANG Y, ANCHIETA A, GOLDMAN P H, HERNANDEZ G, KLOSTERMAN S J. Transcription factor VdCmr1 is required for pigment production, protection from UV irradiation, and regulates expression of melanin biosynthetic genes in., 2018, 164(4): 685-696.
[14] WANG Y, DENG C, TIAN L, XIONG D, TIAN C, KLOSTERMAN S J. The transcription factor VdHapX controls iron homeostasis and is crucial for virulence in the vascular pathogen., 2018, 3(5): e00400-18.
[15] LI J J, ZHOU L, YIN C M, ZHANG D D, KLOSTERMAN S J, WANG B L, SONG J, WANG D, HU X P, SUBBARAO K V, CHEN J Y, DAI X F. TheSho1-MAPK pathway regulates melanin biosynthesis and is required for cotton infection., 2019, 21(12): 4852-4874.
[16] RAUYAREE P, OSPINA-GIRALDO M D, KANG S, BHAT R G, SUBBARAO K V, GRANT S J, DOBINSON K F. Mutations in, a mitogen-activated protein kinase gene, affect microsclerotia formation and pathogenicity in., 2005, 48(2): 109-116.
[17] TIAN L, XU J, ZHOU L, GUO W. VdMsb regulates virulence and microsclerotia production in the fungal plant pathogen., 2014, 550(2): 238-244.
[18] TIAN L, YU J, WANG Y, TIAN C. The C2H2transcription factor VdMsn2 controls hyphal growth, microsclerotia formation, and virulence of., 2017, 121(12): 1001-1010.
[19] TZIMA A, PAPLOMATAS E J, RAUYAREE P, KANG S. Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogen., 2010, 47(5): 406-415.
[20] TZIMA A K, PAPLOMATAS E J, TSITSIGIANNIS D I, KANG S. The G proteinsubunit controls virulence and multiple growth- and development-related traits in., 2012, 49(4): 271-283.
[21] 宋雯, 王春巧, 俞燕, 高峰, 黄家风. 棉花黄萎病菌鸟氨酸脱羧酶抗酶蛋白基因的功能分析. 棉花学报, 2019, 31(2): 101-113.
SONG W, WANG C Q, YU Y, GAO F, HUANG J F. Functional analysis of an ornithine decarboxylase antizyme geneinisolated from cotton., 2019, 31(2): 101-113. (in Chinese)
[22] 王春巧, 陈志荣, 宋雯, 何芳, 黄家风. 一个编码富含丝氨酸蛋白的基因影响大丽轮枝菌的微菌核形成、产孢及致病力. 植物病理学报, 2019, 49(5): 650-659.
WANG C Q, CHEN Z R, SONG W, HE F, HUANG J F. A serine-rich protein identified inaffects microsclerotial formation, conidiation and pathogenicity., 2019, 49(5): 650-659. (in Chinese)
[23] WANG S, XING H, HUA C, GUO H S, ZHANG J. An improved single-step cloning strategy simplifies the-mediated transformation (ATMT)-based gene-disruption method for., 2016, 106(6): 645-652.
[24] GAO F, ZHOU B J, LI G Y, JIA P S, LI H, ZHAO Y L, ZHAO P, XIA G X, GUO H S. A glutamic acid-rich protein identified infrom an insertional mutagenesis affects microsclerotial formation and pathogenicity., 2010, 5(12): e15319.
[25] ZHANG T, ZHANG B, HUA C, MENG P, WANG S, CHEN Z, DU Y, GAO F, HUANG J.is required for melanin formation and virulence in a cotton wilt pathogen., 2017, 60(8): 868-879.
[26] KLOSTERMAN S J, SUBBARAO K V, KANG S, VERONESE P, GOLD S E, THOMMA B P, CHEN Z, HENRISSAT B, LEE Y H, PARK J,. Comparative genomics yields insights into niche adaptation of plant vascular wilt pathogens., 2011, 7(7): e1002137.
[27] BOLTON M D, VAN ESSE H P, VOSSEN J H, DE JONGE R, STERGIOPOULOS I, STULEMEIJER I J, VAN DEN BERG G C, BORRAS-HIDALGO O, DEKKER H L, DE KOSTER C G, DE WIT P J, JOOSTEN M H, THOMMA B P. The novellysin motif effector Ecp6 is a virulence factor with orthologues in other fungal species., 2008, 69(1): 119-136.
[28] VAN ESSE H P, VAN’T KLOOSTER J W, BOLTON M D, YADETA K A, VAN BAARLEN P, BOEREN S, VERVOORT J, DE WIT P J, THOMMA B P. Thevirulence protein Avr2 inhibits host proteases required for basal defense., 2008, 20(7): 1948-1963.
[29] VAN ESSE H P, BOLTON M D, STERGIOPOULOS I, DE WIT P J, THOMMA B P. The chitin-bindingeffector protein Avr4 is a virulence factor., 2007, 20(9): 1092-1101.
[30] QI X, LI X, GUO H, GUO N, CHENG H. VdPLP, a patatin-like phospholipase in, is involved in cell wall integrity and required for pathogenicity., 2018, 9(3): 162.
[31] WANG Y, TIAN L, XIONG D, KLOSTERMAN S J, XIAO S, TIAN C. The mitogen-activated protein kinase gene,, regulates osmotic stress response, microsclerotia formation and virulence in., 2016, 88: 13-23.
[32] LI Z F, LIU Y J, FENG Z L, FENG H J, KLOSTERMAN S J, ZHOU F F, ZHAO L H, SHI Y Q, ZHU H Q., encoding CYC8 glucose repression mediator protein, is required for microsclerotia formation and full virulence in., 2015, 10(12): e0144020.
[33] 曹亚松, 王春生, 李海源, 徐小鸿, 商文静, 杨家荣, 胡小平. 大丽轮枝菌基因克隆与功能分析. 西北农业学报, 2018, 27(2): 275-282.
CAO Y S, WANG C S, LI H Y, XU X H, SHANG W J, YANG J R, HU X P. Cloning and functional analysis ofin., 2018, 27(2): 275-282. (in Chinese)
Cloning and Functional Analysis offrom cotton
SUN Qi, HE Fang, SHAO ShengNan, LIU Zheng, HUANG JiaFeng
(College of Agriculture/Key Laboratory of Oasis Agricultural Pest Management and Plant Protection Resources Utilization, Xinjiang Uygur Autonomous Region, Shihezi University, Shihezi 832003, Xinjiang)
【】The objective of this study is to determine the function of a novel gene () incausing cotton verticillium wilt, and to provide a basis for analyzing the pathogenic mechanism ofand the prevention and treatment of cottonverticillium wilt.【】The full length ofwas cloned and sequenced fromwild-type strain V592 genomic DNA and cDNA. The relative expression ofmeasured by reverse transcription quantitative real-time PCR (RT-qPCR).gene knockout vector, complementary vector and overexpressed vector were constructed to producegene knockout strains, complementary strains and overexpressed strains by-mediated transformation, respectively. Taking wild-type strain V592 as the control, colony growth on PDA and hypha morphology were observed, microsclerotia production, conidial production and pathogenicity to cotton ofgene knockout mutants and complementary strains were measured. The relative expression of other genes involved in pathogenicity inknockout mutants and overexpressed strains was measured by RT-qPCR.【】The full length ofwas determined to be 862 bp and deduced protein contained 268 amino acids, which shared no significant sequence similarity to any known annotated gene in GenBank. The transcriptional expression ofwas significantly up-regulated when V592 strain induced by cotton roots for 6-12 h, indicating thatplays a role at the early stage of the infection. The transcriptional expression ofis differentially expressed in different tissues ofCompared with wild-type strain V592,gene knockout mutants showed significantly decreased conidia and conidiophores, branching hyphae were spirally shaped, and the pathogenicity to cotton was significantly decreased.The relative expression of genes involved in penetration peg formation (,,), delivery of secretory protein () and conidial production (,,,,,,) was significantly down-regulated inknockout mutants, but was up-regulated in the overexpressed strains; whereas, the relative expression of genes involved in melanin synthesis (,,,) was significantly up-regulated inknockout mutants, and was down-regulated in the overexpressed strains. 【】is participated in the production of conidia and conidiophores, and is involved in pathogenicity in.positively regulates the transcriptional expression of genes involved in penetration peg formation, delivery of secretory protein and conidial production, and negatively regulates the transcriptional expression of genes involved in melanin synthesis.
cottonverticillium wilt;;; conidiation; pathogenicity; transcriptional expression

10.3864/j.issn.0578-1752.2020.14.011
2020-01-10;
2020-02-21
国家自然科学基金(31760497,31560494)
孙琦,E-mail:784594752@qq.com。通信作者刘政,E-mail:lzh8200@126.com。通信作者黄家风,E-mail:jiafeng_huang@163.com
(责任编辑 岳梅)

