一种新型银纳米颗粒的制备及其抑制烟草赤星病菌的机制
向顺雨,王靖,谢中玉,施焕,曹哲,江龙,马小舟,汪代斌,张帅,黄进,孙现超
一种新型银纳米颗粒的制备及其抑制烟草赤星病菌的机制
向顺雨1,3,王靖1,谢中玉1,施焕1,曹哲1,江龙1,马小舟1,3,汪代斌4,张帅5,黄进2,3,孙现超1,3
(1西南大学植物保护学院,重庆 400715;2西南大学化学化工学院,重庆 400715;3西南大学软物质材料化学与功能制造重庆市重点实验室,重庆 400715;4重庆烟草科学研究所,重庆 400715;5重庆市烟草公司酉阳分公司,重庆 409800)
【】利用生物多糖合成银纳米颗粒,并解析其对烟草赤星病菌()的抑制活性及机理,探索生物多糖合成银纳米颗粒的农业应用前景,为开发安全、高效的抗菌剂提供理论依据。采用海藻酸钠作为还原剂与表面活性剂在水浴锅中(65℃)一步合成银纳米颗粒(S-AgNPs)。利用透射电镜(TEM)、扫描电镜(SEM)、原子力显微镜(AFM)、紫外分光光度计(UV-vis)、Zeta电位-粒径仪和X射线光电子能谱分析(XPS)分别对S-AgNPs粒径、分散性、稳定性及化学组成进行表征分析。应用Nano measure软件统计TEM与AFM图像中S-AgNPs的平均粒径。采用平板生长速率法探究S-AgNPs在PDA培养基中浓度为0.0625、0.125、0.25、0.5、1.0 μg·mL-1时对赤星病菌菌丝生长的影响。赤星病菌在S-AgNPs浓度为1.0 μg·mL-1的液态PDA培养基(PDB)中培养后,分别通过测定菌丝的鲜重与干重、SEM观察、电导率测定和考马斯亮蓝G250染色,分析S-AgNPs对菌丝生长量、形态、细胞膜通透性和菌丝可溶性蛋白含量的影响。用孢子悬浮液注射接种法测试S-AgNPs在离体烟草叶片上对赤星病的防治效果。最后通过测定S-AgNPs对鲫鱼生长的影响分析海藻酸钠合成的银纳米颗粒的安全性。S-AgNPs的TEM、SEM、AFM图像分析表明该方法所合成的S-AgNPs具有分散性好,粒径统一,稳定性强等特点,平均粒径为9.83 nm。生测结果显示S-AgNPs在1.0 μg·mL-1时对烟草赤星病菌菌丝生长抑制率为83.9%。S-AgNPs处理组的菌丝鲜重与菌丝干重明显低于清水对照组,S-AgNPs可以明显破坏菌丝表面结构。进一步抑菌机制研究表明S-AgNPs主要通过抑制赤星病菌可溶性总蛋白合成而破坏其生物膜结构,降低生物膜保水能力,快速破坏菌丝细胞膜通透性,造成大量细胞质渗漏而抑制菌丝生长发育。最终,离体试验证实S-AgNPs能够有效地抑制烟草赤星病菌侵染烟草叶片,且S-AgNPs在有效浓度(1.0 μg·mL-1)内对鲫鱼无明显毒害作用,不影响其正常生命活动。建立的方法能够稳定合成分散性好,粒径统一,稳定性强的银纳米颗粒。该银纳米颗粒对烟草赤星病菌具有较强的抑制作用,可有效防治烟草赤星病,具有潜在的田间应用前景。
银纳米颗粒;海藻酸钠;绿色合成;烟草赤星病菌;烟草赤星病;抗菌机制
0 引言
【研究意义】我国是农业大国,经济作物的种植是我国大部分农民的主要经济来源。赤星病是植物生产中重要的叶部病害,除烟草以外,其还可对番茄、曼陀罗等作物的生产造成一定影响[1-3]。交链孢菌()为其病原,属半知菌亚门真菌[4],具有潜育期短、单斑产孢量大,暴发迅速等特点[5]。赤星病菌主要危害植物叶片,使叶部产生大小不一的病斑,后期病斑破碎脱落,极大程度地影响植物叶片生长而降低作物品质[6-7]。因此,提高烟草赤星病田间防治效率对增加农业生产产值具有重大意义。【前人研究进展】目前,生产上主要通过使用无毒种苗、选育抗病品种、加强田间管理、喷施化学药剂等方式对赤星病进行综合防治[8-10]。其中,化学防治是我国农业生产中防治赤星病的主要措施之一[5],菌核净是我国各农业产区主要使用的烟草赤星病防治药剂。但是大量使用菌核净以及不合理的管理方式会导致产生耐药菌株,这为烟草赤星病的防治增加了难度[11]。银纳米颗粒由于其优越的抗菌活性,不易产生耐药性而被作为一种理想的抗菌材料被各行业广泛研究。到目前为止,其应用范围已经覆盖到医学器械消毒、医用抗菌剂、食品包装、水体消毒等多领域[12-15]。但研究发现,银纳米颗粒的合成方式一直是影响其抗菌效果以及生物相容性的直接因素。在诸多合成方法中,银纳米颗粒的绿色合成由于具有合成条件温和,不产生有毒副产物等优势而备受关注。ELBESHEHY等曾用短小芽孢杆菌()、波斯芽孢杆菌()、地衣芽孢杆菌()3种土壤细菌还原银离子而成功制备出对于人体致病真菌、细菌以及大豆花叶病毒()具有良好抑制作用的银纳米颗粒[16]。但现有的绿色合成银纳米颗粒的方法难以实现控制银纳米颗粒稳定性与粒径统一进而影响其抗菌活性[17-18]。【本研究切入点】羧基与银纳米颗粒具有强烈的配对作用,且海藻酸钠表面活性羟基具有一定的还原性。本研究基于此,利用海藻酸钠表面羟基还原银离子生成银颗粒,而后其表面羧基迅速与银纳米颗粒产生配对作用使海藻酸钠包裹银纳米颗粒以控制银纳米颗粒粒径,增加银纳米颗粒稳定性,防止银纳米颗粒聚沉,从而长时间保持较高的抗菌活性。【拟解决的关键问题】明确海藻酸钠-银纳米颗粒(S-AgNPs)抗菌活性与抑制烟草赤星病菌的机理,为银纳米颗粒的制备及银纳米颗粒在植物叶部病害防控中的作用提供理论依据。
1 材料与方法
试验于2019年在西南大学植物保护学院完成。
1.1 材料
烟草K326由中国农业科学院烟草研究所赠予,氨水、盐酸(浓度为1.18 g·mL-1)、NaCl、葡萄糖均购自重庆川东化工有限公司,乙二醇购自重庆北碚精细化工厂,高碘酸钠购自成都市科龙化工试剂厂,海藻酸钠(SA)(黏度200±20 mpa·s)购自上海阿拉丁生化科技股份有限公司,琼脂购自北京鼎国昌盛生物技术责任有限公司,考马斯亮蓝G250购自上海康朗生物科技有限公司。
紫外分光光度计PGENERAL(北京普析通用仪器有限责任公司),布鲁克纳米表面仪(BRUKER,布鲁克(北京)科技有限公司),离心机(Sartorius stedim,德国赛多利斯集团),透射电镜(JEM-1200EX Japan JEOL,捷欧路(北京)科贸有限公司),扫描电镜(su8020,日本日立公司),Zeta粒径分析仪(ZS90,英国马尔文公司),冷冻干燥机(FD-1A-50,上海豫明仪器有限公司),电导仪(DDS-11C,青岛明博环保科技有限公司),水浴锅(Keelrein,上海齐欣科学仪器有限公司)。
1.2 海藻酸钠合成银纳米颗粒
称取0.02 g海藻酸钠,用5 mL蒸馏水完全溶解备用。0.04 g硝酸银溶于2 mL水中然后逐滴加入2%氨水溶液直到看到黄色絮状物消失停止滴加,将海藻酸钠溶液加至银氨溶液并在65℃水浴中反应6 min,得到粒径为10 nm左右的银纳米颗粒,并在12 000 r/min,4℃条件下离心5 min,离心3次后将沉淀溶解在超纯水中备用。
1.3 表征方法
采用透射电镜(TEM)、原子力显微镜(AFM)、扫描电镜(SEM)观察S-AgNPs的形貌特征、粒径分布;用紫外分光光度计获得S-AgNPs的紫外-可见吸收光谱;Zeta粒径分析仪测试S-AgNPs的粒径与电位;SEM观察S-AgNPs处理后的赤星病菌菌丝。
1.4 S-AgNPs抑菌作用测定
制作PDA培养基[19],并将已知原始浓度的S-AgNPs添加到PDA中,使PDA培养基中S-AgNPs的浓度分别为0.0625、0.125、0.25、0.5、1.0 μg·mL-1,移入直径为0.8 cm的赤星病菌菌饼(病菌生长5 d后移接),清水为空白对照。当对照板中菌丝体的生长到达培养皿的边缘时,计算抑制率,每个处理设置3次重复。抑制率(%)=100×(清水对照组菌圈直径-处理组菌圈直径)/清水对照组菌圈直径。
1.5 S-AgNPs菌丝抑制作用测定
制作PDB培养基(不带琼脂的PDA培养基),即将液体灭菌后,分装在锥形瓶中,每瓶100 mL培养基,并在每个锥形瓶中移入10个0.8 cm的培养5 d的赤星病菌菌饼,然后28℃,180 r/min的摇床中黑暗培养2 d后加入S-AgNPs,使S-AgNPs在PDB培养基中的浓度分别为0、1.0 μg·mL-1,继续在28℃,180 r/min摇床中黑暗培养4 d后用三层纱布收集菌丝,并用灭菌水洗涤2—3次后用滤纸吸干表面水分后称重(鲜重)。将收集好的菌丝冷冻干燥后称重(干重),统计各处理组菌丝质量,每个处理设置3次重复。
1.6 细胞通透率测定
培养基制作及菌饼放置方法同1.5,在28℃,180 r/min的摇床中黑暗培养6 d后收集菌丝并冷冻干燥。称取100 mg冷冻干燥的菌丝于试管中,加入S-AgNPs并定容至10 mL,使试管中S-AgNPs溶液浓度分别为0、1.0 μg·mL-1。并分别在0、5、10、15、20 min后用电导仪测试各处理组电导率。等待测试期间在25℃,160 r/min摇床中培养。若细胞膜通透性被破坏,细胞质将泄漏到细胞膜外,可通过测试细胞膜外溶液DNA或RNA浓度来判断细胞膜通透性受影响程度。因此,待测完电导率后,将每处理组的菌丝去除掉,收集培养液,并用紫外分光光度计在260nm测定每处理组溶液中DNA的含量,每个处理设置3次重复。
1.7 可溶性蛋白含量测定
菌丝收集方法同1.5,将收集好的菌丝冷冻干燥后备用。取0.25 g菌丝,液氮冷却灭菌好的研钵体后加入0.025 mol·L-1的Tris-HCl 2 mL研磨菌丝至糊状。12 000 r/min,4℃离心15min,收集上清液备用。然后取上述蛋白质粗提液0.2 mL,加入考马斯亮蓝G-250染色液5 mL,25℃环境下静止3 min后在595 nm处测其吸光值。考马斯亮蓝G250染液配制方法:称取考马斯亮蓝G-250 100 mg,用50 mL 95%乙醇溶解后加入100 mL 85% m/v磷酸溶液,去离子水定容至1 L,每个处理设置3次重复。
1.8 离体叶片病害控制效果测定
选用烟草品种为K326(40d烟龄)。分别用不同浓度的S-AgNPs(0.125、0.25、0.5、1.0 μg·mL-1)喷施叶面,每株喷洒50mL,每个浓度5株重复。喷施24 h后选取第4、5位叶片并用注射孢子悬浮液法(106个/mL)接种赤星病菌。在28℃恒温培养箱保湿培养3d后观察叶片发病情况。病害分级标准0级:全叶无病,1级:病斑面积占叶面积1%以下,3级:病斑面积占叶面面积2%—5%,5级:病斑面积占叶面面积6%—10%,7级:病斑面积占叶面面积11%—20%,9级:病斑面积占叶面面积21%以上。依据赤星病叶面病害分级标准计算其病情指数:病情指数=100×Σ(各级病斑数×相应级数值)/(病斑总数×最大级数),每个处理设置3次重复。
1.9 S-AgNPs的水体安全性
选择若干条长度为3—4cm的鲫鱼,配置好体积为1 L浓度为1.0 μg·mL-1的S-AgNPs并在其中放入10条生长良好的鲫鱼,纯自来水作为空白对照,每组重复3次。分别在24、48、72、96 h观察并记录鲫鱼的死亡数量。
1.10 数据处理
采用Excel 2010与OriginPro 8处理数据及作图,采用Photoshop对图片进行调色处理,采用SPSS Statistics 20对数据进行单因素方差分析(Duncan法)。
2 结果
2.1 S-AgNPs紫外吸收与X射线光电子能谱分析
S-AgNPs在421 nm左右有紫外特征吸收峰(图1-A),且XPS能谱显示S-AgNPs表面结合能为3.01 keV,明确了银主要以零价态存在,说明S-AgNPs中的Ag元素主要是单质银(图1-B),表明在整个反应中所合成的物质为金属银单质,且具有银纳米颗粒的紫外吸收特质,能够充分肯定该反应可成功合成纳米级银单质。

图1 S-AgNPs紫外可见吸收光谱(A)与X射线光电子能谱(B)
2.2 S-AgNPs形貌与稳定性表征
经TEM观测,S-AgNPs为球形颗粒,形貌规则,具有较好的分散性,能均匀分散在溶剂中,团聚现象较少(图2-A、2-B)。此外,SEM与AFM观测到S-AgNPs粒径相对均一,颗粒形貌大小无明显差异(图2-E—2-H)。对TEM与AFM图像进行粒径统计(图2-I、2-J)得到该S-AgNPs粒径大约8.14 nm(TEM)与11.23 nm(AFM)。为明确S-AgNPs的稳定性,将S-AgNPs水溶液直接进行冷冻干燥制成S-AgNPs粉末,而后将其复溶在水中发现水接触S-AgNPs粉末后无需搅拌S-AgNPs立刻均匀分散在水中,肉眼观察复溶溶液颜色、状态与未冻干前S-AgNPs溶液极度相似。进一步将其进行TEM观察发现,S-AgNPs冻干后粒径与稳定性与冻干前无明显差异,只观察到少许颗粒发生局部团聚现象,但整体分散性与粒径无明显变化(图2-C、2-D)。

A、B:S-AgNPs溶液TEM图TEM image of S-AgNPs solution;C、D:S-AgNPs冷冻干燥后复溶于水中的TEM图TEM image of S-AgNPs solution re-dissolved in water after freeze-drying;E、F:S-AgNPs扫描电镜图SEM images of S-AgNPs;G、H:S-AgNPs原子力显微镜图AFM images of S-AgNPs;I:S-AgNPs的TEM粒径统计TEM particle size statistics of S-AgNPs;J:S-AgNPs的AFM粒径统计图AFM particle size statistics of S-AgNPs
2.3 S-AgNPs的Zeta电位与粒径统计分析
对S-AgNPs进行进一步表征以明确其粒径分布,Zeta粒径仪分析试验结果发现S-AgNPs粒径分布在5—12 nm,60%的S-AgNPs粒径集中在8—9 nm,统计所得平均粒径为9.83 nm(图3-A)。选用上海函郎新材料有限公司生产的无表面活性剂的银纳米颗粒(AgNPs)作为对照组分与S-AgNPs一起进行Zeta电位测定(图3-B),结果显示AgNPs电位为+4.6 mv,这主要是AgNPs无表面活性剂干扰银颗粒的电位,而S-AgNPs电位为-32.29 mv,这是银纳米颗粒表面包裹的海藻酸钠中和了银颗粒表面电位而使其显负电,该结果证实了海藻酸钠还原银离子后又作为表面活性剂包覆在银纳米颗粒表面。

图3 S-AgNPs Zeta粒径统计图(A)与Zeta电位图(B)
2.4 S-AgNPs对烟草赤星病菌的抑制作用
生测结果发现S-AgNPs在0.0625 μg·mL-1时就对烟草赤星病菌具有一定抑制作用(抑制率10%),且在浓度为1.0 μg·mL-1时抑制率可达83.9%。初步确定S-AgNPs具有较强的抗菌活性,在低浓度下能够明显抑制烟草赤星病菌菌丝生长(图4)。
2.5 S-AgNPs对烟草赤星病菌菌丝生长的影响
如图5所示,清水对照组(CK)菌丝生长迅速,培养基中充满了白色菌丝且饱满(图5-A),而S-AgNPs(1.0 μg·mL-1)处理后的菌饼未观察到明显的菌丝生长,在菌饼周围仅看到少了菌丝附着,培养基较清澈且无菌丝漂浮在培养基中(图5-B)。将两组菌丝取出测定其菌丝鲜重与干重后发现,对照组的菌丝鲜重与干重均显著高于S-AgNPs组(图5-C、5-D)。
2.6 S-AgNPs处理后菌丝表面观察
将S-AgNPs处理后菌丝采用扫描电镜观察表面是否受损。扫描电镜图片显示清水对照组菌丝生长良好,菌丝结构完整,饱满无损伤。S-AgNPs处理后的菌丝显示不同程度的损伤,菌丝表面凹陷,局部膨大,菌丝整体干瘪褶皱明显,表明S-AgNPs对烟草赤星病菌菌丝有较强的破坏作用(图6)。
2.7 细胞膜通透性测定
抗菌机制试验结果显示,S-AgNPs处理后的菌丝在0—5 min时就出现了大量的细胞质渗漏,细胞外液电导率迅速提升,5—20 min电导率也呈缓慢上升。CK对照组电导率在0—20 min无明显变化(图7-A)。与此同时,S-AgNPs处理过后的菌丝在20 min内DNA累积渗漏量要显著高于CK对照组(图7-B)[20]。
2.8 可溶性蛋白含量测定
S-AgNPs组分的菌丝可溶性蛋白含量要远低于CK对照组(图8),表明S-AgNPs抑制菌丝生长或破坏菌丝细胞膜可能与抑制其可溶性总蛋白有关[21]。
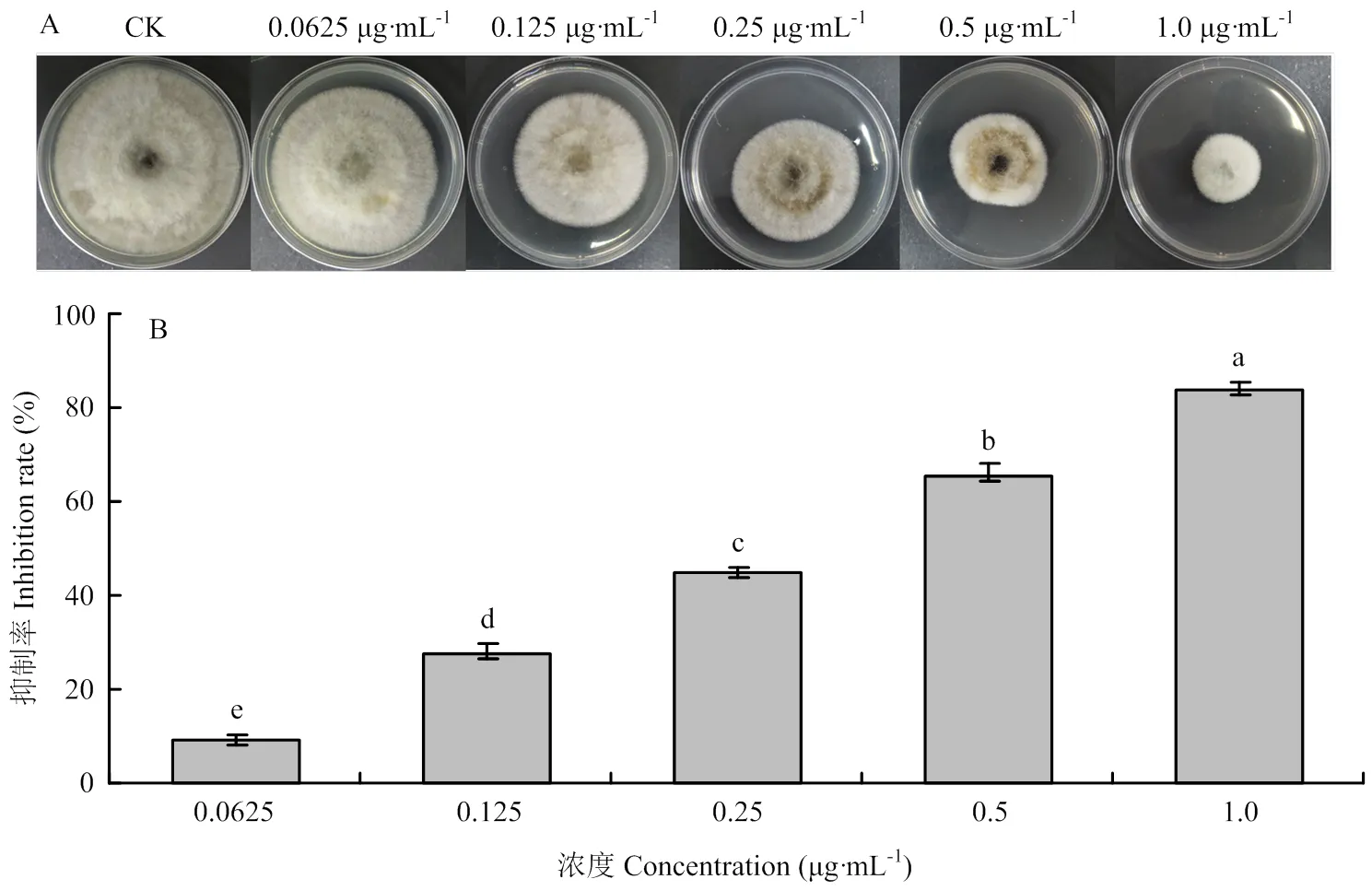
柱上标有不同小写字母表示处理间差异显著(p<0.05),竖条表示标准差。下同
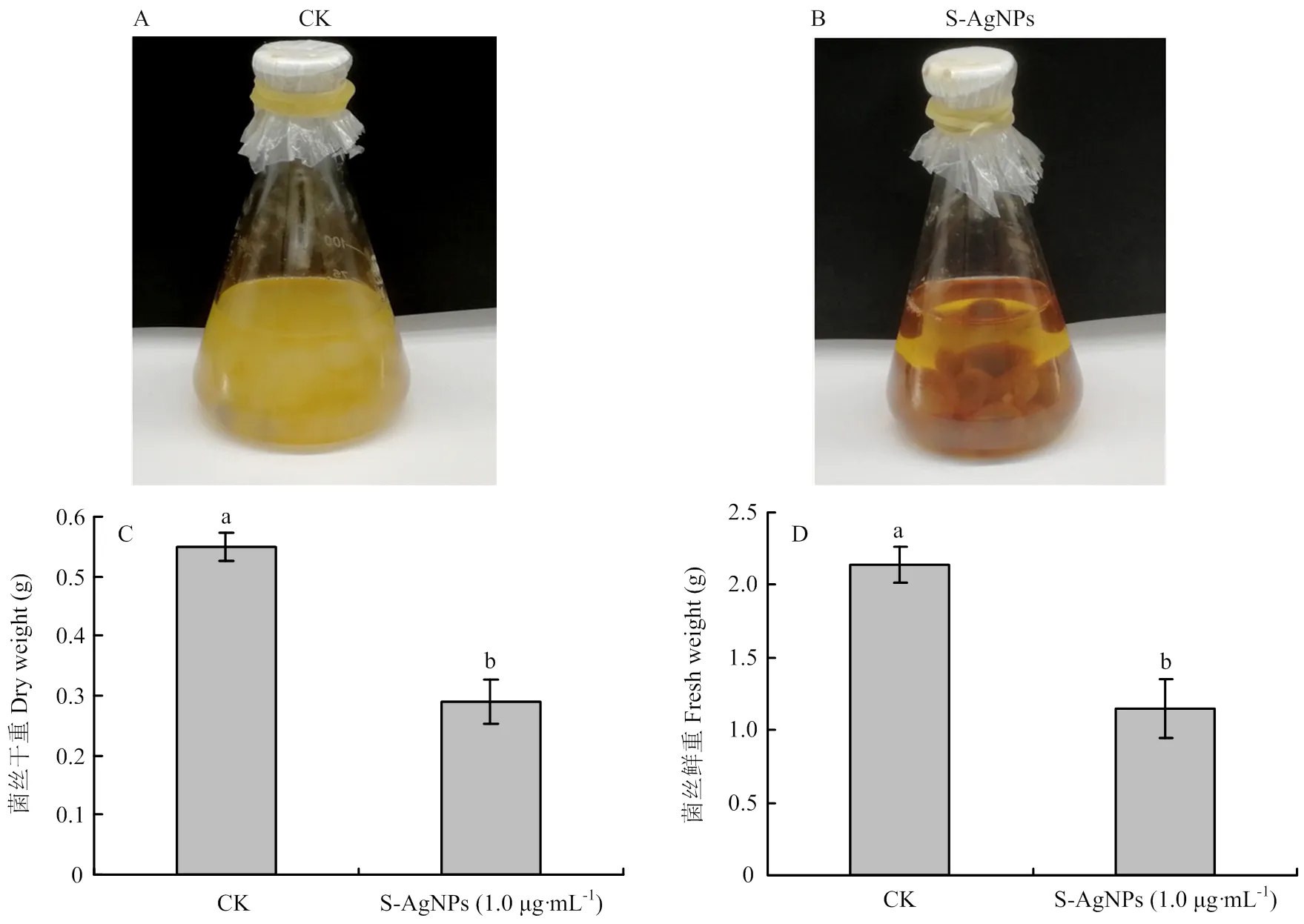
A、B:健康菌丝与S-AgNPs处理后的菌丝Healthy mycelium and S-AgNPs treated mycelium;C:菌丝干重Dry weight of mycelium;D:菌丝鲜重fresh weight of mycelium

图7 菌丝电导率变化(A)与DNA泄露(B)

图8 菌丝可溶性蛋白含量
2.9 离体叶片病害控制效果
如图9所示,清水对照组在接种3 d后发病较严重,能明显观察到深褐色病斑。而S-AgNPs处理组仅浓度为0.125 μg·mL-1时观察到发病,但发病程度与病斑大小要明显低于对照组,且其病情指数也显著低于对照组(表1)。说明S-AgNPs在较低浓度时能够抑制赤星病菌侵染植株,在较高浓度时能够完全保护植株不受侵染。
2.10 S-AgNPs的安全性测定
将S-AgNPs加入水中后观察鲫鱼96 h内的生命活动,结果发现清水对照组与S-AgNPs处理组鲫鱼在96 h内生命活动均正常,无不安、上下翻滚的情况,初步判断S-AgNPs在抑菌范围浓度内对水生生物无明显毒害作用(表2)。

图9 不同处理下烟草赤星病发病情况
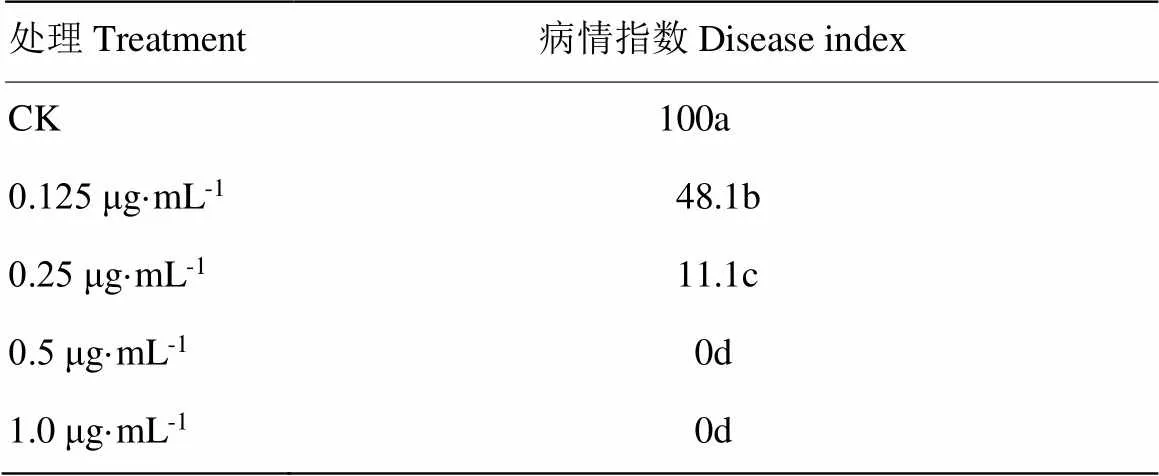
表1 不同处理下烟草赤星病病情指数
数据后不同小写字母表示处理间差异显著(<0.05)
Different lowercases after the data indicate significantly different among different treatments according to the Duncan’s multiple range test (<0.05)

表2 S-AgNPs对鲫鱼的毒性测定
3 讨论
赤星病属暴发性病害,在高温高湿等适于发病的田间环境中可短时间大面积暴发,且其田间防治主推药剂菌核净也面临着高抗药性威胁,因此研究高效的赤星病防治策略迫在眉睫[22]。在诸多研究中,化学新药剂的研发与生物防治是目前针对赤星病研究最多且最受关注的两大途经[23-24]。但新药剂的研发周期较长,无法短时间投入于赤星病防治工作中[25]。生物防治也存在见效慢,农民可接受度低等问题,还需要更进一步完善以提高其应用前景[26]。因此,亟需开发并评价新的烟草赤星病防控药剂。
银纳米颗粒是公认的具有良好抗菌活性的金属纳米材料,具有低耐药性,抗菌机制多样等特点,其已被证实具有优越的广谱抗植物病原真菌/细菌活性[27-28]。因此,银纳米颗粒是可应用于烟草赤星病防治的理想备选材料。而绿色合成银纳米颗粒的方法也可改善银纳米抗菌活性以及提高生物安全性,研究中利用一些生物提取成分或者有效物质对银离子进行还原合成银纳米颗粒可减少有毒副产物的产生,同时生物活性成分的加入也可协同银纳米抗菌以增加抗菌活性[29-31]。其中,最常见的绿色合成银纳米颗粒的方式就是利用微生物还原银离子[16]。有报道评价了购自Quantum Sphere公司直径为20nm左右的银纳米颗粒对植物病原真菌抑制活性,其浓度在高达50 μg·mL-1时才能抑制小麦根腐病菌()侵染小麦[21]。但Mishra等利用土壤细菌BHU-S4的上清液绿色合成了粒径为20 nm的银纳米颗粒(bsAgNPs)并同样用于小麦根腐病的防治,发现bsAgNPs在浓度为4.0 μg·mL-1时就能完全抑制病菌侵染植株[32],表明BHU-S4绿色合成银纳米颗粒确实很大程度上提高了银颗粒对小麦根腐病的防治效果,在达到相同的防治效果时bsAgNPs相比于所购买的普通银颗粒用量更少。微生物在合成银纳米颗粒过程中可能存在难以有效控制银纳米颗粒粒径,所合成的纳米颗粒易出现粒径分散不均匀甚至团聚等现象[33-35]。而银纳米颗粒在抗菌时具有很强的尺度依赖性,其粒径越小抗菌活性越强[36]。同时,银纳米颗粒的稳定性也会直接影响其药效时长[36]。因此,提高银纳米颗粒绿色合成的颗粒稳定性与粒径均一性是增强该方法抗菌应用前景的重要一步。在本研究中,笔者通过前期调查发现羧基与银纳米颗粒的配对作用最强,工业中常用带有羧基的表面活性剂控制银纳米颗粒粒径并增强其稳定性[37]。海藻酸钠表面具有丰富的羧基,在本研究中羧基与银颗粒强烈配对作用使海藻酸钠作为表面活性剂包裹在银颗粒表面以控制银颗粒粒径,提高银颗粒稳定性,最终合成平均粒径为9.83 nm的海藻酸钠-银纳米颗粒(S-AgNPs)。因此,S-AgNPs的高效抗菌效果可能与其超强稳定性、粒径统一以及小粒径特性有关。
此外,利用生物多糖合成银纳米颗粒也逐渐受到各界关注,特别是关于生物多糖协同银纳米颗粒抗菌相关工作的研究。WEI等利用壳聚糖为还原剂制备了壳聚糖基银纳米颗粒,试验证明壳聚糖合成的银纳米颗粒相比于纯壳聚糖与硝酸银溶液抗菌作用更迅速,抗菌时间更持久且抗菌作用更强,在5 μg·mL-1时就能对大肠杆菌具有较强的抑制作用[38]。该策略最终实现了壳聚糖抗菌与银纳米抗菌的双重抗菌作用,实现了快速、高效的协同抗菌行为。海藻酸钠是从褐藻类中提取而来的一种生物多糖,其降解产物海藻酸钠寡糖(AOS)具有促进植物生长、缓解非生物胁迫和诱导抗病的作用[39]。利用海藻酸钠所合成的银纳米颗粒(S-AgNPs)在1.0 μg·mL-1时就能高效抑制赤星病菌生长,一方面可能是病菌对药剂的敏感性存在差异,另一方面也可能是包覆在银纳米颗粒表面的海藻酸钠在使用过程中降解产生了海藻酸钠寡糖,增强了抗菌效果。
综上所述,绿色合成银纳米颗粒可成为增强银纳米颗粒抗菌活性、降低银纳米颗粒生物毒性的重要途经之一[32,38,40],同时此类方法也增强了银纳米颗粒在赤星病防治工作中的应用前景,有望成为烟草赤星病防治研究的一个新方向。
4 结论
利用海藻酸钠成功合成了粒径统一、稳定性高、分散性强的海藻酸钠-银纳米颗粒,所合成的银纳米颗粒在低浓度下便具有高效抑制赤星病菌的活性,其主要通过破坏菌丝细胞膜通透性,抑制可溶性蛋白合成等途经抑制菌丝生长,最终实现抑制病菌侵染植株,具有广阔的农业应用前景。
[1] 刘学敏, 常稳, 李大壮. 烟草赤星病研究现状及存在问题. 东北农业大学学报, 2000, 31(1): 80-85.
LIU X M, CHANG W, LI D Z. Researching advance of tobacco brown spot caused by., 2000, 31(1): 80-85. (in Chinese)
[2] 朱俊峰. 中国烟草产业发展研究[D]. 长春: 吉林农业大学, 2008.
ZHU J F. tobacco industry development in China[D]. Changchun: Jilin agricultural university, 2008. (in Chinese)
[3] 张万良, 翟争光, 谢扬军, 栗广增. 烟草赤星病研究进展. 江西农业学报, 2011, 23(1): 118-120.
ZHANG W L, ZHAI Z G, XIE Y J, LI G Z. Research advance in tobacco brown spot., 2011, 23(1): 118-120. (in Chinese)
[4] 刘丹, 段宁东, 董毅明, 杨明. 普洱市烟叶种植的比较效益分析. 安徽农业科学, 2013, 41(3): 1372-1375.
LIU D, DUAN N D, DONG Y M, YANG M. Analysis of the comparative effectiveness of planting tobacco in Puer City., 2013, 41(3): 1372-1375. (in Chinese)
[5] 王佩, 欧雅姗, 张强, 孙渭, 朱浩, 齐宁海, 陈耀锋. 烟草赤星病研究进展. 安徽农业科学, 2018, 46(21): 33-36.
WANG P, OU Y S, ZHANG Q, SUN W, ZHU H, QI N H, CHEN Y F. Research advance in tobacco brown spot., 2018, 46(21): 33-36. (in Chinese)
[6] STAVELY J R, MAIN C E. Influence of temperature and other factors on initiation of tobacco brown spot., 1970, 60: 1591-1596.
[7] CHEN Y H, LU M H, GUO D S, ZHAI Y Y, MIAO D, YUE J Y, YUAN C H, ZHAO M M, AN D R. Antifungal effect of magnolol and honokiol fromoncausing tobacco brown spot., 2019, 24: 2140.
[8] 易龙, 肖崇刚. 烟草赤星病防治研究进展. 植物保护, 2003, 29(5): 10-14.
YI L, XIAO C G. Advances in studies on control of tobacco brown spot., 2003, 29(5): 10-14. (in Chinese)
[9] TIAN L, MEI G Y, LONG Z F, LUO D Q.Effects offungicides on tobacco brown spot and yield of flue-cured tobacco leaves., 2016, 17(7): 1736-1737, 1748.
[10] 蒋彩虹, 罗成刚, 任民, 杨爱国, 冯全福, 王元英. 一个与净叶黄抗赤星病基因紧密连锁的ssr标记. 中国烟草科学, 2012, 33(1): 19-22.
JIANG C H, LUO C G, REN M, YANG A G, FENG Q F, WANG Y Y. A SSR marker tightly linked to the resistant gene of Jingyehuang on tobacco brown spot., 2012, 33(1): 19-22. (in Chinese)
[11] 孟建玉, 曹毅, 陆宁, 商胜华. 贵州省烟草赤星病菌对菌核净的抗药性. 植物保护学报, 2013, 40(5): 479-480.
MENG J Y, CAO Y, LU N, SHANG S H. Resistance ofto dimethachlon in Guizhou Province., 2013, 40(5): 479-480. (in Chinese)
[12] OLSON M E, WRIGHT J B, LAM K, BURRELL R E. Healing of porcine donor sites covered with silver-coated dressings., 2010, 166(6): 486-489.
[13] AYMONIER C, SCHLOTTERBECK U, ANTONIETTI L, ZACHARIAS P, THOMANN R, TILLER J C, MECKING S. Hybrids of silver nanoparticles with amphiphilic hyperbranched macromolecules exhibiting antimicrobial properties., 2002, 8(24): 3018-3019.
[14] Aguilar-Mendez M A, Martin-Martinez E S, Ortega- Arroyo L, Cobian-Portillo G, Sanchez-Espindola E. Synthesis and characterization of silver nanoparticles: effect on phytopathogen., 2011, 13(6): 2525-2532.
[15] RAI M, YADAV A, GADE A. Silver nanoparticles as a new generation of antimicrobials., 2009, 27: 76-83.
[16] ELBESHEHY E K F, ELAZZAZY A M, Aggelis G. Silver nanoparticles synthesis mediated by new isolates ofspp., nanoparticle characterization and their activity againstand human pathogens., 2015, 6: Article 453.
[17] SINGH D, KUMAR A. Identifying knowledge gaps in assessing health risks due to exposures of nanoparticles from contaminated edible plants//RAJU N J, GOSSEL W, RAMANATHAN A L, SUDHAKAR M.:. Springer International Publishing, 2015: 235-247.
[18] WANG S J, ZHANG Y W, Ma H L, ZHANG Q L, XU W G, PENG J, LI J Q, YU Z Z, ZHAI M L. Ionic-liquid-assisted facile synthesis of silver nanoparticle-reduced graphene oxide hybrids by gamma irradiation., 2013, 55: 245-252.
[19] De FARIAS V L, MONTEIRO K X, RODRIGUES S, FERNANDES F A, PINTO G A. Comparison ofspore production on potato dextrose agar (PDA) and crushed corncob medium., 2010, 56(5): 399-402.
[20] 阮元, 任伟, 申进文, 孙晓萍, 麻兵继, 王晓龙, 徐俊蕾. 盐酸小檗碱对植物病原真菌抑制作用及其抑菌的生理指标分析. 河南农业大学学报, 2014, 48(2): 194-198.
RUAN Y, REN W, SHEN J W, SUN X P, MA B J, WANG X L, XU J L. Inhibition effect of berberine hydrochloride on plant pathogenic fungi and its inhibition physiological index analysis., 2014, 48(2): 194-198. (in Chinese)
[21] JO Y K, KIM B H, JUNG G. Antifungal activity of silver ions and nanoparticles on phytopathogenic fungi., 2009, 93(10): 1037-1043.
[22] 贺刚, 廖衡斌, 李文宇, 朱旭东. 烟草品种和打顶时期对烟草赤星病发病情况的影响. 农学学报, 2017, 7(12): 65-69.
HE G, LIAO H B, LI W Y, ZHU X D. Influence of varieties and topping time on tobacco brown spot morbidity., 2017, 7(12): 65-69. (in Chinese)
[23] 宋莉莎, 司世飞, 龙友华, 刘仁祥, 李忠. 烟草赤星病生防芽孢杆菌的筛选鉴定及其生长条件研究. 河南农业科学, 2019, 48(1): 84-89.
SONG L S, SI S F, LONG Y H, LIU R X, LI Z. Isolation, identification and growth conditions analysis of antagonisticagainst tobacco brown spot., 2019, 48(1): 84-89. (in Chinese)
[24] 曾超宁, 车腾飞. 不同化学药剂对烟草赤星病的防治效果. 安徽农业科学, 2015, 43(24): 99-100, 113.
ZENG C N, CHE T F. Control effects of different chemical agents against brown spot., 2015, 43(24): 99-100, 113. (in Chinese)
[25] 李华. 农药合成新技术. 化学工程与装备, 2012(1): 109-110, 116.
LI H. New technology of pesticide synthesis., 2012(1): 109-110, 116. (in Chinese)
[26] 许灵杰, 谭应举, 邹光进, 蔡翼杨, 杨静, 张继, 曲振飞, 杨金陆. 烟草赤星病研究进展及防治对策. 农技服务, 2018, 35(6): 53-55, 57.
XU L J, TAN Y J, ZOU G J, CAI Y Y, YANG J, ZHANG J, QU Z F, YANG J L. Research progress and control countermeasures of tobacco brown spot., 2018, 35(6): 53-55, 57. (in Chinese)
[27] PRABHU S, POULOSE E K. Silver nanoparticles: mechanism of antimicrobial action, synthesis, medical applications, and toxicity effects., 2012, 2: 32.
[28] RAI M, KON K, INGLE A, DURAN N, GALDIERO S, GALDIRO M. Broad-spectrum bioactivities of silver nanoparticles: the emerging trends and future prospects., 2014, 98(5): 1951-1961.
[29] MEDDA S, HAIRA A, DEY U, BOSE P, MONDAL N K. Biosynthesis of silver nanoparticles fromleaf extract and antifungal activity againstsp. andsp.., 2015, 5(7): 875-880.
[30] QIAN Y Q, YU H M, HE D, YANG H, WANG W T, WAN X, WANG L. Biosynthesis of silver nanoparticles by the endophytic fungusand their activity against pathogenic fungi., 2013, 36(11): 1613-1619.
[31] KATHIRAVAN V, RAVI S, ASHOKKUMAR S, VELMURUGAN S, ELUMALAI K, KHATIWADA C P. Green synthesis of silver nanoparticles usingleaf extract and their antibacterial and antifungal activities.:, 2015, 139: 200-205.
[32] MISHRA S, SINGH B R, SINGH A, KESWANI C, NAQVI A H, SINGH H B. Biofabricated silver nanoparticles act as a strong fungicide againstcausing spot blotch disease in wheat., 2014, 9(5): e97881.
[33] KLAUS T, JOERGER R, OLSSON E, GRANQVIST C G. Silver- based crystalline nanoparticles, microbially fabricated., 1999, 96(24): 13611-13614.
[34] KalimuthuK, Babu R S, VENKATARAMAN D, BILAL M, GURUNATHAN S. Biosynthesis of silver nanocrystals by.:, 2008, 65(1): 150-153.
[35] SUNDARAVADIVELAN C, PADMANABHAN M N. Effect of mycosynthesized silver nanoparticles from filtrate ofagainst larvae and pupa of dengue vectorL.., 2014, 21(6): 4624-4633.
[36] LOK C N, HO C M, CHEN R, HE Q Y, YU W Y , SUN H Z, TAM P K H, CHIU J F, CHE C M. Silver nanoparticles: partial oxidation and antibacterial activities., 2007, 12(4): 527-534.
[37] WANG W, CHEN X, EFRIMA S. Silver nanoparticles capped by long-chain unsaturated carboxylates., 1999, 103(34): 7238-7246.
[38] WEI D W, SUN W Y, QIAN W P, YE Y Z , MA X Y. The synthesis of chitosan-based silver nanoparticles and their antibacterial activity., 2009, 344(17): 2375-2382.
[39] 郭卫华, 赵小明, 杜昱光. 海藻酸钠寡糖对烟草幼苗生长及光合特性的影响. 沈阳农业大学学报. 2008, 39(6): 648-651.
GUO W H, ZHAO X M, DU Y G. Effects of alginate oligosaccharides on growth and photosynthetic characters of tobacco seedlings., 2008, 39(6): 648-651. (in Chinese)
[40] AHMAD A, MUKHERJEE P, SENAPATI S, MANDAL D, KHAN M I, KUMAR R, SASTRY M. Extracellular biosynthesis of silver nanoparticles using the fungus.:, 2003, 28(4): 313-318.
Preparation of A Novel Silver Nanoparticle and Its Antifungal Mechanism Against
XIANG ShunYu1,3, WANG Jing1, XIE ZhongYu1, SHI Huan1, CAO Zhe1, JIANG Long1, MA XiaoZhou1,3, WANG DaiBin4, ZHANG Shuai5, HUANG Jin2,3, SUN XianChao1,3
(1College of Plant Protection, Southwest University, Chongqing 400715;2School of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715;3Chongqing Key Laboratory of Soft-Matter Material Chemistry and Function Manufacturing, Southwest University, Chongqing 400715;4Chongqing Tobacco Science Research Institute, Chongqing 400715;5Chongqing Tobacco Company Youyang Branch, Chongqing 409800)
【】In order to explore the agricultural application prospect of biological polysaccharide synthesis of silver nanoparticles and provide a theoretical basis for the development of safe and efficient antifungal agent, the silver nanoparticle based on the polysaccharide was prepared and its inhibitory activity and mechanism againstwas analyzed【】The sodium alginate was used as reductant and surfactant to synthesize the silver nanoparticles in water bath (65℃). The transmission electron microscopy (TEM), scanning electron microscopy (SEM), atomic force microscopy (AFM), ultraviolet spectrophotometer (Uv-vis), Zeta potential-particle size analyzer and X-ray diffraction energy spectrum (XPS) were used to characterize and analyze the particle size, dispersion, stability and chemical composition of S-AgNPs, respectively. The Nano measure software was used to measure the mean particle size of S-AgNPS in TEM and AFM images. Then, the S-AgNPs inhibition ability against mycelial growth was tested in the potato dextrose agar medium (PDA) with different S-AgNPs concentrations (0.0625, 0.125, 0.25, 0.5, 1.0 μg·mL-1). Aftercultivated in the liquid PDA medium (PDB) with S-AgNPs at the concentration of 1.0 μg·mL-1, the effects of S-AgNPs on the mycelium weight, morphology, the cell membrane permeability and the soluble protein content were investigated by testing the fresh and dry weights of mycelia, SEM observation, conductivity measurement and coomassie brilliant blue G-250 solution stain. Then, the control efficacy of S-AgNPs ontobacco brown spot was testedleaves by the spore suspension injection method. Finally, crucian carp was used to evaluate the biosafety of S-AgNPs.【】The TEM, AFM and SEM images showed that the strategy could be used to well control the size of the S-AgNPs (average particle size of 9.83 nm), and the prepared S-AgNPs showed a high stability and dispersibility in aqueous solvent. The results of bioassay showed that the inhibition rate of S-AgNPs on the growth ofreached 83.9% at 1.0 μg·mL-1. The fresh weight and dry weight of mycelium in S-AgNPs treatment group were significantly lower than those of the control group. The SEM image of mycelium showed that S-AgNPs could obviously destroy mycelium surface structure. Further investigation on the antifungal mechanism of S-AgNPs showed that S-AgNPs could destroy the biofilm structure by inhibiting the synthesis of soluble total protein in, reducing the water retention capacity of biofilm, rapidly destroying the membrane permeability of mycelium and causing a large amount of cytoplasmic leakage to inhibit the growth and development of mycelium. Finally,experiments confirmed that S-AgNPs could effectively inhibitinfecting tobacco leaves. Moreover, S-AgNPs in the effective antifungal concentration had no toxic effect on crucian carp and did not affect its normal life.【】The method established in this study can stably synthesize silver nanoparticles with good dispersion, uniform particle size and strong stability. In addition, the silver nanoparticle has a strong inhibitory ability againstand can effectively control tobacco brown spot, which suggests that S-AgNPs has a potential application prospect.
silver nanoparticle; sodium alginate; green synthesis;;tobacco brown spot;antifungal mechanism

10.3864/j.issn.0578-1752.2020.14.012
2020-01-02;
2020-02-15
国家自然科学基金(31670148,31870147)、中央高校基本科研业务费专项资金(XDJK2020B064)、中国烟草总公司重庆公司科技项目(NY20180401070010,NY20180401070001,NY20180401070008)
向顺雨,E-mail:xiangshunyu0325@163.com。
孙现超,E-mail:sunxianchao@163.com。通信作者黄进,E-mail:huangjin2015@swu.edu.cn
(责任编辑 岳梅)

