大黄酸对过氧化氢诱导心肌细胞损伤的保护作用
刘 钰,刘 晶,潘 涛
0 引 言
氧化应激在心力衰竭、心肌缺血再灌注损伤、心肌病、高血压、动脉粥样硬化、代谢综合征和心房颤动等各种心血管疾病的发病中起着至关重要的作用[1-3]。氧化应激导致活性氧的过度生成,这是心血管疾病发展中的一个重要事件[4]。过量的活性氧会对心肌细胞造成严重损害,从而损害氧化抗氧化平衡系统[5]。此外,损伤的进一步发展可导致细胞凋亡[6]。氧化应激和细胞凋亡在心血管疾病的发展中起着重要作用[7]。减轻氧化应激和/或直接干预细胞凋亡可以为治疗心血管疾病提供潜在的分子靶点[8]。
大黄酸(4,5-二羟基蒽醌-2-羧酸)是从大黄中分离出来的一种蒽醌类化合物,具有保肝、消炎、抗氧化、抗癌和抗菌的药理作用[9-12]。最近的研究表明,大黄酸可以保护胰腺β细胞免受高血糖诱导的细胞凋亡[13]。大黄酸的衍生物argirein可以逆转ISO刺激的心肌细胞FKBP12.6/12表达的下调[14]。除此之外,大黄酸能够通过抑制糖原合成酶3β(GSK3β)活性保护心肌细胞缺氧/复氧损伤[15]。然而,大黄酸对心肌细胞损伤的作用以及可能的作用机制仍不清楚。因此,在该研究中,我们建立过氧化氢(H2O2)诱导的大鼠心肌细胞H9c2损伤模型,通过氧化应激以及细胞凋亡等方面探索大黄酸对H9c2细胞氧化损伤的保护作用以及作用机制。
1 材料与方法
1.1 材料
1.1.1细胞大鼠心肌细胞H9c2来自美国培养细胞保藏中心(Manassas,VA,USA)。
1.1.2药品与试剂大黄酸来自中国药科大学王广基院士赠送,纯度>95%。30% H2O2购自沪试生物公司;DMEM basic、胎牛血清与0.25% Trypsin-EDTA均购自Gibco生物公司;4%多聚甲醛购自biosharp生物公司;6孔板购自WHB卧宏生物科技公司;Western细胞裂解液、SDS-PAGE蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒均购自Beyotime公司;MTT(四甲基偶氮唑)购自南京萌邦生物公司;兔抗p-p38、兔抗p38、兔抗p65、兔抗p-p65、兔抗JNK、兔抗p-JNK和内参抗体兔抗GAPDH购自Abcam(Cambridge,MA,USA);山羊抗兔IgG/辣根酶标记购自北京中杉金桥生物技术公司;其他所有抗体和化学品均购自Sigma-Aldrich公司。
1.1.3仪器Western电泳仪和电泳槽,美国Bio-rad公司;MCO-15AC型二氧化碳培养箱,德国Heraeus公司;SW-CJ-2FD型超净化工作台,苏州佳宝净化工程设备有限公司;多功能酶标仪(型号SpectraMax M5),美国Molecule Device公司;-80 ℃冰箱,中国海尔BCD-258A/C;4 ℃冰箱,中国海尔公司;光学显微镜和荧光倒置显微镜,上海光学仪器厂;电热恒温水槽,上海精宏实验设备有限公司;台式高速冷冻离心机,Thermo Fisher Scientific;电子天平(型号BSA124S),赛多利斯科学仪器有限公司。
1.2实验方法
1.2.1 MTT法检测H9c2细胞活力将H9c2心肌细胞(5000个细胞/孔)铺在24孔板中,用不同浓度的大黄酸(0.25、0.5、1 μg/mL)处理12 h后[15],300 μmol/L H2O2继续处理2 h,加入MTT孵育4 h,在550 nm处测定相对A值。大黄酸干预后,H9c2细胞的活力得到增强,且呈一定的剂量依赖关系。后期实验我们选用大黄酸(1 μg/mL),作用时间为12 h进行后续实验。
1.2.2大鼠心肌细胞H9c2损伤模型的建立和分组大鼠心肌细胞H9c2置于含10%胎牛血清的DMEM/F12的培养基中于37 ℃、5% CO2中培养,每2 天传代1次,取对数生长期的细胞用于实验。取对数生长期的H9c2细胞,以1×105个/ mL的密度接种于60 mm的培养皿中,在37 ℃、5% CO2环境中孵育24 h,用H2O2(300 μmol/L,无血清培养液)干预H9c2细胞2 h,构建H9c2损伤模型[16]。将H9c2细胞分为3组:空白对照组、H2O2诱导组和大黄酸干预组(1 μg/mL)。
1.2.3生化法检测H9c2细胞中谷胱甘肽过氧化酶(GSH-Px)和过氧化氢酶(CAT)含量收集各组H9c2细胞并重悬,离心后弃上清,按照GSH-Px和CAT试剂盒说明说检测其含量。
1.2.4qRT-PCR收集各组H9c2细胞,Trizol法提取总RNA,并反转录合成cDNA后进行聚合酶链式反应。参照PCR试剂盒说明书进行qRT-PCR反应。程序设定:95 ℃ 15 min;94 ℃ 5 s;55 ℃ 30 s;70 ℃ 30 s,共40个循环。以GAPDH为内参基因,用2-△△Ct法计算目的RNA的相对表达量。引物序列:IL-6 forward:5′-AGAGACTTCCATCCAGTTGCC-3′,reverse:5′-CCGGACTTGTGAAGATGGG AA-3′;IL-1β forward:5′-TGGGTTGCCAAGCCTTATCG-3′,reverse:5′-TTCAGCT TCTCACCCAGGGA-3′;IL-1α forward:5′-GCCATATCGGCTCGCAAATC-3′,reverse:5′-AACGAATGCCGAAACCTCCTC-3′;TNF-α forward:5′-ACCGTCAGC CGATTTGCTAT-3′,reverse:5′-CCGGACTCCGCAAAGTCTAA-3′;Bax forward:5′-GCCTCTACACCGATGAGTAA-3′,reverse:5′-GGAAAGGACTACACCACC T-3′;Bcl-2 forward:5′-TCGGAAAGAAATGTCCCAGGTGGA-3′,reverse:5′-TGG AACTGGTTCTCCTTACAGCCA-3′;Caspase-3 forward:5′-ACTGATGCTGGTGA CAAC-3′,reverse:5′-CCGACTTGTGAAGTGGTATAG-3′;Caspase-9 forward:5′-TGGTGCACAGCTCCTTCA-3′,reverse:5′-TAGTGCAGACACCAAGCTC C-3′;GAPDH forward:5′-ATTCAACGGCACAGTCAAGG-3′,reverse:5′-GCAGA AGGGGCCGGAGATGA-3′。
1.2.5蛋白质提取和蛋白质印迹分析收集各组H9c2细胞,加入RIPA缓冲液提取蛋白,每个蛋白(30 μg)上样,通过10% SDS-PAGE进行蛋白分离,然后电泳转移到PVDF膜上。PVDF膜放入5%脱脂牛奶中封闭2 h,随后在室温下孵育一抗:抗p-p38、抗p38、抗p65、抗p-p65、抗JNK、抗p-JNK和抗GAPDH。4 ℃孵育过夜,PBST清洗3次,每次10 min,继而进行二抗孵育2 h,最后PBST清洗3次,每次10 min。GAPDH作为内参蛋白。
1.2.6免疫荧光检测H9c2细胞中的Caspase-3的表达将心肌细胞H9c2行爬片培养并干预,PBS清洗1次,4%多聚甲醛固定爬片,0.25% Triton X-100透膜20 min,3% BSA清洗3次,每次10 min,然后10%山羊血清封闭1 h,倒掉封闭液,然后加入与一抗(Capase-3)混合液,4 ℃孵育过夜。3% BSA清洗3次,每次10 min,然后滴加荧光二抗混合液,避光孵育2 h。DAPI染核10 min,3% BSA清洗3次,每次10 min,抗荧光猝灭剂封固,使用荧光显微镜观察并拍照( ×200)。
1.2.7ROS染色按照1∶1000用无血清培养液稀释DCFH-DA(10 μmol/L)。各组心肌细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为(1.0~2.0)×107个/mL,37 ℃细胞培养箱内孵育20 min。无血清细胞培养液洗涤细胞3次,荧光显微镜观察各组细胞内ROS的表达水平(×200)。
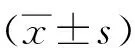
2 结 果
2.1 大黄酸对H2O2诱导的心肌细胞H9c2氧化应激的影响与空白对照组比,H2O2诱导组显著促进ROS的生成(P<0.01), 而大黄酸干预组较 H2O2诱导组显著降低(P<0.01),见图1。另外,与空白对照组比,H2O2诱导组显著抑制GSH-Px和CAT 的表达水平, 而大黄酸干预组较H2O2诱导组显著升高,见表1。
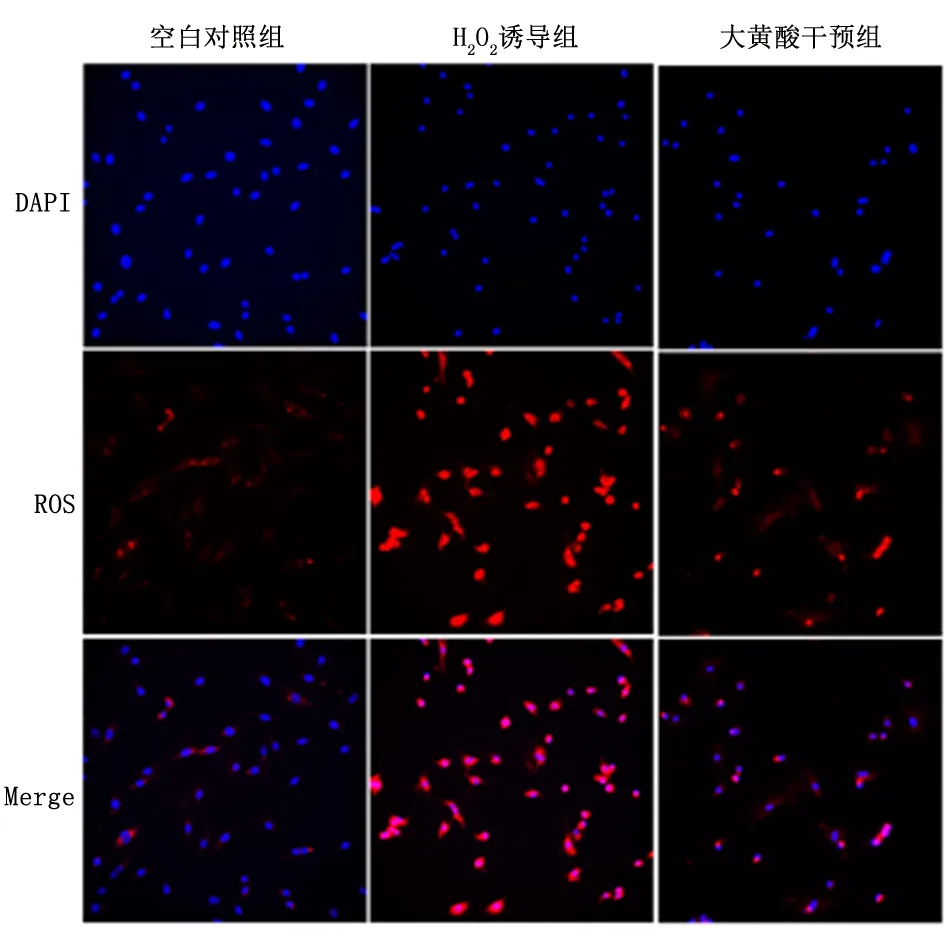
图 1 ROS荧光探针检测大黄酸对H2O2诱导的心肌细胞H9c2氧化应激的影响( ×200)
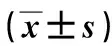
表1 大黄酸对H2O2诱导的心肌细胞H9c2氧化指标GSH-Px和CAT含量的影响
2.2大黄酸对H2O2诱导的心肌细胞H9c2炎症的影响与空白对照组比,H2O2诱导组显著促进促炎因子IL-6、TNF-α、IL-1β和IL-1α的表达, 而大黄酸干预组较H2O2诱导组显著降低(P<0.01),见表2。
2.3大黄酸对H2O2诱导的心肌细胞H9c2凋亡的影响与空白对照组比,H2O2诱导组显著促进Bax、Caspase-3和Caspase-9 mRNA的表达,抑制Bcl-2 mRNA的表达(P<0.01), 而大黄酸干预组较H2O2诱导组显著降低Bax、Caspase-3和Caspase-9 mRNA的表达,促进Bcl-2 mRNA的表达(P<0.01),见表3。另外,免疫荧光结果显示,与空白对照组比,H2O2诱导组显著促进Caspase-3 的表达水平, 而大黄酸干预组较H2O2诱导组显著升高,见图2。
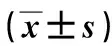
表 2 大黄酸对H2O2诱导的心肌细胞H9c2炎症的影响
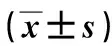
表 3 大黄酸对H2O2诱导的心肌细胞H9c2凋亡因子的影响
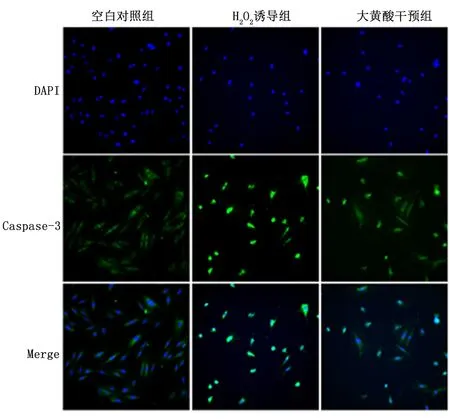
图 2 镜下观察大黄酸对H2O2诱导的心肌细胞H9c2凋亡的影响 (免疫荧光染色 ×200)
2.4大黄酸对H2O2诱导的心肌细胞H9c2中MAPK和NF-κB信号通路的影响与空白对照组比,H2O2诱导组显著激活MAPK(p-JNK和p-P38)和NF-κB(p-P65)信号通路的表达(P<0.01), 而大黄酸干预组较H2O2诱导组显著降低,见图3。
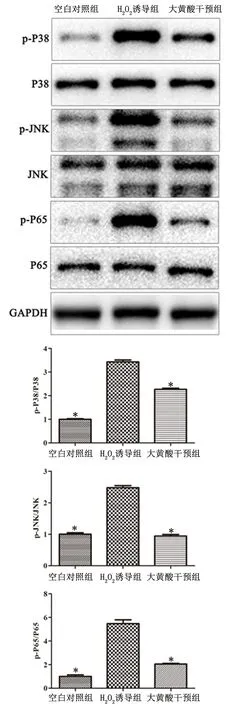
与H2O2诱导组比较,*P<0.01
3 讨 论
在本研究中我们发现大黄酸对H2O2诱导的心肌细胞损伤有显著的保护作用。心肌损伤是一个复杂的过程,最终会导致细胞损伤和心功能不全[17]。根据实验研究和临床观察,氧化应激在H2O2诱导心肌损伤中发挥着重要的作用,ROS是氧化应激过程中重要的关键因子[18-19]。心肌损伤过程中,组织的血液供应引发氧自由基的“爆炸”,攻击细胞并造成损伤。抑制ROS生成或拮抗ROS毒性可减轻心肌损伤[20]。大黄酸已被证明可抑制ROS的产生,在H2O2诱导的人脐静脉内皮细胞中,大黄酸以剂量依赖性的方式显著减少细胞中BH3结构域凋亡诱导蛋白(Bid)、含半胱氨酸的天冬氨酸蛋白水解酶Caspase-3、Caspase-8和Caspase-9的mRNA表达,减少细胞内ROS产生,从而逆转H2O2引起的细胞损伤[21]。在该实验中,我们发现H2O2暴露导致H9c2细胞内氧化应激,促进ROS的表达以及抑制GSH-Px和CAT含量,而大黄酸处理能够显著降低ROS的产生,抑制其氧化应激作用。过度的氧化应激能够促进心肌细胞的凋亡和炎症反应。显然抑制凋亡和炎症反应是减轻心肌氧化损伤的有效途径[6-7]。在本研究中,我们发现大黄酸能够显著减轻H2O2对心肌细胞H9c2的凋亡和炎症反应。
在氧化应激过程中,信号传导通路起着重要的作用。大量的证据支持了MAPK信号通路参与心肌损伤过程,心肌损伤过程中能够激活MAPK信号通路[22]。MAPK亚家族的p38和JNK引起氧化应激、炎症、细胞凋亡、死亡。有研究表明,p38和JNK的抑制可减轻氧化应激和炎症反应,维持细胞骨架结构,从而保护心肌免受损伤[23]。因此,我们认为MAPK信号通路在心肌损伤过程中起着至关重要的作用。在本研究中,我们发现H2O2能够激活MAPK信号通路(p-P38和p-JNK表达量显著提高),而大黄酸干预后,MAPK信号通路显著被抑制。NF-κB是一个系统发育保守的蛋白家族,作为核转录因子,在心肌损伤期间心脏存活、凋亡、肥大和病理重塑的调节中发挥着关键作用[24]。研究表明NF-κB的慢性或长期激活可诱导氧化应激以及炎性细胞因子的表达并导致心肌细胞凋亡[25]。在本研究中,我们发现H2O2能够激活NF-κB信号通路(p-P65表达量显著提高),而大黄酸干预后,NF-κB信号通路显著被抑制。
综上所述,大黄酸能够减轻过氧化氢诱导的心肌细胞损伤,其可能是通过抑制MAPK和NF-κB信号通路的表达进而保护心肌细胞。本研究为进一步探讨大黄酸对心肌损伤的保护作用及机制提供了理论依据,同时以期为心肌损伤的治疗提供新的潜力药物依据。

