乳腺癌组织中tRF-31的表达及其对癌细胞增殖的影响
江 盼,严 枫
0 引 言
乳腺癌是威胁女性健康最常见的恶性肿瘤,乳腺癌发病率呈现不断上升的趋势,是我国女性发病率最高的肿瘤。尽管在临床治疗和早期诊断方面取得了进展,但是乳腺癌患者的预后仍然很差,发病率和复发率较高[1]。而提高乳腺癌治愈率的关键是早发现、早诊断和早治疗。因此,寻找一种有效的生物标志物对早期乳腺癌筛查有重要的意义。
tRNA及其衍生物(tRNA-derived small RNAs, tsRNAs)是来源于tRNA切割产生的一类新型的非编码RNA[2-3],由特定的核酸酶在tRNA的环上剪切,产生的长度为14~35核苷酸(nucleotide,nt)的单链RNA。tsRNAs属于短ncRNA家族,存在于大多数生物中,并且与癌细胞中的miRNA一样丰富。近年来有越来越多的证据表明,tsRNAs在癌症中表达失调,且在癌症的发生、发展的过程中扮演着重要的角色,参与了癌症的致病过程,目前已知其在乳腺癌细胞的增殖和迁移等功能方面具有调控作用[4-5]。tRF-31是tsRNAs中的一类长度为31 nt的tRNA片段,由成熟的tRNA-His-GTG切割产生。目前关于tRF-31对乳腺癌的影响研究报道较少。本研究旨在探讨乳腺癌患者肿瘤组织中tRF-31的表达水平及其对乳腺癌细胞增殖的影响。
1 资料与方法
1.1 病理组织收集2017年11月至2019年2月南京医科大学附属肿瘤医院乳腺外科女性患者的32份肿瘤组织标本及对应的癌旁组织。Ⅰ~Ⅱ期5例,III~IV期27例,年龄为36~83岁。肿瘤组织及对应癌旁组织(距离病灶>2 cm 范围内组织)-80℃冰箱保存。纳入标准:①无任何癌症病史;②无任何放化疗、生物免疫剂使用史;③无乳腺炎症病史;④所有组织均经过病理组织学证实。排除标准:非首次确诊患者。本研究经过南京医科大学附属肿瘤医院医学伦理委员会的批准,批准号:南医大伦审(2018)471号,患者均签署知情同意书。
1.2 细胞与试剂人乳腺癌细胞MCF-7、MDA-MB-231分别来自中国科学院细胞库; DMEM培养液、Opti-MEM培养液、0.25%胰蛋白酶、CCK8试剂盒购自江苏凯基生物;胎牛血清购自Gibco公司;TRIzol LS 试剂购自美国life technologies;tRF-31抑制剂tRF-31 inhibitor、阴性对照negative control和riboSCRIPTTM 逆转录试剂盒购自广州锐博生物公司;SYBR qPCR Master mix购自南京诺唯赞生物;lipofectamine3000转染试剂购自美国Invitrogen公司;ViiA 7 实时荧光定量PCR仪产自Applied Biosystems。雷帕霉素靶蛋白(mTOR)抗体、苏氨酸激酶(AKT)抗体购于美国Abcam公司。
1.3 方法
1.3.1 tsRNAs测序分析从32份患者组织标本中选取6对乳腺癌患者的组织以及对应的癌旁组织进行高通量测序。构建每个组织样本的tsRNAs序列文库,与Mature-tRNA和Pre-tRNA参考序列对齐, 筛选出核苷酸长度为15-40nt的小RNA,使用数据库MINTbase v2.0 (http://cm.jefferson.edu/MINTbase/)将测序序列与整个基因组上的Mature-tRNA进行比对。
1.3.2 RT-PCR检测组织tRF-31的表达将乳腺癌组织、癌旁组织快速用组织研磨器研磨,采用TRIzol 法提取组织中总 RNA,用RT-PCR检测tRF-31在组织中的表达。逆转录用广州锐博生物科技公司提供的颈环法合成的特异性逆转录引物和试剂盒(riboSCRIPTTM Reverse Transcription Kit)。逆转录反应体系为10 μL,反应条件:42 ℃ 60 min,70 ℃ 10 min。qPCR使用SYBR qPCR Master mix和ABI PRISM 7500 real-time PCR system进行,反应体系为10 μL。U6作为tRF-31的内参。tRF-31的序列:GCCGTGATCGTATAGTGGTTAGTACTCTGCG;U6 PCR引物序列,FW:5′GCTTCGGCAGCACATATACTAAAAT3′;RW:5′CGCTTCACGAATTTGCGTGTCAT3′;tRF-31 PCR引物序列,FW:5′ ATCTGCCGTGATCGTATAGTGGTT 3′;RW :5′ACGTGTGCTCTTCCGATCTCG 3′。扩增条件:95 ℃,10 min;40个PCR循环(95 ℃,10 s;60 ℃,60 s)。所有样本设置3个复孔,反应结束后分析熔解曲线和扩增曲线,得到Ct值,即荧光达到阈值所需的PCR循环数,计算tRF-31的表达量。2-ΔΔCT用来表示tRF-31水平的表达量。
1.3.3 细胞培养将2种乳腺癌细胞MDA-MB-231和MCF-7接种于DMEM完全培养基(含10%FBS,100 μ/mL青霉素和链霉素),放入37 ℃、5%CO2和相对湿度为90%的培养箱中培养。观察细胞生长状态,待细胞长到培养皿的80%~90%时用0.25%胰蛋白酶消化传代。
1.3.4 细胞分组与转染选对数生长期状态良好的细胞接种于6孔板,每孔约0.8×105个细胞,培养至70%融合进行转染。设置对照组(转染negative control)和tRF-31组(转染tRF-31抑制试剂tRF-31 inhibitor)。取2个1.5mL的Ep管,每管加125 μL Opti-MEM培养液稀释5 μL P 3000TM,对照组negative control 15 μL,tRF-31组20 μmol/L tRF-31 inhibitor 15 μL;另外一管取同体积Opti-MEM培养液稀释7.5 μL Lipofectamine TM 3000,室温孵育5 min后将2种溶液混合,静置20 min,滴加到6孔板一个孔的细胞中,用Opti-MEM培养液补齐到每孔2 mL。每组设3个平行复孔,重复实验3次。转染24 h后检测转染效率。
1.3.5 细胞转染效率检测转染24 h后比较对照组和tRF-31组tRF-31的表达水平,评估转染效果。用胰蛋白酶消化培养状态良好的各组细胞,收集细胞后用TRIzol试剂提取各组细胞中总 RNA,用RT-PCR检测tRF-31在细胞株中的表达。
1.3.6CCK-8增殖实验转染24h后取对数生长期细胞,0.25%胰蛋白酶消化后制备单细胞悬液,按3×103个/孔接种于96孔板(100 μL/孔),在37 ℃、5%CO2饱和湿度的培养箱中以DMEM完全培养基继续培养,以空白孔调零。在0、24、48、72 h时每孔加入10 μL CCK-8显色试剂后,放在培养箱中继续孵育2 h,用酶标仪测量并记录各孔450 nm处的吸光度值。绘制曲线比较各组细胞的增殖情况,A450越大表示增殖的细胞数越多。实验重复3次。
1.3.7 细胞克隆形成实验转染24 h后取对数生长期细胞,0.25%胰蛋白酶消化后制备单细胞悬液,按3×103个/孔接种于6孔板,在37 ℃ 、5% CO2饱和湿度的培养箱中以DMEM完全培养基继续培养,当培养皿中出现肉眼可见的克隆时,终止培养,弃去上清液,4%多聚甲醛固定40 min,然后用0.1%结晶紫染色15 min。 通过将对照调节至100%来测量克隆形成的百分比,计算克隆形成率。
1.3.8 蛋白印迹分析将细胞收集后用RIPA裂解细胞,将含有裂解液的细胞置于4 ℃摇床平台上,剧烈振荡 30 s,放置冰上 4 min,重复 5 次。12 000×g,4 ℃离心 5 min,1000 r/min。然后,使用 BCA 试剂盒测定裂解物的蛋白质浓度,加入Loading buffer 后 90 ℃震荡加热10 min使蛋白质变性。将等量的总蛋白质加样到浓度为12%的聚丙烯酰胺凝胶上,电泳后使用转膜仪将蛋白转移到 PVDF 膜上,然后用5%的脱脂牛奶室温封闭 2 h。将PVDF 膜与特异性一抗在4 ℃温育过夜,并在室温下用相应的二抗孵育1 h。用双色红外成像系统避光扫描拍照。
1.4 统计学分析采用GraphPad prism 8.0和SPSS 25.0进行统计分析。计量资料采用均数和标准差描述,组间均值比较采用t检验,分类资料采用频数描述,组间比较采用χ2检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 tRF-31的生物信息学分析高通量测序获得31个差异表达的tsRNAs,其中17个高表达的tsRNAs,14个低表达的tsRNAs,差异倍数均(Fold Change,FC)>2,选择其中一个高表达的tRF-31(FC=6.5781,P=0.023)作为研究对象,在UCSC基因组数据库中,tRF-31定位在染色体chr1(q21.1):146,038,044-146,038,074,长度为31nt,序列为5′-GCCGTGATCGTATAGTGGTTAGTACTCTGCG-3′。
2.2 乳腺癌患者组织中tRF-31的表达量RT-PCR结果显示, tRF-31在癌组织(0.103±0.207)的表达显著高于癌旁组织(0.028±0.039),差异有统计学意义(P<0.05)。tRF-31的熔解曲线呈单峰。以上结果说明tRF-31在乳腺癌组织中显著高表达。见图1。
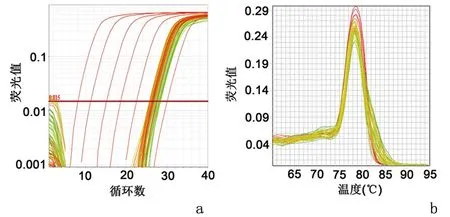
a:扩增曲线图;b:熔解曲线图
2.3 ROC曲线分析结果显示,曲线下面积(AUC):0.682,95%CI:0.548~0.817(P=0.012),最大的Youden指数是0.438,对应的Cut-off值是0.007。tRF-31 检测乳腺癌的敏感性为90.63%,特异性为53.13%,见图2。
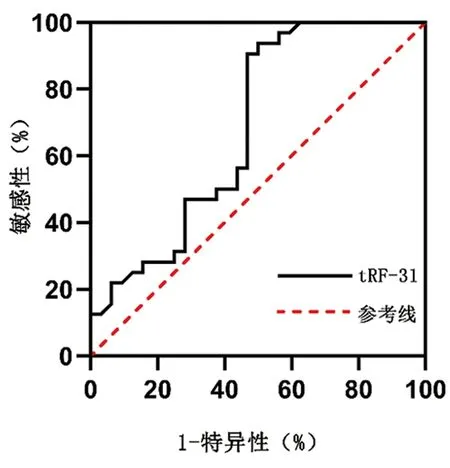
图2 tRF-31的ROC曲线分析
2.4 组织tRF-31与临床病理参数的关系tRF-31表达量的中位数为0.013。tRF-31表达水平与年龄、TNM分期、淋巴结转移无明显相关性(P>0.05),见表1。
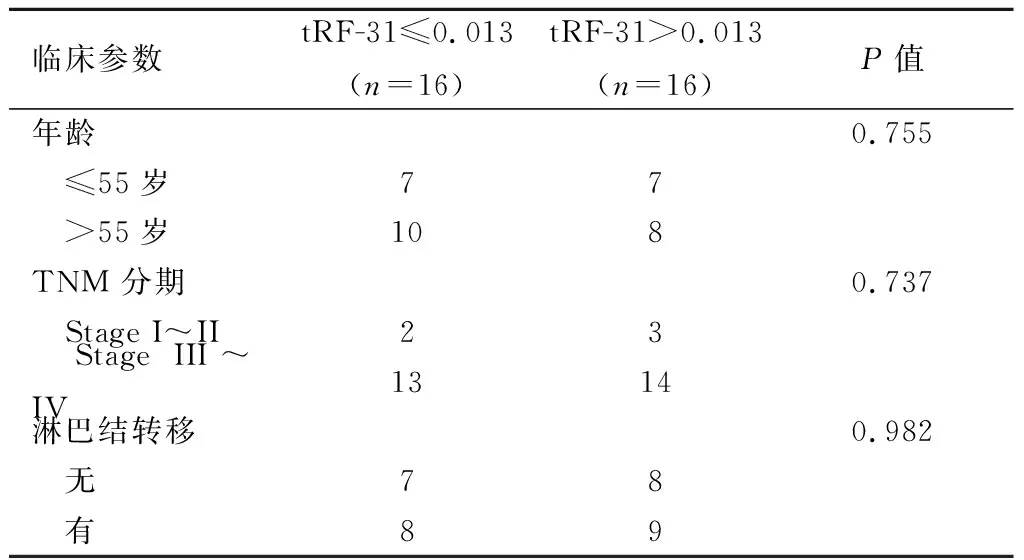
表1 乳腺癌组织tRF-31的表达水平与临床病理特征的关系(n)
2.5 细胞转染效率MDA-MB-231细胞中,tRF-31组tRF-31的表达量较对照组明显降低[(0.267±0.012)vs(1±0.040)],差异具有统计学意义(P<0.01);MCF-7细胞中,tRF-31组tRF-31的表达量较对照组亦明显降低[(0.293±0.016)vs(1±0.016)],差异具有统计学意义(P<0.01)。以上结果提示抑制tRF-31表达后可用于后续实验。
2.6 tRF-31对乳腺癌细胞增殖的影响MDA-MB-231和MCF-7细胞中,tRF-31组细胞0、 24、 48、 72 h增殖能力较对照组降低(P<0.05)。结果提示tRF-31能够促进乳腺癌细胞增殖,见图3。
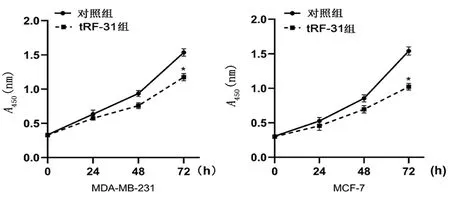
*P<0.05
2.7 下调tRF-31对乳腺癌细胞克隆形成率的影响MDA-MB-231细胞中, tRF-31组细胞克隆形成率[(43.67± 3.29)%]较对照组[(100±3.74)%]明显降低(P<0.01);MCF-7细胞中, tRF-31组细胞克隆形成率[(49±2.94)%]较对照组[(100±4.89)%]明显降低(P<0.01),见图4。以上结果说明抑制tRF-31能够降低乳腺癌细胞克隆形成的能力,即tRF-31能够促进乳腺癌细胞的增殖。
2.8 tRF-31通过激活AKT/mTOR信号通路促进乳腺癌细胞的增殖在MDA-MB-231和MCF-7细胞中,tRF-31组AKT和mTOR的蛋白水平较对照组明显下降,见图5。结果说明,AKT/mTOR信号通路可能参与了tRF-31诱导的乳腺癌细胞增殖过程。

图 4 tRF-31对乳腺癌细胞克隆形成能力的影响
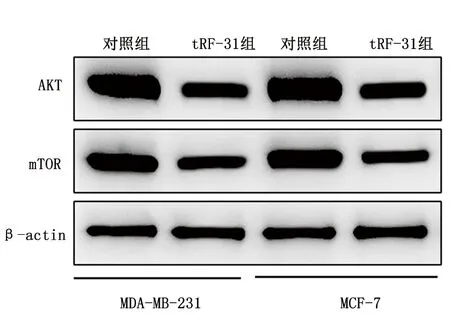
图 5 MDA-MB-231和MCF-7细胞中AKT和mTOR的表达
3 讨 论
过去由于人们对tRNAs的认识不足,tsRNAs通常被认为是microRNA或降解产物[6-7]。tsRNAs首先在原核生物中被发现,随着研究的深入真核生物中的tsRNAs也逐渐被揭开。它们在早期研究中与机体受到外界刺激密切相关,但近年来,越来越多的证据证明tsRNAs在癌症中起关键作用[8]。与miRNA相似,tsRNAs作为基因表达介质,在翻译或转录后水平调节基因功能[9]。tsRNAs可能参与核糖体的形成,特定tsRNA的缺失会严重破坏核糖体的加工,从而影响整个翻译过程[10]。tsRNAs影响翻译起始复合物的装配并在翻译水平上调节蛋白质的产生[11-12]。Sun等[13]研究发现,tsRNAs以类似于miRNA的方式调节基因表达,并通过与靶基因互补发挥生物学作用。由于它们大量存在于原核生物和真核生物中,tsRNAs也被认为是最保守的小非编码RNA之一[14-15]。研究表明,一种来源于tRNA尾部的tRF-U3-1能够隔离La/SSB在细胞质中的表达,从而导致对各种RNA病毒的抗性,可用于抑制某些癌症病毒[16]。
tsRNAs在许多肿瘤的肿瘤组织和正常组织之间存在显著性差异表达[17-18],如乳腺癌[19]、卵巢癌[20]、慢性淋巴细胞白血病[21]、口腔鳞癌[22]等。越来越多的具有调控作用的tsRNAs被人们发现,生物学教授Falconi鉴定出了一种新的tsRNAs (命名为tRF3E),它来自于成熟tRNA-Glu,在乳腺腺癌中特异性表达。tRF3E与P53 结合核仁蛋白(NCL)导致P53表达过量,抑制了乳腺癌的发展,提示tsRNAs可以作为肿瘤抑制剂[23]。2017年的报道中指出,在非小细胞肺癌(NSCLC)患者的组织鉴别出了高表达的tRF- Leu- CAG,该分子在血清中含量与病程进展显著相关,并且tRF-Leu- CAG抑制了细胞的增殖,阻碍了细胞的周期,提示该tsRNA可能成为NSCLC新的诊断标志物和潜在的治疗靶点[24]。本研究通过高通量基因测序分析发现与正常组织相比,乳腺癌肿瘤组织中tRF-31的表达量升高,提示tRF-31可能在乳腺癌中扮演着重要角色。为进一步确认测序结果,本研究在32例乳腺癌患者组织和癌旁组织中检测tRF-31的表达情况,发现tRF-31在乳腺癌肿瘤组织中的表达量显著高于癌旁组织。为进一步确认tRF-31在乳腺癌中的生物学作用,在MDA-MB-231和MCF-7乳腺癌细胞中下调tRF-31,在生物学功能检测中发现下调 tRF-31 后可显著抑制MDA-MB-231和MCF-7细胞增殖能力。上述研究表明,tRF-31在乳腺癌组织和细胞中存在异常表达,并且异常表达的tRF-31参与了乳腺癌细胞的增殖。文献证明Akt/mTOR信号通路在在调节乳腺癌细胞增殖中起关键作用[25-26]。本研究发现转染tRF-31 inhibitor抑制了Akt和mTOR的表达。因此,我们推测tRF-31可以通过Akt/mTOR信号通路促进乳腺癌细胞的增殖。本研究的不足之处在于由于临床样本量较少只对tRF-31做了初步探索,需要更多的研究来验证tRF-31促进细胞增殖的机制。
综上所述,本研究发现tRF-31在乳腺癌组织中的表达量显著高于对应的癌旁组织,其诊断敏感性为90.63%,特异性为53.13%;同一个指标,一般敏感性越高,则特异性越低;反之,特异性越高,则敏感性越低。此处的敏感性指的是tRF-31在诊断乳腺癌的时候不漏诊的概率,而特异性指的是tRF-31在诊断乳腺癌时不误诊的概率。进一步研究可通过扩大组织病例数,提高特异性。tRF-31促进乳腺癌细胞的恶性增殖,其表达水平与肿瘤分期、淋巴结转移等临床病理特征没有明显相关性,可能是由于乳腺癌是一种异质性很高的肿瘤,有待于进一步扩大样本量、收集不同组织学类型的肿瘤组织进行研究。本研究为tRF-31作为乳腺癌治疗靶点提供了实验依据。目前,tRF-31分子机制值得进一步深入探讨。

