过表达GATA-4基因的骨髓间充质干细胞外泌体对心肌梗死后心功能的影响
李 敏,王梓豪,严 丹,谢巧丽,撒亚莲,贺继刚
0 引 言
有研究证实,过表达GATA-4的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)分泌的外泌体 (BMSCGATA-4-外泌体)可以促进BMSC向心肌样细胞分化并改善心肌梗死后心功能,并发现BMSCGATA-4-外泌体中miRNA-673-5p明显高表达[1]。因此,分析BMSCGATA-4-外泌体可能是修复心肌损伤的关键分子。基于此,本实验利用小鼠心肌梗死模型,通过尾静脉注射过表达miRNA-673-5p的BMSC分泌的外泌体48 h后,利用心脏彩超评估小鼠心肌梗死后心功能恢复情况,探讨分析BMSCGATA-4-外泌体改善心肌梗死后心功能的分子调控机制,为临床转化应用提供实验数据。
1 材料与方法
1.1 材料DMEM/F12基础培养基(美国 gibco公司),外泌体提取试剂盒(广州市锐博生物科技有限公司),Bulge-Loop miRNA qRT-PCR Starter Kit(广州市锐博生物科技有限公司),Bulge-Loop miRNA qRT-PCR Primer(广州市锐博生物科技有限公司),miRNA-673-5p mimic试剂盒、miRNA-673-5p inhibitor试剂盒(广州市锐博生物科技有限公司),α-actin引物、CX43引物、Desmin引物、cTnT引物(invitrogen公司)、miRNA-673-5p(广州市锐博生物科技有限公司),Tsc-1 抗体(abcam公司),Erk1/2抗体(CST公司),Mef2c抗体(abcam公司)。
1.2 方法
1.2.1 小鼠BMSC的分离、培养及鉴定全骨髓培养小鼠BMSC,胰蛋白酶消化传至第3代时采用CD11b的磁珠负选,去除造血祖细胞。继续传至第7代。取增殖至第7代BMSC,待细胞汇合达80%~90%时。而后按Cyagen Biosciences公司脂肪、骨、软骨分化说明书操作完成小鼠BMSC三系分化检测。
1.2.2 构建过表达GATA-4基因BMSC将已构建成功的GATA-4基因插入慢病毒包装质粒GV308中,构建GV308-GATA-4重组慢病毒包装质粒。将构建成功的GV308-GATA-4重组慢病毒包装质粒转染入小鼠BMSC并加入基因开启剂强力霉素,具体见参考文献[1]。
1.2.3 实验动物健康4周龄SPF级C57BL/6 小鼠25只,均为雄性,由成都达硕实验动物中心提供,动物许可证号为SCXK(川)2015-030,饲养条件:温度(23±2)℃,湿度45%~55%,光照12 h,通风良好,所有动物的喂养、观察均按照非临床研究管理规范规定执行。
1.2.4 小鼠心肌梗死模型的建立直视下气管插管与小动物呼吸机连接,由第3肋间进入胸腔,以肺动脉圆锥与左心耳右缘之间交点和心尖的假想连线为小鼠冠状动脉前降支走行标志,以9/0缝线于左心耳根部下方,缝扎的方向和左心耳的下缘平行,结扎成功标志为左心室前壁及心尖周围心肌组织运动减弱,缝合关胸。
1.2.5 细胞的分组及处理实验分为BMSC组、空载体组、GATA-4组、模拟组、抑制组,BMSC细胞分别转染空载体、GATA-4、miR-673-5p-mimic、miR-673-5p-inhibitor,将BMSC-外泌体、BMSC空载体-外泌体、BMSCGATA-4-外泌体、 BMSCmiR-673-5p-mimic-外泌体、BMSCmiR-673-5p-inhibitor-外泌体分别于小鼠建模后48 h经尾静脉分别注入各组,每组3只。另设正常组(不建模,尾静脉注射相同量的等渗盐水),梗死未处理组(建模,但未给予任何外泌体处理)作为对照,每组3只。各组于48 h采用心脏彩超(PHILIPS EPIQ 7C)评估心功能改变。
1.2.6 检测各组心肌细胞内miRNA-673-5p及心肌细胞α-actin、CX43、Desmin、cTnT表达取相同部位(心肌梗死结扎线以下1 cm)心肌组织,采用RT-PCR方法检测各组心肌细胞内miRNA-673-5p、α-actin、CX43、Desmin、cTnT表达的量。提取总RNA,按照Bulge-Loop miRNA qRT-PCR Starter Kit 和 Bulge-Loop miRNA qRT-PCR Primer试剂盒说明合成cDNA第一条链。随后完成目的基因扩增(95 ℃:10 min;95 ℃:2 s ;60 ℃:20 s;70 ℃:10 s)。收集信息,做Ct值分析。
1.2.7 采用数据库明确miRNA-673-5p的靶基因根据12个miRNA靶基因预测数据库对miRNA-673-5p的靶基因进行预测(筛选条件 同一个靶基因必须被≥10个数据库检索到同时靶基因与miRNA的匹和度≥8),可见miRNA-673-5p对应的靶基因为:Tsc-1、Erk1/2、Mef2c。
1.2.8 Western blot检测提取上述各组心肌细胞内蛋白质,检测各组心肌细胞内Tsc-1 、Erk1/2(细胞外调节蛋白激酶)、Mef2c的表达。
2 结 果
2.1 小鼠BMSC三系分化结果BMSC三系分化可见脂肪、骨及软骨细胞,见图1。
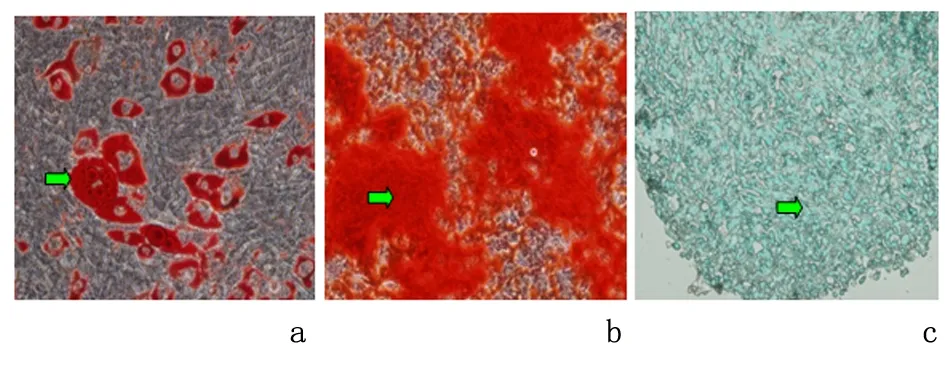
a:脂肪分化;b:骨分化;c:软骨分化绿色箭头示分化细胞
2.2 慢病毒转染小鼠BMSC后24 h GATA-4的表达慢病毒转染小鼠BMSC 24 h后,过表达GATA-4组GATA-4基因表达丰度(97.27±8.73)较阴性对照组(1.00±0.03)明显升高(P<0.05)。
2.3 采用心脏彩超评估心功能改变BMSC组、空载体组、GATA-4组、模拟组、抑制组心功能较梗死未处理组和正常组改善(P<0.05)。GATA-4组、模拟组较BMSC组和空载体组改善(P<0.05);与GATA-4组比,模拟组心功能改善、抑制组心功能恶化(P<0.05)。见图2。
2.4 RT-PCR检测各组心肌细胞内miRNA-673-5p表达梗死未处理组miRNA-673-5p表达较正常组减少,而BMSC组、空载体组、GATA-4组、模拟组、抑制组较正常组和梗死未处理组增多(P<0.05);GATA-4组、模拟组较BMSC组和空载体组增多(P<0.05);与GATA-4组比,模拟组增多,抑制组减少(P<0.05)。见图3。
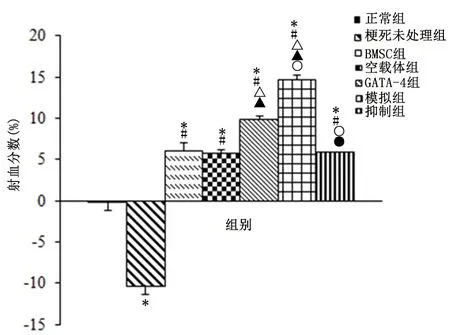
与正常组比较,*P<0.05; 与梗死未处理组比较,#P<0.05; 与BMSC组比较,△P<0.05; 与空载体组比较,▲P<0.05;与GATA-4组比较,○P<0.05;与模拟组比较,●P<0.05
2.5 RT-PCR检测各组心肌梗死后心肌细胞内心肌细胞特异性分子表达与正常组α-actin、CX43、Desmin、cTnT表达比较,梗死未处理组、BMSC组、空载体组、GATA-4组、模拟组、抑制组心肌细胞减少(P<0.05);而BMSC组、空载体组、GATA-4组、模拟组、抑制组较梗死未处理组增多(P<0.05);GATA-4组、模拟组心肌细胞较空载体组和BMSC组增多(P<0.05);模拟组心肌细胞表达较GATA-4组增多而抑制组较GATA-4组减少(P<0.05)。见表1。
表1 各组心肌梗死组织中α-actin、connexin-43、Desmin和cTnT表达比较
2.6 Western blot检测各组相同心肌梗死部位心肌细胞内miRNA-673-5p对应靶基因蛋白的表达与正常组比,梗死未处理组心肌细胞内Tsc-1的表达增多,GATA-4组和模拟组Tsc-1、Erk1/2、Mef2c 表达均减少(P<0.05);BMSC组、空载体组、GATA-4组、模拟组、抑制组心肌细胞内Tsc-1、Erk1/2、Mef2c 表达的表达较梗死未处理组减少(P<0.05); 与BMSC组比, GATA-4组Tsc-1和Erk1/2以及模拟组中Tsc-1、Erk1/2、Mef2c 表达均减少(P<0.05);GATA-4组Tsc-1和模拟组中Tsc-1、Erk1/2、Mef2c表达均较空载体组减少(P<0.05);与GATA-4组比,模拟组中Tsc-1的表达减少,抑制组心肌梗死心肌细胞内Tsc-1、Erk1/2、Mef2c表达增多(P<0.05)。抑制组心肌细胞内Tsc-1的表达较模拟组增多(P<0.05)。见图4,表2。
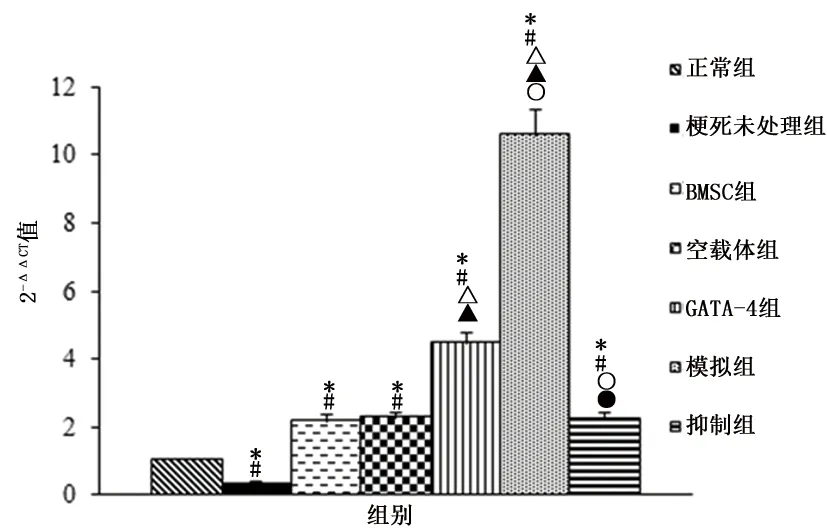
与正常组比较,*P<0.05; 与梗死未处理组比较,#P<0.05; 与BMSC组比较,△P<0.05; 与空载体组比较,▲P<0.05;与GATA-4组比较,○P<0.05;与模拟组比较,●P<0.05
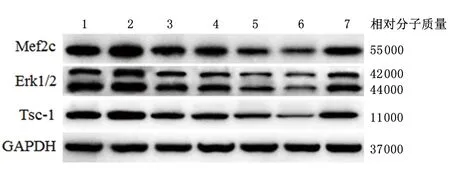
1:正常组; 2:梗死未处理组; 3:BMSC组; 4:空载体组; 5:GATA-4组; 6:模拟组; 7:抑制组
表 2 各组心肌梗死组织中Tsc-1、Erk1/2、Mef2c表达比较
3 讨 论
BMSC具有抗炎、抗凋亡作用[2-3]。GATA-4具有促性干细胞向心肌样细胞分化作用[4]。前期研究我们已经证明过表达GATA-4的BMSC分泌的外泌体可以通过促进BMSC向心肌样细胞分化、有效地修复心肌梗死引起的心肌损伤[1, 5-6]。进一步研究发现在其分泌的外泌体中miRNA-673-5p表达明显增高且功能涉及促分化,提示miRNA-673-5p可能是外泌体修复心肌损伤的关键分子[1]。
miRNA-673-5p是一个目前研究较少的microRNA。有研究结果表明,敲除单个miRNA(miRNA-673-5p)后,通过MAVS的调节作用可修复ESC中的抗病毒反应。miR-673-5p和MAVS之间的相互作用可以作为在多能性过程中抑制抗病毒IFN的转换,并提供增强其抗病毒免疫力的遗传途径[5]。Skeeles等[7]用MicroInspector、Patrocles和 microSNiPer评估并预测了ETV1和Ifrd1基因内的SNPs对miRNA结合位点的影响,并确定了11个SNPs与总共43个miRNA差异性结合。通过RNAhybrid和RNAcofold两种工具,确定了ETV1为miRNA-673-5p靶标,在两种小鼠品系预测差异中杂交自由能均大于5 kcal/joule MFE。课题组前期通过pathway通路发现miRNA-673-5p具有促细胞分化功能。故本实验通过建立小鼠心肌梗死模型,经尾静脉注射各处理组分泌的外泌体入心肌梗死模型小鼠体内,探讨miRNA-673-5p的功能及机制。实验结果表明,模拟组心肌梗死后心功能改善最为明显,其心肌细胞内miRNA-673-5p表达量最高。 提取相同部位心肌组织可见模拟组心肌细胞α-actin、CX43、Desmin、cTnT的含量最高。
本实验进一步采用miR Walk、Microt4、miRanda、mirbridge、miRDB、miRMap、miRNAMap、Pictar2、PITA、RNA22、RNAhybrid和Targetscan数据库对miRNA-673-5p的靶基因进行预测(筛选条件:靶基因总和≥10同时靶基因与miRNA的匹和度≥8),可见miRNA-673-5p对应的靶基因为:Mef2c,Erk1/2,Tsc-1。课题组进一步采用Western blot检测了心肌梗死心肌细胞内Mef2c、Erk1/2、Tsc-1蛋白的表达, 可见TSC1蛋白呈规律性下降,具有显著性差异。
TSC1和TSC2是肿瘤综合征TSC(结节性硬化症复合体)中突变的肿瘤抑制基因。它们的基因产物形成复合物,已成为许多信号转导研究人员关注的焦点[8-11]。有研究发现,由于TSC1或TSC2突变导致的错构瘤综合征,其中约60%的患者出现心脏横纹肌瘤[12]。在心脏组织和血管平滑肌中TSC1缺失的小鼠(TSC1c/cSM22 cre/-),发现进行性心脏扩大。小鼠(TSC1c/cSM22 cre/-)的心脏显示心肌细胞数量逐渐增加,并且1-6周龄时细胞数量增加较少。此外,与对照组心脏相比,小鼠(TSC1c/cSM22 cre/-)心肌细胞增殖标志物(磷酸化组蛋白H3和PCNA)在0-4周时升高,表明心肌细胞增殖是小鼠(TSC1c/cSM22 cre/-)心脏肥大的主要机制。心脏中TSC1的缺失会引起心脏扩大,这是由于心肌细胞增殖增加所致[13]。这与我们的研究一致,即TSC-1的下调可以引起心肌细胞数量增加。
哺乳动物雷帕霉素靶标蛋白(mammalian target of Rapamycin, mTOR)是进化上保守的丝氨酸/苏氨酸激酶,其在调节细胞生长和代谢中具有重要作用。在mTOR信号通路的研究中,结节性硬化症复合体(TSC)1/2被鉴定为mTOR活性的关键调节因子。 TSC1/2通过负调控mTOR信号通路在免疫细胞稳态和分化中发挥重要作用,TSC1/2-mTOR途径被证明是调节多种免疫细胞的免疫功能的中心点[14]。同时mTOR也是调节细胞生长,增殖和大小的中心原件。通过与复杂的信号传导途径网络的相互作用,调节广泛的生物学过程,包括自噬,蛋白质翻译,代谢,能量摄取,应激反应和免疫/炎症反应[15-16]。由于mTORC1的活性控制着合成代谢过程以促进细胞生长,它对细胞生长条件的变化非常敏感。课题组认为肿瘤形成的本质就是细胞增值,但心肌细胞的增值是否也是通过mTOR信号途径,值得进一步探索。通过细胞中许多磷酸化进程,TSC1-TSC2复合物已成为这些生长条件的传感器和整合体,传递来自不同细胞途径的信号以适当调节mTORC1活性。由于TSC1/2在mTOR信号传导中的重要作用,构建TSC1/2缺失或过表达的动物模型对于进一步理解mTOR信号传导在不同疾病和衰老中有重要意义[14]。敲低TSC1基因导致mTORC1依赖性线粒体呼吸增强[17]。也有研究表明,可能存在TSC1/2突变的谱系破坏内源基因功能,通过不同的机制抑制下游mTOR的活性,并导致肿瘤更具攻击性的行为。TSC突变细胞可降低雷帕霉素的集落形成能力[18]。
综上所述, miR-673-5p(+)-Tsc-1(-)-mTOR(+)途径可能是BMSCsGATA-4-外泌体促进心肌细胞分化,引起心肌细胞增值,进而修复心肌损伤的关键途径。作者将进一步检测mTOR的表达,证实此调控网络在细胞分化中的作用。

